淫羊藿苷抑制内质网应激介导HT22细胞抗谷氨酸诱导凋亡
王 臻,朱 婧,薛 彤,白 宁
(陕西省人民医院麻醉科,陕西 西安 710068)
谷氨酸(glutamate,Glu)是哺乳动物神经系统中含量非常丰富的兴奋性神经递质,通过突触间隙的相应受体,在神经元分化、生长、迁移等过程中发挥重要作用[1]。然而,Glu过度释放或堆积会引起神经元损伤,表现为兴奋性神经毒性,最终诱发神经系统疾病[2]。内质网是真核细胞的重要细胞器,主要负责蛋白的合成、分泌及降解;内质网功能异常会引发错误蛋白超载,即内质网应激(endoplasmic reticulum stress,ERS)[3]。活性氧(reactive oxygen species,ROS)是Glu致神经元损伤的另一主要机制[4],能通过介导ERS广泛参与神经系统退行性病变过程[5]。
淫羊藿苷(icariin,ICA)是小檗科植物淫羊藿的主要活性成分。有研究显示,ICA通过调节颗粒蛋白前体的表达减轻低浓度Glu诱导的HT22细胞损伤[6],然而ERS信号通路是否同样参与上述过程尚不清楚。因此,本研究筛选合理的ICA浓度,探讨ICA预处理对Glu介导的HT22细胞凋亡的保护作用及调控机制,旨在为ICA治疗神经系统损伤提供新的理论基础,现报告如下。
1 材料与方法
1.1 材料
细胞和主要试剂:小鼠海马神经元HT22细胞系于我院中心实验室保种,CCK-8试剂盒(七海复泰生物科技有限公司,上海),JC-1和ROS检测试剂盒(翊圣生物技术研究所,上海),TUNEL凋亡试剂盒(Roche公司,德国),DAPI(Sigma-Aldrich公司,美国),乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(建成生物工程研究所,南京),DMEM培养基和胎牛血清(Gibco公司,美国),青—链霉素双抗混合液(100×)和DMSO(索莱宝科技有限公司,北京),p-eIF2α、eIF2α、GRP78和CHOP抗体(Cell Signaling Technology公司,美国),Bcl2、Bax、β-actin抗体及CHOPsiRNA(SantaCruz公司,美国),辣根过氧化物酶标记的二抗(中杉金桥生物技术有限公司,北京)。
仪器:细胞培养箱(Thermo公司,美国),酶标仪(MolecularDevices,美国),高速低温离心机(艾本德公司,德国),激光共聚焦显微镜(奥林巴斯公司,日本),Western blot蛋白分离及成像系统(Bio-Rad公司,美国)。
1.2 方法
1.2.1 细胞培养 使用含10%胎牛血清的DMEM培养基,于37 ℃、5%CO2的饱和湿环境中常规培养HT22细胞,添加青霉素(100 U/mL)和链霉素(100 mg/mL)。每2 d换液1次,待细胞生长达90%左右时以0.25%胰酶消化传代,传代比例为1∶2。取对数生长期的细胞作为实验对象。
1.2.2 药物处理和实验分组 ICA以DMSO助溶配成母液,于4 ℃保存,用时以无血清的DMEM培养基稀释(DMSO<0.1%)。首先,检测不同浓度ICA(0.1~100 μmol/L)处理24 h后对HT22细胞的毒性作用,最终选择浓度5 μmol/L和10 μmol/L用于后续实验。随后,将细胞分为对照组、Glu损伤组、低剂量ICA+Glu(L-ICA+Glu)组和高剂量ICA+Glu(H-ICA+Glu)组。根据毒性试验结果分别给予L-ICA+Glu组和H-ICA+Glu组低浓度(5 μmol/L)和高浓度(10 μmol/L)ICA预处理24 h后[7-8],加入Glu(5 mmol/L)继续孵育18 h[9];Glu损伤组单纯用Glu处理18 h;对照组则以等体积的无血清DMEM培养基稀释液(DMSO<0.1%)孵育18 h。
1.2.3 CCK-8法检测细胞活性 将HT22细胞以2×104个/孔接种于96孔板,每组设5个复孔。按照1.2.2方法处理后,弃培养基,PBS缓慢冲洗。每孔加入100 μL无血清的DMEM和10 μL的CCK-8试剂混合液,37 ℃孵育2 h后,于450 nm波长处测定吸光度(opticaldensity,OD)。以对照组结果为100%。
1.2.4 比色法检测细胞LDH释放量 将HT22细胞以1×106个/孔接种于6孔板,按1.2.2方法处理后,收集上清培养基,并转移至96孔板内,每组设5个复孔。每孔加入50 μL反应底物,37 ℃孵育30 min,加入等量终止液。室温放置3 min,于440 nm波长处测定吸光值。对照组的值设为1。
1.2.5 TUNEL染色显示凋亡细胞 将HT22细胞以3×105个/孔接种于24孔板内制作细胞爬片,并按1.2.2方法处理后,4%多聚甲醛室温固定10 min,并以Triton X-100溶液(0.1%)于室温孵育10 min。严格按照试剂盒步骤对细胞进行TUNEL染色[5],并用DAPI溶液(1 μg/mL)室温、避光复染细胞核10 min。甘油封片后,激光共聚焦显微镜下计算随机10个视野中的细胞凋亡率,凋亡率=绿色细胞数/蓝色细胞数×100%。
1.2.6 JC-1染色检测线粒体膜电位(mitochondrial membrane potential,MMP)变化 调整HT22细胞密度为3×105个/孔,接种至24孔板中,并制作细胞爬片。按1.2.2方法处理后,弃培养基,PBS洗涤、备用。按照每50 μL的JC-1(200×)加入8 mL超纯水的比例稀释JC-1原液,剧烈振荡;然后再加入2 mL的JC-1染色缓冲液(5×),混匀后即为JC-1染色工作液。向各孔中加入400 μL JC-1染色工作液和等体积的细胞培养液,37 ℃避光孵育20 min。激光共聚焦显微镜下观察染色结果,并用Image J分析结果。
1.2.7 DCFH-DA检测细胞ROS含量 用无血清DMEM培养液将DCFH-DA稀释成10 μmol/L的工作液。将HT22细胞以3×105个/孔接种于24孔板内制作细胞爬片,按1.2.2方法处理后,取一定量的上述工作液覆盖于处理后的细胞爬片,37 ℃避光孵育20 min,并以无血清DMEM培养液洗涤细胞2次。于488 nm激发波长和525 nm发射波长处测定荧光强度,单纯DCFH-DA溶液用做调零,Image J分析结果,对照组的值设为1。
1.2.8 细胞转染 HT22细胞以0.5×106个/孔接种于6孔板,根据既往文献报道[10],严格按照转染说明书,对细胞进行操作,转染48 h后,Western blot检测目的蛋白的表达情况。随后分为Glu+ControlsiRNA组、Glu+CHOPsiRNA组、H-ICA+Glu+ControlsiRNA组、H-ICA+Glu+CHOPsiRNA组,经ICA(10 μmol/L)和Glu处理后,再次检测细胞活性、凋亡率、ROS含量、凋亡相关蛋白表达以及MMP水平。
1.2.9 Western blot检测关键蛋白的表达 制备处理后的细胞裂解液,分别提取总蛋白。定量后,高温变性,取20 μg蛋白液行SDS-PAGE(8%)电泳,将蛋白转移至硝酸纤维素膜上,加入含5%脱脂奶粉的TBST缓冲液中,室温封闭2 h,分别加入一定浓度的一抗(p-eIF2α、eIF2α、GRP78和CHOP为1∶1 000,Bcl2、Bax和β-actin为1∶500),于4 ℃孵育过夜。加入相应的二抗(1∶5 000)室温孵育2 h,电化学发光法显影,并用软件Image Lab 5.1分析蛋白的相对表达量。
1.3 统计学方法

2 结果
2.1 ICA对Glu诱导HT22细胞损伤后细胞活性的影响
过量的Glu具有明显的神经毒性,以浓度为5 mmol/L的Glu作用18 h后能够显著抑制HT22细胞增殖,见图1。光镜下发现,与对照组相比,Glu损伤组细胞表现为皱缩、变圆、折光性增强,并可见大量悬浮体;ICA预处理24 h有效缓解上述情况。CCK-8结果进一步提示,Glu损伤组细胞活性明显较低,ICA干预明显提高损伤后各组细胞活性,并呈剂量依赖性(P<0.05)。提示ICA可以减轻Glu对HT22细胞的抑制。
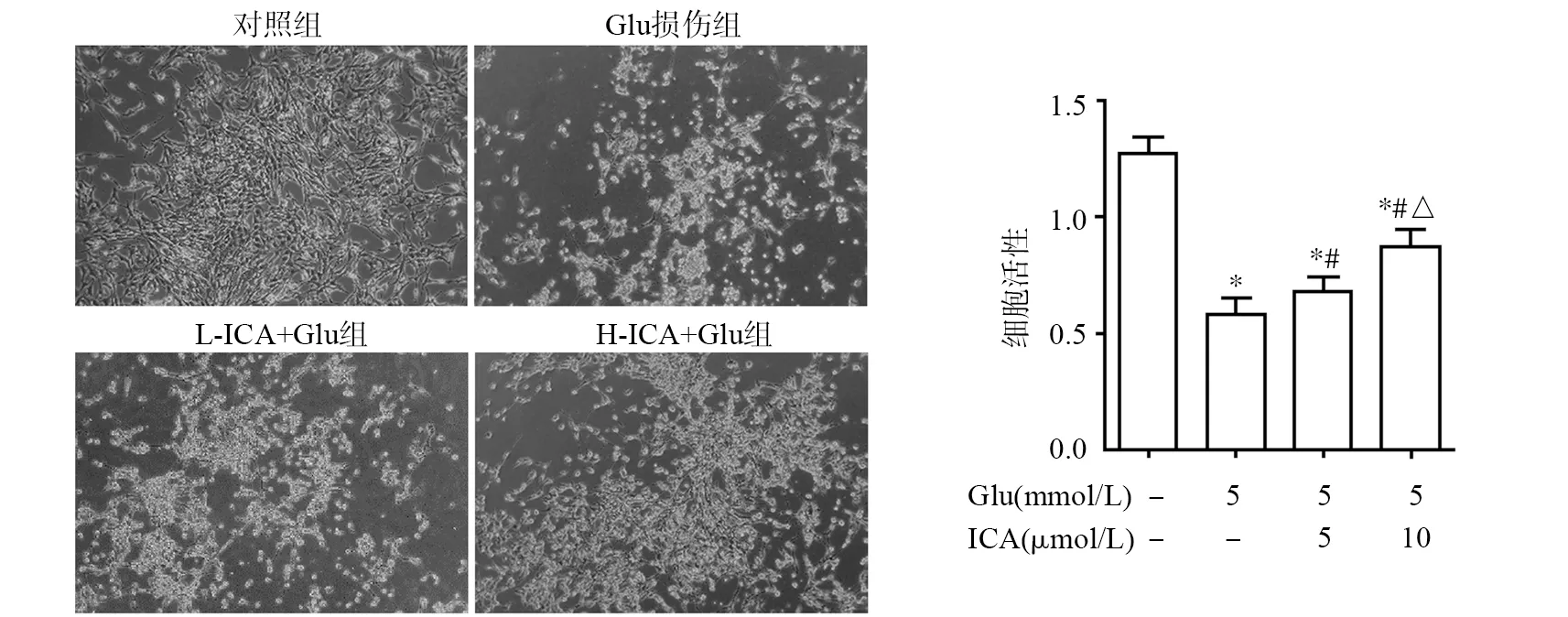
*:与对照组比较,P<0.05;#:与Glu损伤组比较,P<0.05;△:与L-ICA+Glu组比较,P<0.05
2.2 ICA对Glu诱导HT22细胞损伤后LDH释放和凋亡的影响
Glu损伤组中LDH的释放量明显增加(P>0.05),ICA可降低LDH的释放量,以H-ICA+Glu组最明显(P<0.05),见图2a。TUNEL染色提示,Glu(5 mmol/L)处理18 h后HT22细胞中绿色荧光所占的比例增加(P<0.05),而ICA(5、10 μmol/L)均能有效降低细胞凋亡率,且呈剂量依赖性(P<0.05),见图2b。说明ICA能显著抑制Glu诱导HT22细胞分泌LDH以及凋亡。
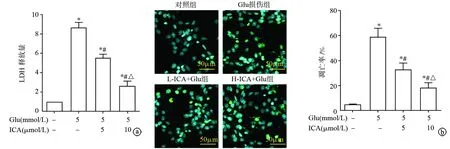
a:LDH释放量;b:细胞凋亡率(绿色表示凋亡细胞,蓝色表示细胞核) *:与对照组比较,P<0.05;#:与Glu损伤组比较,P<0.05;△:与L-ICA+Glu组比较,P<0.05
2.3 ICA对Glu诱导HT22细胞损伤后MMP变化和ROS含量的影响
实验结果显示,对照组细胞以红色荧光为主;Glu损伤组红色荧光减弱,绿色荧光增强,提示MMP明显降低(P<0.05);L-ICA+Glu组和H-ICA+Glu组绿色荧光受到抑制,红色荧光增加(P<0.05),见图3a。Glu提高HT22细胞中ROS的表达量,表现为绿色荧光增加(P<0.05),ICA预处理则显著降低其表达量(P<0.05),见图3b。以上结果提示,ICA对Glu诱导的HT22细胞线粒体氧化应激损伤具有一定的保护作用。
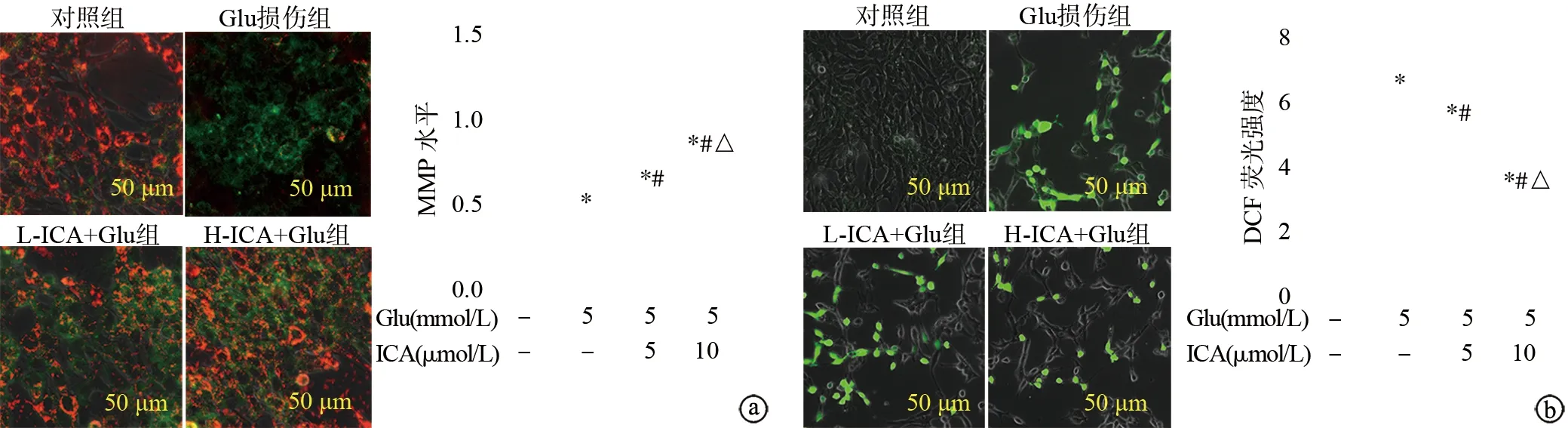
a:MMP水平(红色表示高MMP,绿色表示低MMP);b:DCF荧光强度(绿色表示ROS阳性) *:与对照组比较,P<0.05;#:与Glu损伤组比较,P<0.05;△:与L-ICA+Glu组比较,P<0.05
2.4 ICA对Glu诱导HT22细胞损伤后ERS及凋亡信号通路的影响
相对于对照组,Glu损伤组p-eIF2α、GRP78和CHOP表达量增加;同时抗凋亡蛋白Bcl2下调,促凋亡蛋白Bax上调(P<0.05);不同浓度(5 μmol/L和10 μmol/L)的ICA能显著抑制ERS的激活,表现为下调p-eIF2α、GRP78和CHOP的表达,Bcl2表达增加,Bax表达降低,Bcl2/Bax比值升高(P<0.05),见图4。提示ICA可有效抑制Glu诱导HT22细胞中ERS及凋亡相关蛋白的活性。
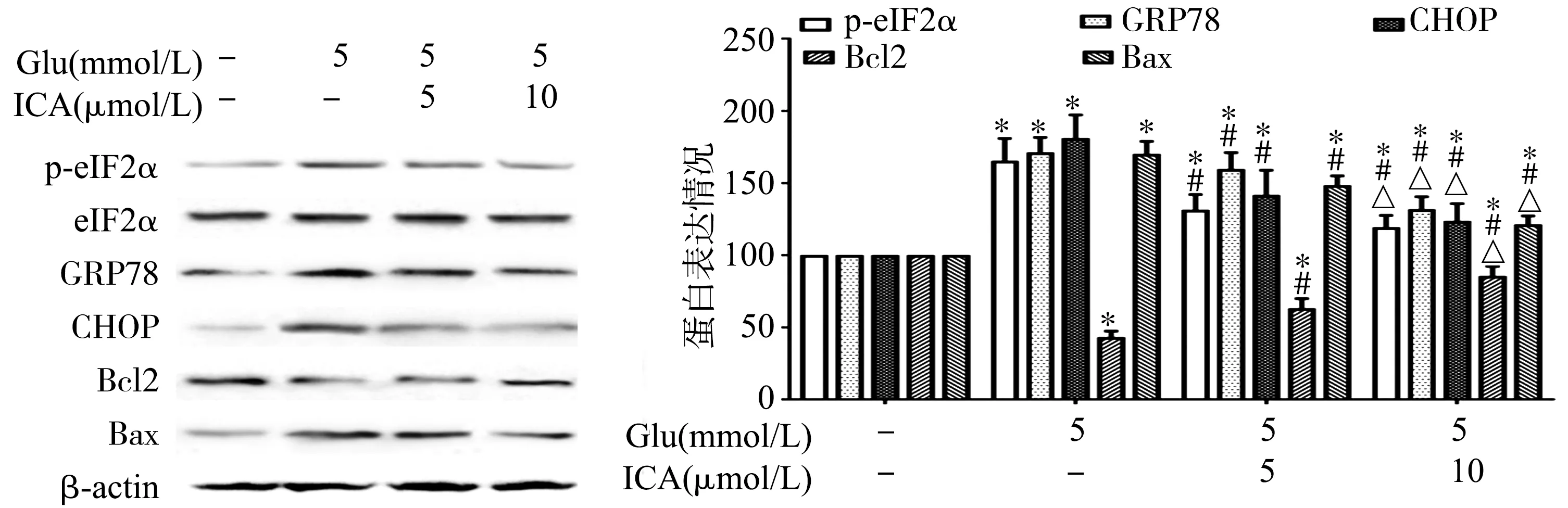
*:与对照组比较,P<0.05;#:与Glu损伤组比较,P<0.05;△:与L-ICA+Glu组比较,P<0.05
2.5 抑制CHOP对ICA保护HT22细胞抗Glu损伤的影响
与Control siRNA组比较,CHOP siRNA组CHOP蛋白表达明显受到抑制(P<0.05),见图5a。同时,与Glu+ControlsiRNA组比较,H-ICA+Glu+ControlsiRNA组细胞活性更高(P<0.05),细胞TUNEL阳性率更低(P<0.05),细胞MMP水平更稳定(P<0.05),细胞ROS活性更弱(P<0.05),见图5b~e。同时,降低CHOP表达能够有效增强ICA对Glu损伤HT22细胞后的保护作用,表现在相对于H-ICA+Glu+ControlsiRNA组,H-ICA+Glu+CHOPsiRNA组细胞活性和MMP水平升高(P<0.05),凋亡率和ROS活性降低(P<0.05),见图5b~e。此外,Western blot结果显示,联合应用ICA和CHOP siRNA可以进一步下调ERS相关蛋白(p-eIF2α、GRP78和CHOP)及Bax的表达,上调Bcl2的表达(P<0.05),见图5f。表明抑制ERS通路可以明显敏化ICA对Glu诱导HT22损伤的保护作用。
3 讨论
神经系统疾病是危害人类健康的常见病和多发病,不仅致死率高,而且其后遗症给患者家庭和社会带来沉重的负担[11]。神经元是神经系统的基本组成单位,机体内外的多种损伤因素均可以引起神经元功能紊乱。Glu是重要的兴奋性神经递质,高浓度Glu能够激活突触后膜的相应受体,通过改变细胞内离子浓度(如Ga2+)或者氧化应激水平,诱导神经元凋亡[12]。HT22细胞是永生化的小鼠海马神经元,因缺乏离子型Glu受体[13],而常用于研究Glu的氧化应激损伤[14]。有研究表明,Glu通过竞争性抑制半胱氨酸摄取,导致细胞谷胱甘肽耗竭和ROS累积而诱导凋亡[15]。因此,有效地逆转上述过程是治疗神经系统疾病的关键,探索新的神经保护方法以及潜在的调控机制,成为目前该领域研究的热点。

a:CHOP蛋白表达;b:细胞活性;c:凋亡率;d:MMP水平;e:DCF荧光强度;f:ERS(p-eIF2α、GRP78和CHOP)及凋亡相关蛋白(Bcl2和Bax)表达情况 *:与Control siRNA组比较,P<0.05;#:与Glu+ControlsiRNA比较,P<0.05;△:与Glu+CHOPsiRNA组比较,P<0.05;▲:与H-ICA+Glu+ControlsiRNA组比较,P<0.05
ICA是小檗科植物淫羊藿的主要活性成分,传统医学认为其具有益精气、坚筋骨、补腰膝、强心力的功效[16]。而现代医学研究发现,ICA是含有8-异戊烯基的黄酮醇苷类化合物,具有更广泛的药理学作用,包括抗癌、增强免疫、调节内分泌及改善心脑血管功能等[17-18]。近年来,ICA对神经系统的保护作用受到广泛的关注。Li等[19]的研究证实,ICA调节乙酰-α-微管蛋白和磷酸化的微管蛋白结合蛋白Tau,修复受损的细胞网络骨架并恢复磷酸化蛋白激酶B,介导大鼠皮质神经元抗高半胱氨酸的毒性反应。重要的是,ICA通过突触间隙的Glu受体在大鼠抑郁症模型中发挥保护作用[20]。因此,ICA具有多种神经保护作用;然而,其对Glu诱导的神经损伤的调控机制未见报道。因此,本研究以Glu预处理HT22细胞构建氧化应激诱导的凋亡模型,探讨ICA对其拮抗作用。结果显示,Glu(5 mmol/L)处理18 h可引起HT22细胞活性降低以及凋亡和LDH分泌增加,与以往研究一致[21-22]。不同浓度(5 μmol/L和10 μmol/L)的ICA显著增加细胞活性并降低凋亡率和LDH释放量,说明ICA具有抗Glu诱导的HT22细胞凋亡作用。
线粒体是细胞进行氧化磷酸化、合成三磷酸腺苷的主要场所,在细胞能量代谢中扮演重要角色[23]。线粒体功能损伤后可使呼吸链障碍、膜电位去极化、三磷酸腺苷合成减少等,干扰正常的细胞代谢[23]。线粒体既是ROS产生的主要场所,也是ROS攻击的靶器官,因而在其损伤后会产生放大效应,最终导致细胞死亡[23]。JC-1是一种广泛用于检测线粒体MMP的理想荧光探针。正常情况下,JC-1聚集在线粒体内,可以产生红色荧光;线粒体损伤后,JC-1外漏并以单体形式存在,发出绿色荧光。目前常用红绿荧光的相对比例来衡量线粒体去极化的比例[24]。本研究荧光检测显示,Glu明显诱导MMP降低,同时引起细胞内ROS堆积,ICA预处理能有效逆转上述变化,说明ICA具有清除过度ROS的功能[25],进而提高线粒体膜的稳定性,发挥抑制细胞凋亡的作用。
PERK-eIF2α-CHOP是ERS重要的调控通路[26]。静息状态下,PERK与GRP78相互结合处于稳态;当内质网内的错误蛋白增多,PERK解离并激活,磷酸化下游分子eIF2α,并上调CHOP分子入核诱导凋亡[27]。已有研究证实,CHOP可以通过抑制抗凋亡蛋白(如Bcl2)和活化多种促凋亡蛋白(如Bax、Bak)发挥作用[28-29]。此外,ROS介导的ERS是Glu损伤神经元的重要分子病理基础[15],可能与凋亡相关蛋白促进MMP去极化有关[30]。本研究显示,经ICA处理后,HT22细胞中p-eIF2α、GRP78和CHOP的表达明显降低,而Bcl2/Bax比值增加。以上结果说明,ICA能有效阻断HT22细胞中Glu诱导的氧化应激反应及ERS,进一步稳定线粒体功能,从而抑制凋亡发生。更重要的是,本研究应用siRNA特异性抑制效应分子CHOP后,ICA的作用明显增强,提示ICA部分通过下调PERK-eIF2α-CHOP介导HT22细胞抗Glu诱导的氧化应激反应性凋亡。
综上,ICA可以保护神经元,其作用机制一定程度上与抑制细胞ROS堆积,进而抑制ERS信号通路激活,最终稳定MMP水平并恢复其功能,以减轻细胞凋亡有关(图6);然而,其具体作用机制仍需深入研究。
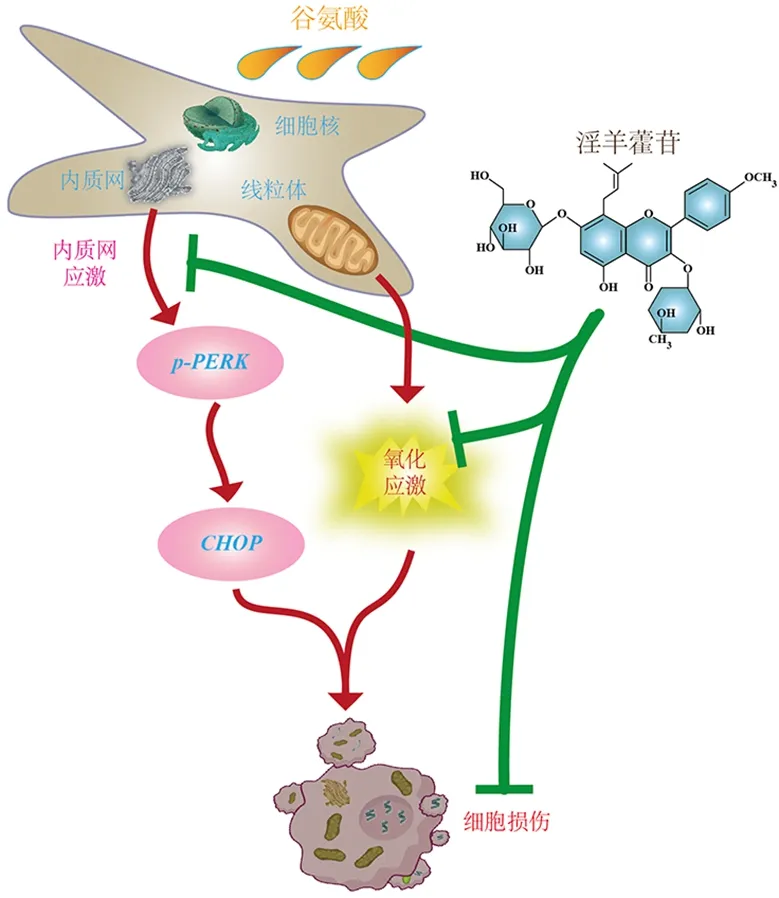
图6 ICA通过抑制ERS通路保护HT22细胞抗Glu损伤的机制图

