丙酮酸缩对硝基苯甲酰腙/MCM-41的吸附性能
陈凤英,李海英,段玉荣
(商洛学院化学工程与现代材料学院/陕西省尾矿资源综合利用重点实验室,陕西商洛 726000)
当前,水的品质和水资源紧缺越来越受到全球关注[1-2],从污染水中去除有害重金属离子也随之成为世界性环保研究热点课题[3-4]。重金属离子通过直接饮水、食用被污水浇灌过的蔬菜等途径,很容易进入人体内,进而导致人体细胞发生癌变、畸形或突变。铜虽然是人体健康不可缺少的微量营养素,但是当其在动植物体内积累到一定数量后,动植物会出现生理受阻、发育停滞等症状,甚至造成动植物死亡[5]。去除水体中重金属离子的方法主要有化学沉淀法[6-7]、离子交换法[8-9]、吸附法[10-11]等。由于吸附法去除重金属离子具有成本相对低廉,操作简单等优点,被广泛应用于净化含有重金属离子的废水[10-12]。有序介孔分子筛MCM-41具有较大的比表面积、分布较窄的孔径、规整的孔道等特征、非常易于引入功能化基团,常作为吸附剂使用,引起了人们高度的关注[13]。介孔分子筛对重金属的吸附主要是依靠表面的官能团与水体中重金属离子之间发生螯合作用,形成配位化合物,故经改型后的介孔分子筛材料通常会表现出吸附效果的显著变化[14-17]。因此,本文设计合成了丙酮酸缩对硝基苯甲酰腙修饰的MCM-41分子筛,采用热重和XRD对修饰后的分子筛进行表征,测试了其对铜离子的吸附性能。
1 材料与方法
1.1 试剂与仪器
丙酮酸为生化试剂,对硝基苯甲酰肼、CTAB、TEOS、NaOH、N,N-二甲基甲酰胺(DMF)均为分析纯。红外光谱仪(美国Nicolet 5700型,KBr压片),CN61M/AA-7002A原子吸收光谱仪,NETZACH STA449C同步热分析仪,X'Pert PRO型X射线衍射分析仪。
1.2 丙酮酸缩对硝基苯甲酰腙(PNH)的合成
准确称取1 mmol对硝基苯甲酰肼置于到三颈烧瓶中,加入100 mL无水乙醇,磁力搅拌使对硝基苯甲酰肼完全溶解,用胶头滴管缓慢将1.1 mmol的丙酮酸滴加到烧瓶中,80℃水浴加热反应6 h,冷却,过滤得粗产品。用无水乙醇重结晶,得到淡黄色晶体。
1.3 MCM-41分子筛的制备
MCM-41分子筛的制备参考了文献[11]。将 CTAB溶解在 2 mol·L-1的 NaOH溶液中,室温搅拌下加入TEOS反应1 h后,将反应物转移到100 mL反应釜中,设置晶化温度为100℃,晶化时间为3 d。产物经过滤、洗涤、干燥,最后在550℃焙烧6 h,即得MCM-41介孔分子筛。
1.4 MCM-41分子筛的功能化
称取0.25 g的PNH用N,N-二甲基甲酰胺配制成90 mL溶液,称取1.0 g的MCM-41分子筛加入到PNH溶液中,室温下搅拌24 h,过滤,用少量N,N-二甲基甲酰胺和蒸馏水洗涤,空气氛中干燥得到丙酮酸缩对硝基苯甲酰腙功能化分子筛(PNH/MCM-41)。
1.5 吸附铜离子的方法
向锥形瓶中加入一定体积的铜离子模拟废水和适量的PNH/MCM-41,磁力搅拌吸附一段时间后,取上层清液离心、过滤、用原子吸收光谱检测溶液中铜离子浓度,计算得到吸附剂的吸附容量(Q)与铜离子的去除率(E):

式中:C0为铜离子起始浓度(mg·g-1),Ce为铜离子剩余浓度(mg·g-1),V为铜离子溶液的试验体积(L),m 为吸附剂质量(g),Q 为吸附容量(mg·g-1)。
2 结果与分析
2.1 XRD表征
图1是MCM-41的XRD图谱,XRD测试的靶材为CoKα,管电压为35 KV,管电流为35 mA,扫描速度为2(°)·min-1,扫描范围为2θ=1.5°~6°。从图1可以看出,在 2θ=2.3°附近有一个强的吸收峰,这是对应于MCM-41的100晶面反射峰,说明材料有着六方排列的结构。此外,图谱在2θ=3°~4°和 2θ=4°~5°时还有两个较弱的吸收峰,分别对应于MCM-41的110和200晶面反射,说明所得材料为MCM-41分子筛。

图1 MCM-41的XRD图谱
2.2 PNH在MCM-41上的负载量
图 2 是 MCM-41(a)和 PNH/MCM-41(b)在氮气气氛中,升温速率为10℃·min-1的热重曲线。从图2中可以看出,MCM-41失重达到平衡时,质量减少约为8.0%,这对应MCM-41表面和孔道内吸附水的离去。PNH/MCM-41的TG曲线显示,失重达到平衡时,失重率约为19.3%,因此PNH在MCM-41上的负载量约为11.3%。
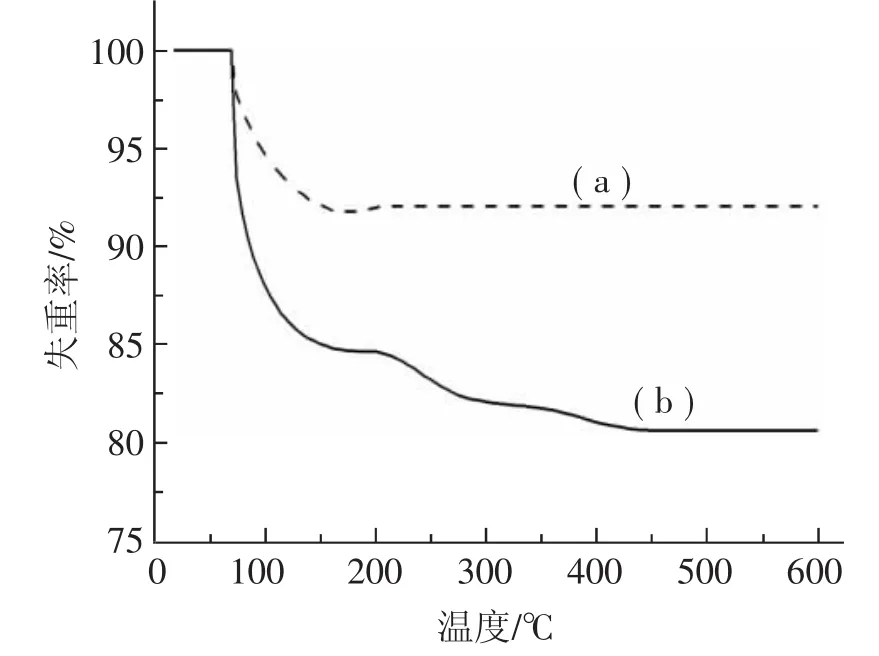
图2 吸附剂的TG曲线
2.3 吸附时间对铜离子去除率的影响
向5个不同编号的锥形瓶中分别加入C0=50 mg·L-1的铜离子溶液 25 mL和 0.02 g PNH/MCM-41,在室温条件下,磁力搅拌吸附10,20,30,40,50 min 后取上层清液,用原子吸收光谱测定铜离子浓度,根据式(1)计算去除率,所得结果如图3所示。从图3可以看出,吸附初期,去除率因吸附时间的延长而增大,40 min后去除率基本不再改变,因此本研究将吸附时间选定为40 min。

图3 去除率随吸附时间的变化
2.4 温度对铜离子去除率的影响
向5个不同编号的锥形瓶中分别加入C0为50mg·L-1的铜离子溶液25mL和0.02gPNH/MCM-41,设置吸附温度分别为20℃,25℃,30℃,35℃,40℃,吸附时间40 min。取上层清液,用原子吸收光谱测定铜离子浓度,根据式(1)计算去除率,所得结果如图4所示。从图4可以看出,在20℃~35℃时,温度的升高会使去除率持续增大,并在35℃时达到峰值,然后逐渐下降。这是由于温度会使正反应和逆反应速率同时加快,但是在温度较低时,正反应的速率增大较快,去除率增大,当温度升高到一定程度,逆反应速率增大占据了主导地位,从而引起去除率下降[12]。
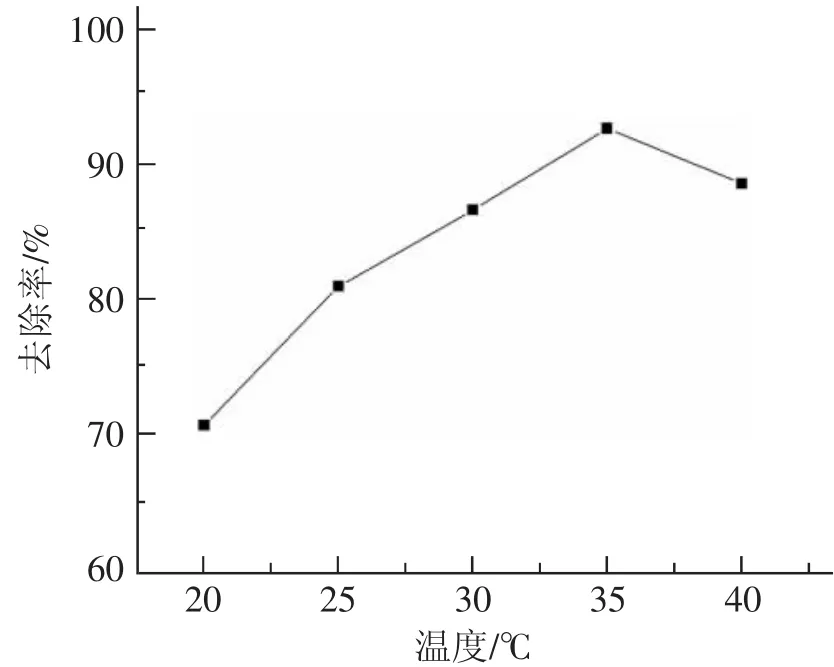
图4 去除率随吸附温度的变化
2.5 吸附剂用量对去除率的影响
向5个不同编号的锥形瓶中分别加入铜离子浓度为50 mg·L-1的溶液25 mL和0.02,0.04,0.06,0.08,0.10 g PNH/MCM-41,设置吸附温度为35℃,磁力搅拌吸附40 min。取上层清液,用原子吸收光谱测定铜离子浓度,计算去除率,所得结果见图5。从图5可以看出,当吸附剂用量为0.02~0.06 g时,去除率与吸附剂用量正相关,当吸附剂用量大于0.06 g时,去除率基本保持不变。这是由于在反应的初期阶段,单分子层吸附重金属离子会快速达到饱和,表现为较大的去除率;当吸附剂用量大于0.06 g后,吸附剂超过吸附平衡时所需要的量,表现为去除率基本不变。因此,吸附剂最佳应用量为0.06 g。
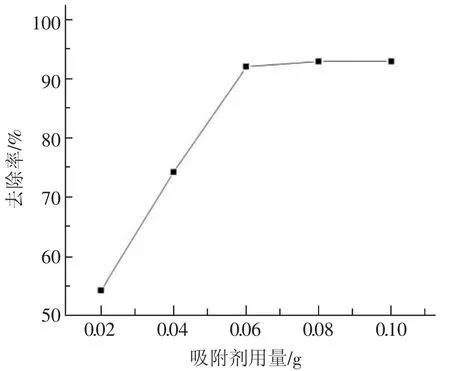
图5 PNH/MCM-41用量对去除率的影响
图6是根据实验所测得的不同温度下的吸附量,利用式(3)和式(4)的吸附热力学参数计算公式,拟合得到的ln(qe/Ce)~1/T关系曲线,对吸附过程的ΔH、ΔS以及不同温度下的ΔG进行了求算,所得结果如表1所示。PNH/MCM-41对铜离子的吸附过程的ΔH<0,说明该吸附过程是一个放热过程;ΔS<0,说明PNH/MCM-41与铜离子的反应是一个熵减小的反应。吸附过程熵减小是由于在初始状态,铜离子杂乱无章地排列在溶液中,混乱度较大,吸附完成时,绝大多数的铜离子被吸附并固定到吸附剂表面不能自由移动,混乱程度减小,导致熵减小。ΔG<0,说明在实验温度下吸附过程可以自发进行。


表1 HL/MCM-41吸附铜离子的热力学参数
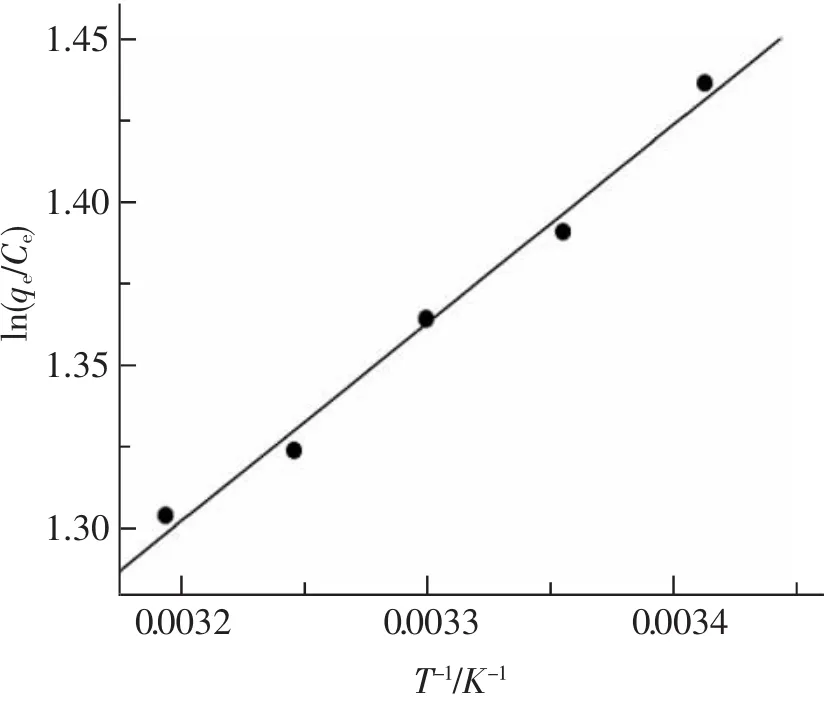
图6 ln(qe/Ce)与1/T的关系
3 讨论与结论
在碱性条件下制备出MCM-41分子筛,采用物理浸渍法制备出PNH负载量为11.3%的PNH/MCM-41吸附剂。通过考察吸附时间、吸附温度、吸附剂用量等因素对去除率的影响,得到了PNH/MCM-41对铜离子吸附的最佳条件:吸附时间为40 min、温度为35℃,吸附剂用量为0.06 g,最大去除率为93%,吸附过程是一个自发的、熵减、放热过程。PNH/MCM-41对金属离子的去除主要是通过PNH对金属离子的螯合作用将金属离子固定到吸附剂上,去除率的高低与PNH的负载量有密切关系。因此,适当提高功能化试剂的负载量将会是提高该类吸附剂性能的一个较为关键的因素。

