金天格胶囊对他莫昔芬治疗的乳腺癌患者的骨密度及 骨代谢干预研究
叶春伶,唐翔
(北京市回民医院外科,北京 10054)
0 引言
全世界范围内,乳腺癌占女性恶性肿瘤的比例约为25%,我国近年来约有30万例/年新发病例。[1]以往的研究表面,乳腺癌细胞本身可能存在抑制成骨细胞活性,诱导破骨细胞活性增加的作用,引起骨质疏松。[2]以他莫昔芬为代表的内分泌治疗药物,是目前乳腺癌最常用的内分泌治疗药物,由于其抗雌激素作用,可能引起骨质疏松。[3]回顾以往的研究,发现尚无对乳腺癌患者的骨代谢与骨密度利用金天格干预并进行研究的先例。本研究以我院乳腺癌患者作为研究对象,进行了相应分析。研究已经我院伦理委员会的批准。
本研究使用的骨代谢指标主要包括以下几项:骨钙素(bone gamma-carboxyglutamic-acid-containing proteins,BGP),Ⅰ型前胶原羧基末端肽(procollagen type I carboxyterminal peptide,PICP),维生素D(Vitamin D,VD),甲状旁腺素(parathyroid hormone,PTH)。骨密度应用所测的超声速度绝对值(Speed of Sound,SOS)的中位数进行比较。
1 资料与方法
1.1 病例资料
2014年1月至2018年12月在我院外科进行乳腺癌根治术的女性,年龄42-65岁,平均(51.45±3.17)岁,总数209例。
完成本项研究的乳腺癌患者共106例,入选患者平均年龄(50.65±3.09)岁,所有患者均进行为期1年的随访。
1.2 方法
(1)病例入选标准,符合以下条件:
a术后病理为乳腺癌及雌激素受体阳性;
b接受他莫昔芬的内分泌治疗;
c依从性好,签署知情同意书,能配合完成检查;
d排除其他自身免疫性疾病;
e排除曾服用维生素D、钙片、双膦酸盐等改善骨代谢药物;
f排除妇科内分泌疾病史;
g排除骨质疏松病史;
(2)研究时间窗:2014年1月至2018年12月
1 根据入选条件筛选患者;
2 签署知情同意书,按照统计人员预先编排入组顺序,盲法编入药物组(组A),对照组(组B);
3 所有入选组A及组B的女性于T1(入组时),T2(6个月),T3(1年)分别抽血检查甲状腺功能、骨代谢;于T3检测一次骨密度。
4 组A及组B入组成员均于入组当日即开始服用药物或安慰剂,持续用药1年。
(3)检测项目
a骨代谢:采用骨代谢4项试剂(罗氏诊断产品(上海)有限公司),商品名骨代谢标志物质控液,可以检测PTH、BGP、VD、PICP4项。
b超声骨密度:检测项目为腕关节SOS值,设备为M402348超声骨密度仪,美国Sahara出品。
(4)使用药物
药物组(组A):金天格(金花企业(集团)股份有限公司),规格0.4g*36粒,药物批号:Z20030080。用药方式为口服,1日3次,每次3粒共1.2g,除金天格药物外不再使用改善骨代谢的药物或钙片。
对照组(组B):由金花企业(集团)股份有限公司提供不含有效成分,但包装完全相同的安慰剂,口服,1日3次,每次3粒共1.2g,除金天格药物外不再使用其他改善骨代谢药物或钙片。
1.3 统计方法
本研究所有数据采用SPSS 16.0软件进行数据处理。
组A与组B这2组,分别在T1、T2、T3这3个时间段的组间骨代谢指标的组间差别,采用方差分析进行比较,并以P<0.05为有统计学意义。
组A与组B各自组内骨代谢指标从T1至T3的变化,使用方差分析比较,以P<0.05为有统计学意义。
比较组A与组B的在T3的组间骨密度变化,使用成组t检验分析2组之间是否存在差别,以P<0.05为有统计学意义。
2 结果
组A最终入组55名,年龄(50.01±4.14)岁;
组B最终入组51名,年龄(51.09±5.07)岁。
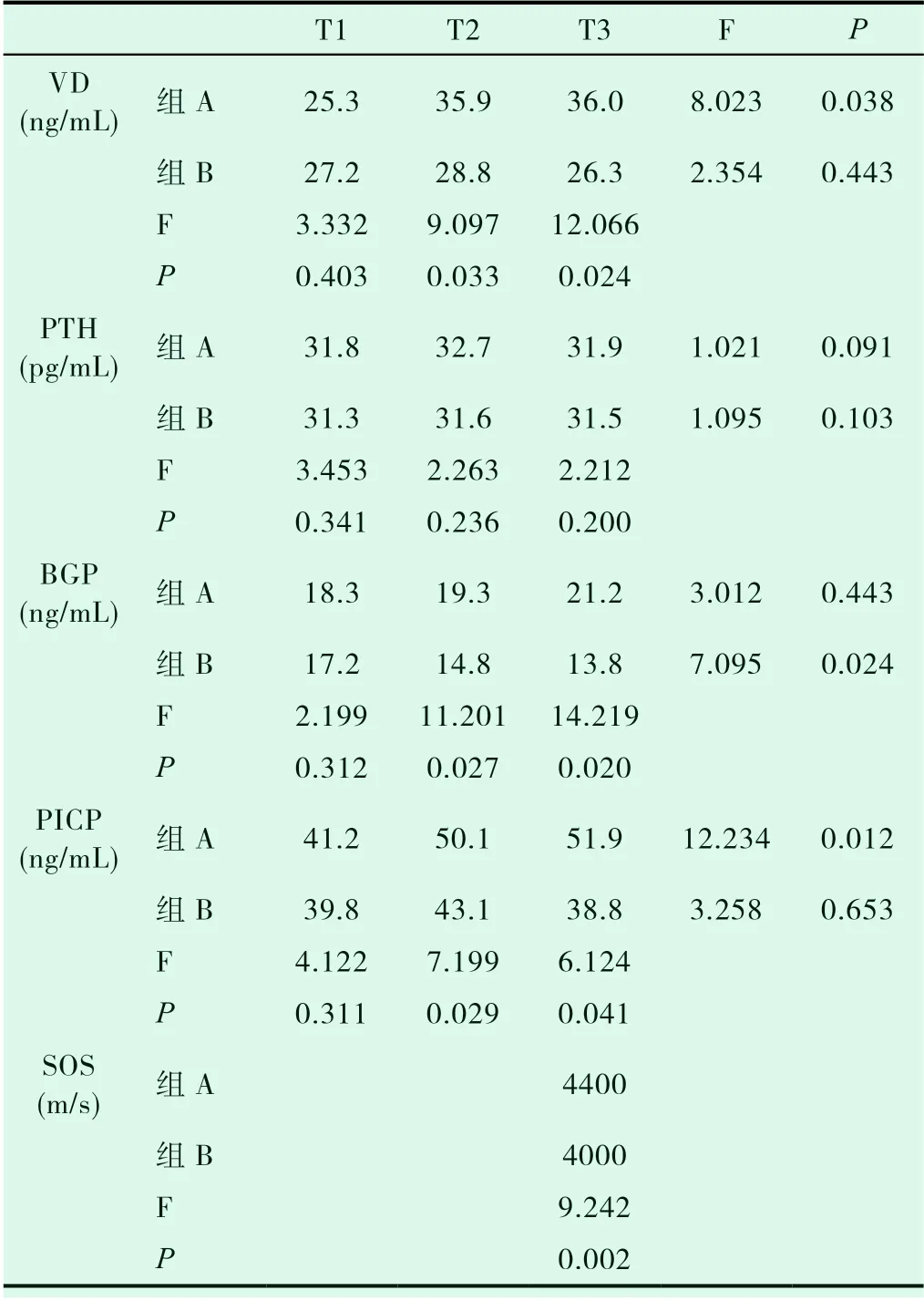
表1 组A与组B的骨代谢及超声骨密度比较
VD在T1时,2组的VD值无组间的统计学差别(P>0.05),T2及T3时均有组间的统计学差别(P<0.05)。组A在T1至T3有统计学差异(P<0.05),组B在T1至T3无统计学差异(P>0.05)。
PTH在T1-T3这3个时间段,2组的PTH值均没有组间的统计学差别(P>0.05),2组组内在T1-T3也无统计学差异(P>0.05)。
BGP在T1-T3这3个时间段,组A的BGP 值均没有组内的统计学差别(P>0.05),组B的BGP值组内有统计学差异(P<0.05)。2组BGP值组间在T1无统计学差异(P>0.05),T2及T3均存在组间差异(P<0.05)。
PICP在T1时,2组的PICP 值无组间的统计学差别(P>0.05),T2及T3时均有组间的统计学差别(P<0.05)。组A在T1至T3有统计学差异(P<0.05),组B在T1至T3无出统计学差异(P>0.05)。
SOS值在T3时,组A与组B的骨密度有统计学差别(P<0.05)。
3 讨论
以往的研究提示,乳腺癌患者与非乳腺癌患者相比存在骨密度下降。[4]机制可能是乳腺癌细胞对成骨细胞与破骨细胞均存在调节作用。癌细胞分泌相关因子通过与成骨细胞与破骨细胞细胞膜表面的受体结合直接调节骨代谢。破骨细胞水平升高,成骨细胞水平减低,骨转换周期减慢,从而导致骨量丢失,出现骨质疏松。[5]他莫昔芬作为雌激素抑制剂,进一步加剧了骨量流失,降低了骨密度[6]。
本研究采用的骨代谢各项指标主要临床意义分别在于以下几个方面:PTH则反映了破骨细胞活性。[7]当PTH增高时可表现为骨骼强度下降。[8]VD促进钙质利用,抑制甲状旁腺素分泌,[9]当发生VD缺乏易导致骨量流失。[10]PICP是占骨有机基质的90%的Ⅰ型胶原合成的前体,[11]其他研究提示PICP与骨形成正相关。[12]BGP反映了成骨细胞活性。[13]骨质合成活跃时可显示BGP升高[14]。
为探索如何改进他莫昔芬治疗的乳腺癌患者的骨密度,我们进行了相应研究,了解能否通过补充金天格的形式来改善他莫昔芬治疗的乳腺癌患者骨密度。2017版《原发性骨质疏松症诊疗指南》(中华医学会骨质疏松和骨矿盐疾病分会发布),“中医中药治疗”类别明确提到了本研究采用的金天格胶囊,将其收录入进该指南的骨质疏松症防治章节。相关研究提示金天格具有改善骨质疏松及促进骨生长的作用[15]。
经补充金天格后,他莫昔芬治疗的乳腺癌患者BGP与PICP两个指标较对照组改善,提示了金天格的增加改善了成骨细胞的功能。T3骨密度也要好于组B。很多研究提示,VD对于PTH具有抑制作用[16],但本研究没有观察的类似的情况,这可能与检测指标为总VD而非活性VD有关,不能反应有效VD对于PTH的影响。组B的BGP水平下降。而BGP是由成骨细胞合成并释放入血,是成骨细胞的产物,BGP水平与骨形成或骨转换率正相关,可能提示了他莫昔芬抑制了成骨细胞的作用,导致了骨密度下降。PTH在2组之间没有体现差异,这可能反映了金天格对破骨细胞的影响作用较小或破骨细胞本身并不活跃。在没有维生素D补充的情况下2组的VD值无统计学差异。组A的全程PICP均较组B低,反映了他莫昔芬可能存在对骨形成的抑制。超声骨密度检查提示,发现组B在T3时骨密度较正常女性减少,骨密度呈下降的趋势,而组A没有看到这样的改变,提示金天格可以改善他莫昔芬治疗的乳腺癌患者的骨密度。
金天格的主要成分为人工虎骨粉,既往研究提示了改善了小鼠骨质疏松模型骨密度的作用,但作用机制尚不明确。[17]本研究提示了金天格改善骨质疏松的原理可能在于促进成果细胞活动及增加VD,但未在使用金天格的同时监测使用者的血清钙和尿钙,需要在以后的研究中增加相关内容,避免在部分使用者中出现高钙血症或高钙尿症。
本研究提示了对他莫昔芬治疗的乳腺癌患者补充金天格,有助于改善骨密度,将使这部分人群获得更大的医疗效益。

