利用CRISPR/Cas9双元转基因体系探究家蚕配子生成素结合蛋白基因Bmggnbp2的功能
刘洪锷, 汪丽枝, 刘祖莲, 衣玫妍, 冯启理, 黄勇平, 相 辉,*
(1. 华南师范大学生命科学学院昆虫科学与技术研究所, 广东省昆虫发育生物学与应用技术重点实验室/广州市昆虫发育调控与应用研究重点实验室, 广州510631; 2. 中国科学院上海生命科学研究院植物生理生态研究所, 上海200032)
配子生成素结合蛋白2(gametogenetin binding protein 2, GGNBP2)是锌指蛋白家族中的一种保守蛋白。该蛋白在睾丸中的表达水平远高于在其他组织中的,已有不少文献揭示其生理功能与生殖过程密切相关(曹志国, 2005; Zhangetal., 2005; 张进, 2005; 刘凌云, 2017; 郭凯敏, 2018; Guoetal., 2018)。ggnbp2基因最早被发现时,被认为是二噁英的一个目的基因,产物用于调节生殖毒性。其在睾丸中以及整个生精过程中高度表达,和DNA的合成和有丝分裂有密不可分的关系(关瑞, 2012)。GGNBP2参与整个生精过程,并且与精子发生中必不可少的有丝分裂存在关联,据报道(Guoetal., 2018),GGNBP2可能是与GGN1(gametogenetin protein 1)相互作用介导,在精母细胞的减数分裂过程中,在DNA双链断裂(DNA double strand break,DSB)修复中起重要作用,GGNBP2敲除的小鼠,在精子分化过程中引起变形缺陷从而导致小鼠生殖腺内无成熟的精子(郭凯敏, 2018)。另外,该基因还参与哺乳动物胎儿发育过程,是成功怀孕的重要因素,并作为关键因子参与胎盘发育过程中的分化(Lietal., 2016)。
GGNBP2缺失会导致C-Met-Stat3信号激活,改变了滋养层干细胞(trophoblast stem cells, TSC)增殖与分化,最终导致胎盘血管结构,只有ggnbp2基因正确表达才能维持TSC增殖平衡而成功怀孕和进行正常的胚盘发育过程的分化(Lietal., 2016)。在肿瘤研究中,GGNBP2作为抑癌因子参与抑制乳腺癌(李春艳, 2016; 高学仁等, 2017; Liuetal., 2019)、卵巢癌(Lanetal., 2016)和胶质瘤细胞(王佳等, 2016)的增殖、迁移和侵袭(Zhanetal., 2017)。
尽管在哺乳动物中的研究证实,GGNBP2在配子发生和生殖过程中发挥重要作用,但是在昆虫中的存在性及功能仍完全未知,使用家蚕Bombyxmoriggnbp2基因序列在NCBI数据库进行BLAST比对(blastx)(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastx),在斜纹夜蛾Spodopteraitura等诸多昆虫中都能找到该基因的同源序列,表明该基因在昆虫亦广泛存在(Guoetal., 2018; Xiangetal., 2018; Liuetal., 2019),但是其功能仍然未知。有趣的是,这个未知功能的基因,在家蚕的驯化过程可能发挥作用。我们前期的研究鉴定到该基因是候选驯化基因之一(Xiangetal., 2018),但是缺乏该基因的功能证据。我们猜测其可能对家蚕生殖、繁殖能力产生一定的影响。为此我们在家蚕中来研究ggnbp2的基因功能,以期探讨该基因在家蚕驯化过程中可能的作用。
1 材料与方法
1.1 家蚕饲养
本研究所用家蚕B.mori为非滞育品系Nistari蚕卵,由中国科学院上海生命科学研究院植物生理生态研究所和中国科学院昆明动物研究所提供。幼虫用新鲜的采摘的桑叶饲养。注射质粒pBac[IE-EGFP-Nos-Cas9](Nos-Cas9)后得到的稳定传代的Cas9单品系家蚕Nistari(下称“Nos-Cas9转基因品系”),由中国科学院上海生命科学研究院植物生理生态研究所黄勇平教授实验室提供。
1.2 基因相关信息及表达数据的获得
根据课题组前期研究成果(Xiangetal., 2018),以及更新版的家蚕基因组和注释信息(doi.org/10.5061/dryad.fn82qp6),得到ggnbp2基因的序列信息。通过与NCBI中的NR库(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)进行蛋白质序列比对,得到对应的家蚕参考序列(GenBank登录号: XP_004930406.1)。根据基因芯片探针编号,从家蚕基因组数据库(https:∥silkworm.genomics.org.cn/)获得的家蚕5龄第3天幼虫不同组织的芯片表达数据中得该基因的基因芯片数据。
1.3 ggnbp2基因的系统发育分析
通过blastp比对NCBI数据库中的NR库(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi),下载13个物种的GGNBP2同源蛋白序列,从NCBI的NR蛋白库中获取牛Bostaurus和智人Homosapiens的GGNBP序列作为外群,进行后续分析。将最终确定的蛋白序列通过MEGA7软件(Kumaretal., 2016)中的ClustalW进行多序列比对,将比对后的文件转化为nex格式,通过beast软件使用贝叶斯法构建系统发育树,其参数chain length为10 000 000,logEvery为1 000,burnin为0.1。树文件用FigTree软件(1.4.3版本)生成图形文件。
1.4 Bmggnbp2基因的人工选择信号分析
利用我们前期研究建立的家蚕-野桑蚕(Bombyxmandarina)群体基因组多态性数据 (https:∥doi.org/10.5061/dryad.fn82qp6) (Xiangetal., 2018),并根据其中筛选驯化过程人工选择信号的方法(Xiangetal., 2018),进行Bmggnbp2基因区域人工选择信号分析。具体而言,以5 kb基因组区域为窗口,500 bp为步长,计算全基因组每个窗口进行种群分歧度系数(Fst)和家蚕地方品种的核苷酸多态性参数(π),以最高1%的Fst以及最低5%的π作为人工选择信号筛选阈值,对Bmggnbp2基因及上下游2 000 bp区域进行选择扫荡(selective sweep)的扫描。
1.5 家蚕Bmggnbp2基因突变体构建
大肠杆菌EscherichiacoliDH5α是本实验保存的菌种。pMD18-T载体购自TaKaRa公司。pBac[IE1-DsRed-U6-sgRNA1+2]、辅助质粒Helper1和Helper2及piggyBac mRNA IFP2载体由中国科学院上海生命科学研究院植物生理生态研究所黄勇平教授实验室保存。参考Zeng等(2017)的方法,基于Bmggnbp2基因序列,利用sgRNA在线设计软件CRISPRdirect(http:∥crispr.dbcls.jp/)设计了sgRNA1和sgRNA2(间隔2 330 bp),分别位于第4和第7号外显子上(图1),靶点遵循:5′-N(20)-NGG-3′(N为任意碱基)。利用质粒pBac[IE1-DsRed-U6-sgRNA1+2],通过多轮PCR(KOD-plus, TOYOBO)(引物见表1)多片段重组(MultiS One Step Cloning Kit, Vazyme)的方法将设计的Bmggnbp2敲除靶位点sgRNA1和sgRNA2通过KpnⅠ(TaKaRa)和HindⅢ(TaKaRa)替换到原质粒DNA中,最终获得piggyBac转基因质粒载体pBac [IE1-DsRed-U6-Bmggnbp2sgRNA1+2]。

表1 引物信息Table 1 Primer information
piggyBac mRNA IFP2载体用XbaⅠ(Thermo Scientific)按说明书配制酶切体系后37℃过夜酶切进行线性化,用酚/氯 仿/异戊醇进行纯化。使mMESSAGE mMACHINE®试剂盒(T7)(Ambion)进行piggyBac mRNA IFP2的体外转录,产物使用酚/氯仿/异戊醇进行纯化,经1.5%琼脂糖凝胶电泳检测后分装备用。
将新羽化的家蚕Nistari雄、雌成虫交配5 h以上,将雄雌成虫分开,收集新鲜的Nistari卵,在2 h内用Eppendorf双针显微注射系统完成蚕卵的显微注射。注射体系:pBac [IE1-DsRed-U6-Bmggnbp2sgRNA1+2]质粒400 ng/μL, Helper1质粒400 ng/μL, Helper2质粒400 ng/μL, piggyBac mRNA IFP2的mRNA 200 ng/μL, RNase-free water补齐到25 μL。每个蚕卵注射10 nL,注射结束后,将补洞后的卵在通风橱吹风10 min;结束后放入培养箱中26℃、相对湿度70%、黑暗条件下催青。
1.6 Bmggnbp2敲除突变体荧光筛选
取1.5节注射的G0代蚁蚕孵出,桑叶正常喂食饲养至化蛾后,相互交配。待G1代卵孵化出后,由于pBac[IE1-DsRed-U6-Bmggnbp2sgRNA1+2]载体带有红色荧光蛋白标记基因,在荧光显微镜下,筛选带有红色荧光的蚁蚕,稳定饲养传代,即可认定为pBac [IE1-DsRed-U6-Bmggnbp2sgRNA1+2]转基因品系(下称U6-sgRNA转基因品系)。U6-Bmggnbp2sgRNA转基因品系与Nos-Cas9转基因品系(绿色荧光标记)杂交,后代筛选具有既有红色荧光又有绿色荧光的蚁蚕,表明[IE1-DsRed-U6-Bmggnbp2sgRNA1+2]载体和Nos-Cas9载体在蚕体内正常表达,不断表达的sgRNA和Cas9蛋白结合后,当代通过荧光筛选既有红色荧光又有绿色荧光的个体可以获得Bmggnbp2基因的敲除突变体△Bmggnbp2。同时U6-Bmggnbp2sgRNA转基因品系与Nos-Cas9转基因品系分别自由交配后代饲养传代作为对照组。
1.7 Bmggnbp2突变体基因型检测
随机取10头1.6节筛选到具有双荧光的家蚕突变体△Bmggnbp2 2龄幼虫组成混合样,用DNA抽提液(pH≥7.5,购自北京鼎国昌盛生物技术有限责任公司)提取混合样品基因组DNA。在靶基因位点周围300-500 bp设计引物(表1),以基因组DNA为模板进行PCR扩增,PCR反应体系(25 μL): Premix Taq Version 2.0 12.5 μL, 上下游引物(10 μmol/L)各0.5 μL, 基因组DNA模板1.0 μL, 灭菌双蒸水补足至25 μL。扩增程序: 95℃预变性3 min; 95℃ 30 s, 58℃ 30 s, 72℃ 2 min, 32个循环; 72℃延伸10 min。PCR产物连接到pMD-18T载体,挑单克隆送到广州擎科生物技术公司测序,进行基因型检测,测序结果与野生型基因组进行BLAST比对以确定突变情况。
1.8 Bmggnbp2突变体表型检测
对1.6节筛选到的突变体后代和对照(U6-Bmggnbp2sgRNA和Nos-Cas9两个单品系)后代进行正常的饲养,称量突变体△Bmggnbp2(n=75), U6-Bmggnbp2sgRNA品系(n=77)和Nos-Cas9品系(n=50)的全茧重、蛹重和茧壳重;分别统计突变体△Bmggnbp2个体(n=30)和Nos-Cas9对照个体(n=10)的单雌产卵量和卵孵化率。 实验数据用SPSS25.0进行ANOVA统计分析,采用t检验分析处理与对照间在0.05水平的差异显著性,用GraphPad Prism 6作图。
解剖10头雄性蛹期第4天的突变体△Bmggnbp2的精巢和相同时期的Nos-Cas9对照雄蛹精巢,放置于生理盐水中,于体视显微镜(Nikon, DS-Ri2)观察比对精巢的形态变化并拍照。
2 结果
2.1 Bmggnbp2的系统发育分析
序列比对分析发现该基因在斜纹夜蛾等几种鳞翅目昆虫中都呈现高度保守性。贝叶斯法构树结果显示(图2),家蚕的BmGGNBP2与粉纹夜蛾Trichoplusiani、斜纹夜蛾Spodopteralitura、棉铃虫Helicoverpaarmigera、烟芽夜蛾Heliothisvirescens和车前角夜蛾Arctiaplantaginis的GGNBP2聚到一支,揭示了该基因在斜纹夜蛾等鳞翅目中高度保守,且在鳞翅目昆虫中亦普遍存在,但与哺乳动物存在差异。
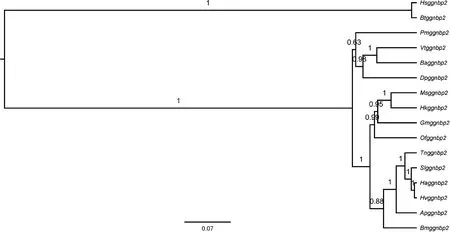
图2 基于核苷酸序列构建的家蚕Bmggnbp2和其他鳞翅目昆虫ggnbp2的分子进化分析Fig. 2 Molecular evolution analysis of Bmggnbp2 of Bombyx mori and ggnbp2from other lepidopteran insects based on nucleotide sequence同源序列来源物种及其GenBank登录号 Source species of homologous sequences and their GenBank accession numbers: Bm: 家蚕Bombyx mori (XP_004930406.1); Ha: 棉铃虫Helicoverpa armigera (XP_021185134.1); Ms: 烟草天蛾Manduca sexta (XP_030023210.1); Tn: 粉纹夜蛾Trichoplusia ni (XP_026724666.1); Sl: 斜纹夜蛾Spodoptera litura (XP_022819345.1); Hv: 烟芽夜蛾Heliothis virescens(PCG81109.1); Ap:车前角夜蛾Arctia plantaginis (CAB3228591); Gm:大蜡螟Galleria mellonella (XP_026757917.1); Vt: 夏威夷红蛱蝶Vanessa tameamea (XP_026494965.1); Of: 亚洲玉米螟Ostrinia furnacalis (XP_028163466.1); Hk: 海波斯莫科马属蛾Hyposmocoma kahamanoa (XP_026329683.1); Pm: 金凤蝶Papilio machaon (KPJ06248.1); Ba: 偏瞳蔽眼蝶Bicyclus anynana (XP_023946886.1); Dp: 黑脉金斑蝶Danaus plexippus (XP_032513369.1); Bt: 牛Bos taurus (XP_010814079.1); Hs: 智人Homo sapiens (XP_005257746.1). 基因树节点上的数字是可信度参数后验概率;系统树下方的刻度值代表核酸替代率。Number in each node indicates the posterior probability. The scale value below the phylogenetic tree represents the nucleic acid substitution rate.
2.2 Bmggnbp2的人工选择信号分析
Bmggnbp2所在的基因组区域种群分歧度参数(Fst)在此区域有明显的上升,形成选择扫荡;核苷酸多态性参数(π)也显示,该区域家蚕呈现多态性极低,而野桑蚕则保持较高的多态性(图3)。结果表明,Bmggnbp2的基因组区域有明显的人工选择信号。该基因也在我们之前的研究中也被鉴定为候选驯化基因(Xiangetal., 2018)。
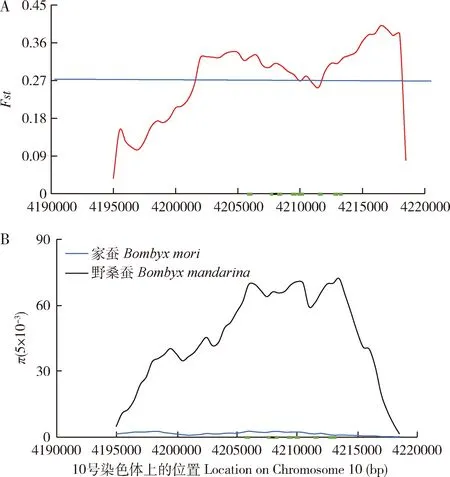
图3 家蚕Bmggnbp2基因区的人工选择信号分析Fig. 3 Selection signatures of Bmggnbp2 of Bombyx moriA和B图分别是该基因区域的选择信号参数——种群分歧度系数(Fst) (家蚕三眠蚕品系与野蚕种群)和两个群体的核苷酸多态性参数(π)的分布图。灰色虚线表示最高5% Fst阈值;绿色方块为该基因的结构示意图,位于10号染色体。Signature indexes population divergence coefficient (Fst) between the Chinese local trimoulting domestic silkworm strain and Bombyx mandarina (A) and the nucleotide diversity index (π) in the silkworm population (B), are shown along the genomic regions covering the Bmggnbp2 gene. Dashed lines represent the top 5% Fst cutoff. The green square represents the Bmggnbp2 gene region which is located on Chromosome 10.
2.3 Bmggnbp2基因相关信息以及其在家蚕组织中的表达特征
Bmggnbp2基因ORF全长1 827 bp,编码608个氨基酸,包含8个外显子。家蚕芯片组织数据显示该基因在家蚕各个组织位置均有表达,且在家蚕5龄第3天幼虫的脑、卵巢、精巢和丝腺中有很高的表达量(图4)。
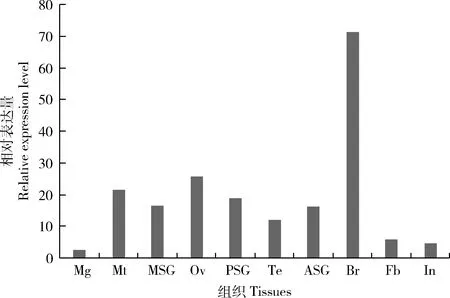
图4 基于基因芯片数据的Bmggnbp2在家蚕5龄第3天幼虫中的组织表达格局Fig. 4 Tissue expression pattern of Bmggnbp2 in the day-3 5th instar larvae of Bombyx mori based on gene chip dataOv: 卵巢Ovary; Te: 精巢Testis; Br: 脑部Brain; In: 表皮Integument; Fb: 脂肪体Fat body; Mg: 中肠Midgut; Mt: 马氏管Malpighian tubules; ASG: 前部丝腺Anterior silk gland; MSG: 中部丝腺Middle silk gland; PSG: 后部丝腺Posterior silk gland.
2.4 基于转基因CRISPR系统的家蚕Bmggnbp2突变体
注射pBac[IE1-DsRed-U6-Bmggnbp2sgRNA1+2]转基因载体于Nistari品系野生型家蚕共880颗卵,成功孵化出775头,卵孵化率为85%。正常饲养至化蛾时期后。G0代雌雄相互交配,总共得到203个蛾圈后代(G1)。待G1代卵孵化后,对G1代的每个蛾圈进行红色荧光筛选。总共筛选到25头带有红色荧光的蚁蚕。该品系与Nos-Cas9品系杂交后,得到既有红色荧光又有绿色荧光的杂交后代(图5),即为Bmggnbp2敲除嵌合突变体△Bmggnbp2。与前期的研究(Zengetal., 2016, 2017)相比较,利用该方法得到的嵌合突变体敲除率较高。
2.5 家蚕Bmggnbp2突变体基因型
随机挑选突变体文库的9个单克隆进行测序,发现丰富的敲除突变,9个样品均有大于2 000 bp的大片段碱基缺失,大片段的基因组敲除导致了Bmggnbp2基因的第4, 5, 6和7号外显子缺失(数据未展示),结果再次证实转基因CRISPR系统的有效性。
2.6 家蚕Bmggnbp2突变体的表型
在生殖相关性状方面,Bmggnbp2突变体△Bmggnbp2蛹期第4天的精巢在形状上表现为椭圆形(图6: A),而对照Nos-Cas9呈现经典的肾形精巢(图6: B),并且突变体精巢表面还出现一层较厚的黄色覆盖物。 就茧丝经济性状而言,Bmggnbp2突变体△Bmggnbp2(n=75)相对于U6-Bmggnbp2sgRNA(n=77)和Nos-Cas9两个对照品系(n=50),在全茧重、蛹重和茧壳重上均没有显著差异(P>0.05)(图7: A)。 与对照Nos-Cas9对比,突变体△Bmggnbp2的单雌产卵量及卵孵化率均没有显著差异(P>0.05)(图7: B, C)。结果表明,BmGGNBP2对家蚕的产丝性状没有明显的影响,尽管对雄性生殖腺形态有一定的影响,但并没有影响到产卵、孵化这些性状。
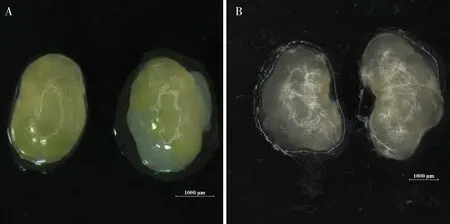
图6 家蚕突变体△Bmggnbp2 (A)与对照Nos-Cas9 (B)蛹期第4 天的精巢对比Fig. 6 Testis comparison of the 4 day-old pupa between the mutant △Bmggnbp2 (A)and the control Nos-Cas9 (B) of Bombyx mori
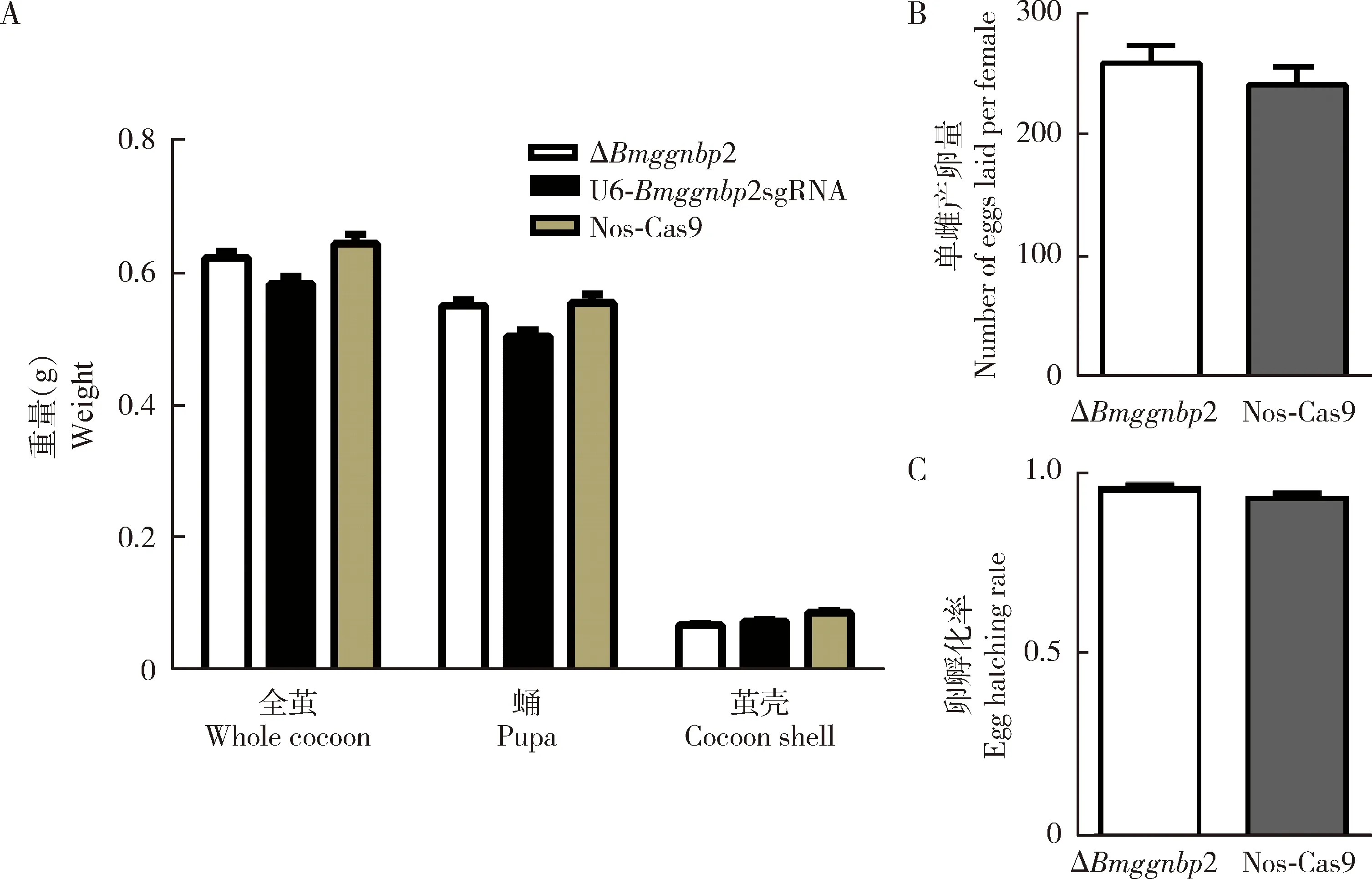
图7 家蚕突变体△Bmggnbp2产丝性能(A)以及单雌产卵量(B)和卵孵化率(C)对比Fig. 7 Comparison of silk production performance (A), and number of eggs laid per female (B)and egg hatching rate of mutant △Bmggnbp2 (C) of Bombyx moriA: △Bmggnbp2(n=75)与对照U6-Bmggnbp2sgRNA(n=77)和Nos-Cas9(n=50)的全茧重、茧壳重和蛹重Cocoon weight, cocoon shell weight and pupal weight of the mutant △Bmggnbp2 (n=75) and the controls U6-Bmggnbp2sgRNA (n=77) and Nos-Cas9 (n=50); B: △Bmggnbp2与对照Nos-Cas9的单雌产卵量Number of eggs laid per female of △Bmggnbp 2 and the control Nos-Cas9; C: △Bmggnbp 2与对照Nos-Cas9的卵孵化率Egg hatching rate of △Bmggnbp 2 and the control Nos-Cas9. 图中数据为平均值±标准差;采用t检验检测突变体分别与两种对照间在0.05水平的差异显著性。Data in the figure are mean±SD. Significance of differences between the values of the mutants and the two controls at the 0.05 level was tested by t-test.
3 讨论
本研究利用双元转基因体系对家蚕的Bmggnbp2进行了基因敲除,在突变体△Bmggnbp2中,Bmggnbp2有2 000多个碱基的缺失,导致BmGGNBP2蛋白氨基酸的大片段缺失。表型观察发现,突变体跟对照品系相比,突变体的精巢形态发生变化并且出现一层厚厚的黄色覆盖物(图6),说明基因敲除对家蚕的精巢形态产生了一定的影响。这些变化以及覆盖物成分的进一步分析,将可能对于理解该基因的功能提供进一步的线索。我们进一步统计其产卵量和卵孵化率发现,精巢的形态改变并没有影响突变体的产卵量和卵孵化率(图7)。统计突变体△Bmggnbp2以及对照U6-Bmggnbp2sgRNA和Nos-Cas9的全茧重、蛹重和茧壳重,但没有发现有明显的差异,表明Bmggnbp2的缺失同样没有影响到重要的驯化性状——茧丝性状。就本研究的结果而言,ggnbp2这一在哺乳动物中具有重要功能的基因在家蚕的生殖发育中的作用似乎并不至关重要。一种可能是,在家蚕中存在某种互补机制,可以替代GGNBP2基因缺失可能引起的精细胞功能缺陷的补救措施。为了解其机理,后续使用生物化学技术对其结合因子进行进一步研究有助于回答这一问题。GGNBP2基因起作用的复杂性,提示我们在进行表型检测时,可能需要进行更为精细的条件设置。正如一项家蚕蜕皮激素氧化酶(ecdysone, EO)的研究中(Sunetal., 2014),该基因的不同基因型的表型差异仅在饥饿处理时才能检测到,而在正常喂食条件下,两种品系之间没有差异。因此,引发Bmggnbp2基因敲除并未发现家蚕突变体的繁殖力发生变化,也可能是需要一定的外力诱导才有可能产生性状改变,后续深入探索该基因的调控机制将有助于回答这一问题。
转基因CRISPR系统可以使得sgRNA和Cas9蛋白在同一时期表达和传递,在转基因幼虫中,转基因普遍且持续地表达,但可能较弱,后代容易产生嵌合体;而直接显微注射Cas9 mRNA和sgRNA在胚胎中较短时间内就能实现对目的基因的破坏,但由于存在Cas9蛋白和sgRNA传递的差异,可能导致表型不规则(Zengetal., 2016)。我们运用转基因CRISPR对Bmggnbp2基因进行基因敲除发现,敲除比例偏低,但敲除片段较大;另外可以稳定表达荧光蛋白的突变体品系可能为嵌合体而不是完全敲除的纯合体,从而使得基因还能发挥一部分的功能。
综上所述,本研究在家蚕中利用双元转基因体系获取了Bmggnbp2敲除的家蚕突变体△Bmggnbp2,对其与对照Nos-Cas9品系和U6-Bmggnbp2 sgRNA在精巢形态、全茧重、蛹重和茧壳重等性状进行了比较,同时统计了突变体△Bmggnbp2与对照Nos-Cas9的产卵量和卵孵化率。尽管本研究观察到该基因的敲除对精巢形态有一定的影响,但对繁殖性状、茧丝经济性状均没有显著影响。后续针对该基因的深入功能剖析以及体内对于该基因通路可能的补偿机制探究,将为理解家蚕精巢发育机制提供新的启示。

