胞质型肽聚糖识别蛋白RfPGRP-L2在维持红棕象甲肠道菌群稳态中的作用
肖 蓉, 王兴红, 李雄伟, 刘惠惠, 鲁盛平,侯有明, 石章红,*
(1. 福建农林大学, 闽台作物有害生物防控国家重点实验室, 福州 350002;2. 福建农林大学植物保护学院, 福建省昆虫生态学重点实验室, 福州 350002)
微生物是自然界中常见的一种生命体,通常以“微生物群落”的方式共存。在动物的肠道中栖息着包括细菌、古菌、病毒、真菌和原生生物等多种微生物,其中细菌是主要的微生物类群,常被称为肠道菌群(Lee and Brey, 2013)。昆虫与肠道菌群之间的互作是昆虫适应环境和进化成功的重要因素。现有证据表明,肠道菌群对昆虫的生理适合度有很显著的影响作用(Engel and Moran, 2013; Douglas, 2015; 陈勃生等, 2017; 石章红和侯有明, 2020)。例如,肠道菌群可以调节昆虫的营养代谢、生长发育、免疫活性、器官稳态维持、寿命以及交配觅食行为(Youetal., 2014; Schretteretal., 2018; Lynch and Hsiao, 2019; 高欢欢等, 2020)。肠道是宿主与外界环境进行物质交换的主要场所,外界环境中的非肠道微生物会随着食物进入昆虫肠道。因此,宿主需要快速且精准地识别并清除非肠道细菌以维持其肠道菌群稳态。因为动物肠道菌群的结构组成和数量可以随着内外各种因素的波动而不断动态变化,所以肠道菌群稳态通常是指肠道菌群的结构组成与宿主健康之间的一种动态平衡状态,通常从肠道细菌的数量和不同种类细菌的相对丰度这两个角度来进行衡量(Ryuetal., 2008; Buchonetal., 2013)。已有研究证实昆虫免疫系统在宿主肠道菌群稳态的维持和调控中扮演关键角色(Chenetal., 2019; Xiaoetal., 2019)。例如,黑腹果蝇Drosophilamelanogaster和斯氏按蚊Anophelesstephensi的肠上皮细胞能够通过分泌产生活性氧(reactive oxygen species, ROS)(Oliveiraetal., 2011; Leeetal., 2013)和抗菌肽(Ryuetal., 2008)来调控肠道菌群的组成和数量。
纵观当前关于昆虫肠道菌群的相关研究报道,不难发现对于昆虫宿主如何调控和维持其健康的肠道菌群稳态这方面的科学问题研究关注相对很少,而且非常有限的相关报道也是主要来自于模式昆虫黑腹果蝇D.melanogaster、冈比亚按蚊A.gambiae和埃及伊蚊Aedesaegypti等。众所周知,昆虫种类繁多,生态习性千差万别。因此,源于模式昆虫的相关研究报道很难泛化到一些重要的农林害虫。目前已发现许多重要的农林害虫的肠道中都栖息有丰富的细菌群落。和哺乳动物等模式生物类似,维持健康的肠道菌群稳态对于害虫的正常生长发育至关重要(Muhammadetal., 2017, 2019a, 2019b; Hebinezaetal., 2019)。例如,肠道菌群对昆虫的生长发育、营养代谢、抗药性的产生、免疫防御与器官稳态维持、配偶选择、交配竞争力和社会行为等众多生理过程都有重要的影响作用(Chengetal., 2017; Chenetal., 2019; Wangetal., 2020)。因此,肠道菌群被认为是宿主体内的一个“超级器官” (O′Hara and Shanahan, 2006)。越来越多的研究证实肠道菌群稳态的变化会导致昆虫发育延缓、寿命缩短和慢性炎症等疾病的产生(Shinetal., 2011; Guoetal., 2014; Muhammadetal., 2017, 2019a, 2019b; Iatsenkoetal., 2018; Mottaetal., 2018)。因此,维持肠道菌群的稳态对宿主的健康生存至关重要。然而,关于害虫如何维持和调控其肠道菌群稳态的免疫机理知之甚少。
红棕象甲Rhynchophorusferrugineus是我国的一种高风险性入侵害虫,主要危害棕榈科植物,还能危害甘蔗等农作物(鞠瑞亭等, 2006; Shietal., 2014)。该害虫的肠道中栖居着主要由肠杆菌科(Enterobacteriaceae)、乳酸杆菌科(Lactobacillaceae)、虫原体科(Entomoplasmataceae)和链球菌科(Streptococcaceae)4个科所构成的细菌群落,其中一些细菌具有降解纤维素的能力而且蕴含着大量编码降解植物纤维素和淀粉等酶的功能基因(Jiaetal., 2013; Muhammadetal., 2017)。当肠道菌群的组成结构被改变或被彻底清除后,红棕象甲的营养代谢受到显著影响,免疫活性也被明显降低,这说明肠道菌群在该害虫的营养代谢和免疫防御等过程中扮演重要角色(Muhammadetal., 2017, 2019a, 2019b; Hebinezaetal., 2019)。与其他病原细菌一样,绝大多数肠道细菌都会代谢释放肽聚糖(peptidoglycan, PGN)到宿主肠腔内(Chu and Mazmanian, 2013),而肽聚糖正是昆虫识别“异己”进而激活其免疫系统的一种重要抗原物质(Royet and Dziarski, 2007)。因此,对于宿主昆虫来说,如何科学地管理来自肠道菌群的肽聚糖而避免肠道免疫的过度激活来维持健康的肠道菌群稳态是一个重要挑战。在昆虫体内,肽聚糖识别蛋白(peptidoglycan recognition protein, PGRP)识别肽聚糖是激活其免疫系统的关键环节(Royetetal., 2011; 杨青泰等, 2018)。源于肠道菌群的肽聚糖可以穿透肠壁进入血淋巴进而影响宿主发育并增强宿主的免疫能力(Round and Mazmanian, 2009),而且宿主的Toll-like免疫识别受体参与介导肠道菌群提高宿主适合度的生理过程(Kubinak and Round, 2012)。我们的前期调研发现,红棕象甲具有一个编码位于细胞质内的PGRP的功能基因RfPGRP-L2,而且该基因的编码蛋白可能在该害虫与其肠道菌群的互作过程中扮演关键角色。在本研究中,综合运用RNAi、RT-qPCR、重组蛋白原核表达和基于细菌16S rRNA的高通量测序等多种手段解析了胞质型肽聚糖识别蛋白RfPGRP-L2的组织表达谱、免疫功能特征及其在该害虫肠道菌群稳态调控和维持中的作用。
1 材料与方法
1.1 供试昆虫
红棕象甲的实验室种群饲养在人工气候培养箱中(DRX-260,宁波赛福实验仪器有限公司)。雌雄成虫配对饲养在圆柱状透明塑料盒(直径7 cm,高10 cm)中,盒盖上有纱布遮挡的孔以保证空气流通。成虫的饲养条件为温度27±1℃、相对湿度75%±5%和光周期12L∶12D,用切片的新鲜甘蔗喂食,每4~5 d换一次甘蔗。在甘蔗片更换的过程中,小心剖开旧甘蔗片,用毛笔轻轻挑出其中的虫卵,并置于含有润湿滤纸的玻璃培养皿(直径7 cm)中,然后将培养皿放入人工培养箱中待卵孵化。初孵幼虫逐条挑出并转移至含有新鲜甘蔗片的洁净培养皿饲养,每皿仅放1头幼虫,每4~5 d更换一次甘蔗,幼虫的饲养条件为温度27±1℃、相对湿度75%±5%和光周期0L∶24D。幼虫化蛹后,取出甘蔗片后加入一些干净潮湿的甘蔗渣,待其羽化成成虫。其中的部分4龄幼虫用于后续的试验处理。
1.2 红棕象甲RfPGRP-L2的序列分析
利用ORF Finder(https:∥www.ncbi.nlm.nih.gov/orffinder/)和ExPASy-Translate Tool(https:∥web.expasy.org/translate/)分别预测RfPGRP-L2的开放阅读框和其编码的氨基酸序列,随后采用在线分析工具SMART(http:∥smart.embl-heidelberg.de/)的一般模式(normal mode)预测RfPGRP-L2所含有的保守结构域,使用软件MEGA 5.0中的最大似然法进行RfPGRP-L2与其他同源蛋白的系统进化分析。
1.3 红棕象甲RfPGRP-L2的组织表达谱分析
随机选取健康的红棕象甲4龄幼虫解剖获取不同组织(头、脂肪体、表皮、前肠、中-后肠和血淋巴),每种组织设3个生物学重复,每个生物学重复含3头试虫。然后参照Dawadi等(2018)描述的方法步骤采用TRIzol法(ThermoFisher Scientific, 美国)从组织中提取总RNA。用微量分光光度计NanoDrop 2000和琼脂糖凝胶电泳分别检测所获总RNA的RNA浓度、纯度及完整性,随后将符合要求的样品保存在-80℃备用,利用Verso cDNA Synthesis Kit(ThermoFisher Scientific, 美国)合成cDNA。根据Dawadi等(2018)的报道,利用在线引物设计软件primer 3.0(http:∥bioinfo.ut.ee/primer3-0.4.0/)设计RT-qPCR引物(表1)。采用FastStart Universal SYBR Green Master (Roche, Cat.No.04913850001)试剂盒在ABI 7500荧光定量PCR仪(Life Technology, 美国)上进行RT-qPCR,反应总体系(20 μL): 上下游引物(10 μmol/L)各0.3 μL, cDNA模板1 μL, Super Mix10 μL, 灭菌的去离子水8.4 μL。RT-qPCR程序: 95℃预变性10 min; 95℃变性15 s, 61℃退火延伸1 min, 40个循环。以红棕象甲的Rfβ-actin基因为内参(Dawadietal., 2018),采用2-ΔΔCt方法进行相对表达量的计算。
1.4 细菌感染对红棕象甲肠道和脂肪体中RfPGRP-L2表达量的影响
为明确对细菌感染的响应特征,利用大肠杆菌EscherichiacoliDH5α和金黄色葡萄球菌Staphylococcusaureus经注射(注射1 μL OD600=1.6的菌液)和喂食(取食涂抹了1 mL OD600=1.6的菌液的甘蔗薄片)两种不同的方式分别感染红棕象甲的4龄幼虫,在感染后的6, 12和24 h解剖获取肠道和脂肪体并提取总RNA。每个处理设3个生物学重复,每个重复含3头试虫。每个处理取1 μg总RNA用Verso cDNA Synthesis Kit(Thermo, AB1453B)反转录试剂盒制备RT-qPCR的cDNA模板。引物序列见表1,RT-qPCR反应体系和反应程序同1.3节,采用2-ΔΔCt方法进行相对表达量的计算。
1.5 红棕象甲RfPGRP-L2的原核表达、纯化与体外功能分析
基于PAS(PCR-based accurate synthesis)方法设计引物,并在引物的两端各设计保护性碱基(表1),以1.3节中的cDNA为模板,用高保真酶Taq-LA(大连宝生物工程有限公司)扩增并将其克隆连接至表达载体pET-32a上,构建表达质粒pET-32a-RfPGRP-L2并转化至大肠杆菌DH5α感受态细胞,测序比对选择正确的阳性克隆用于后续的诱导表达试验(Dawadietal., 2018)。使用AXYGEN的质粒小提试剂盒提取表达质粒pET-32a-RfPGRP-L2并转化至大肠杆菌Arctic ExpressTM感受态细胞(南京钟鼎生物技术有限公司)中,接入含有50 μg/mL Amp的LB培养基中于37℃下培养至对数生长期,加入IPTG至终浓度为0.5 mmol/L,20℃ 220 r/min振摇过夜,诱导融合蛋白表达。室温下4 000 r/min离心10 min富集菌体,用PBS重悬并再次富集菌体后用细胞裂解液(20 mmol/L Tris-HCl, 含1 mmol/L PMSF,细菌专用蛋白酶抑制剂混合物,pH 8.0)重新悬浮,于冰上进行超声破碎20 min,将超声破碎的细胞裂解液于4℃ 10 000 r/min离心20 min,收集沉淀。包涵体经过变复性的方式,重溶目标蛋白,通过Ni柱亲和纯化获得目标蛋白,使用12% SDS-polyacrylamide gels (Bio-Rad)进行SDS-PAGE并用考马斯亮蓝染色,结合Western blotting进行重组蛋白质量检测(杨青泰等, 2018)。

表1 引物信息Table 1 Primer information
参照Dawadi等(2018)制备大肠杆菌DH5α和金黄色葡萄球菌的悬浮液,进行重组蛋白RfPGRP-L2体外功能分析试验。RfPGRP-L2的细菌凝集反应体系总体积为30 μL,包括5 μL细菌悬浮液和25 μL重组蛋白RfPGRP-L2(含或不含Zn2+,对照组用Tris-HCl缓冲液替代重组蛋白RfPGRP-L2)组成,混匀后于25℃水浴中孵育1 h,随后将样品制成玻片在Nikon ECLIPSE NI显微镜下进行观察并拍照。RfPGRP-L2的抑菌活性反应体系为30 μL,反应体系与细菌凝集反应体系相同,混匀并离心,于25℃水浴中孵育5 h后,在超净工作台中向每管样品中加入1 mL LB培养基,于37℃ 200 r/min过夜培养;在96孔板中加入上述培养物样品,每孔100 μL,利用酶标仪SpectraMax(Molecular Devices Corp., 美国)测量菌液的OD600值。每个处理和对照设3个平行实验。
1.6 RfPGRP-L2的RNAi
根据1.2节获得的RfPGRP-L2全长序列,使用在线软件E-RNAi (https:∥www.dkfz.de/signaling/e-rnai3/idseq.php)设计并评估筛选最佳引物(表1),利用MEGAscript® RNAi试剂盒(ThermoFisher Scientific, 美国)合成靶向该基因和EGFP的dsRNA,其中用于合成dsEGFP的引物序列引自王兴红(2018)(表1)。用无菌水清洗虫体,并将其放于冰上进行冷冻麻醉处理3 min,然后用10 μL Hamilton注射器(WPI Corp., 美国)给每头4龄试虫从腹部的节间膜注射2 μL dsRNA(500 ng/μL),对照组试虫注射等量的dsEGFP作为参照。注射处理的试虫放回人工气候箱内进行饲养,48 h后解剖收集肠道和脂肪体并提取总RNA,利用表1中的特异性引物进行RT-qPCR检测基靶因的沉默效率和该基因沉默对4个抗菌肽基因RfColeopericin,RfAtacin,RfCecropin和RfDefensin表达的影响,总RNA提取方法、RT-qPCR反应体系和反应条件同1.3节。每个处理设4个生物学重复,每个重复含3头试虫。
1.7 RNAi干扰RfPGRP-L2后红棕象甲对细菌感染的响应检测
根据Dawadi等(2018)的方法,注射dsRNA后的幼虫置于正常饲养条件下饲养45 h后,注射2 μL EGFP标记的大肠杆菌DH5α菌液(OD600=2.0)于4龄幼虫体腔内,3 h后在超净工作台中每头幼虫抽取100 μL血淋巴置于含有3 μL 5 mmol/L苯基硫脲(phenylthiourea, PTU)溶液的无菌EP管中,用无菌PBS进行梯度稀释,在稀释的过程中用移液枪抽打使之充分混匀,随后取稀释液100 μL均匀涂布于含AMP的LB平板,LB平板倒置放于37℃的恒温培养箱中培养过夜,次日在Nikon ECLIPSE NI显微镜下统计每个平板上的细菌菌落数并拍照记录,分析RfPGRP-L2沉默对红棕象甲的血淋巴清除感染细菌能力的影响。每个处理设3个生物学重复,每个重复含3头试虫。
注射RfPGRP-L2的dsRNA后将4龄幼虫放回培养箱正常饲养,12 h后对幼虫进行饥饿处理12 h后喂食含有EGFP标记的大肠杆菌DH5α菌液(OD600=2.0)的新鲜甘蔗片24 h后,解剖提取肠道并放入含有1 mL无菌PBS的灭菌匀浆器中,充分研磨后取100 μL肠道匀浆液均匀涂布在含AMP的LB平板上,LB平板的培养条件和菌落计数方法同上,分析RfPGRP-L2沉默对红棕象甲的肠道清除感染细菌能力的影响。每个处理设4个生物学重复,每个重复含3头试虫。
1.8 RNAi干扰RfPGRP-L2后健康红棕象甲4龄幼虫肠道菌群结构组成检测
注射RfPGRP-L2的dsRNA 48 h后,参照Muhammad等(2017)的描述方法,先用75%酒精清洗虫体表面90 s,接着用无菌水淋洗虫体3次,随后在超净工作台中解剖获取肠道并迅速放入事先盛有1 mL无菌PBS的洁净EP管中,立即放入液氮中迅速冷冻后置于-80℃中保存,利用DNeasy Blood & Tissue试剂盒(Qiagen, 德国)提取肠道细菌总DNA,用NanoDrop 2000(ThermoFisher Scientific,美国)和1%凝胶电泳分别检测所提DNA的浓度和质量。每个处理设3个生物学重复,每个生物学重复含3头幼虫。以利用DNeasy Blood & Tissue试剂盒提取的肠道细菌总DNA作为模板,用带有barcode的特异性引物341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)扩增细菌16S rRNA的V3+V4区,PCR反应体系: 0.2 μmol/L引物, Phusion® PCR预混液(New England Biolabs, 美国)15 μL, 肠道菌群总DNA模板10 ng,最后用灭菌的去离子水补足至30 μL。PCR反应程序: 98℃预变性1 min; 98℃变性10 s, 50℃退火30 s, 72℃退火延伸60 s, 30个循环; 72℃最后延伸5 min。技术重复3次,将PCR产物切胶回收,然后用QuantiFluorTM荧光计进行定量。将纯化的PCR扩增产物等量混合并连接测序接头、构建测序文库,Hiseq2500 PE250上机测序。参照Muhammad等(2017)和Dawadi等(2018)的数据分析流程,利用软件工具Quantitative Insight into Microbial Ecology (QIIME)(V17.0, http:∥qiime.org/index.html)和Uprase(V7.0.1001,http:∥drive5.com/uprase)将测序获得的raw reads进行过滤、拼接组装和再过滤,保证利用最有效的数据聚类成可操作分类单元(operational taxonomic unit, OTU);获得OTU后,利用QIIME软件(17.0)比较分析干扰RfPGRP-L2对不同处理组间样品肠道菌群的物种丰富度(Chao1指数和Ace指数)、群落多样性(Shannon-Wiener指数和Simpson指数)和不同类群相对丰度的影响。
1.9 数据分析
采用单因素方差分析(ANOVA)检测RfPGRP-L2在不同组织中的表达量差异、细菌感染对其在肠道和脂肪体中表达量的影响以及重组蛋白RfPGRP-L2对细菌生长的影响。采用t检验分析RNAi效率以及RNAi对抗菌肽表达量、细菌清除效率、肠道可培养细菌菌落数和肠道菌群多样性的影响。所有统计分析使用SPSS 21.0软件完成,利用Sigmaplot 12.0软件制图片。
2 结果
2.1 红棕象甲RfPGRP-L2的序列特征
RfPGRP-L2(GenBank登录号: MT830864)的cDNA序列全长为1 140 bp,其ORF长897 bp,编码一个由298个氨基酸组成的多肽。该多肽无信号肽和跨膜结构域,是一种胞质型肽聚糖识别蛋白。其中的第121-264位氨基酸构成一个保守的PGRP结构域,RfPGRP-L2仅有第152位、第260位的组氨酸(H)和第186位酪氨酸(Y) 3个保守的酰胺酶活性位点,而第266位的酪氨酸(T)和第268位的半胱氨酸(C)均被替换,这表明该蛋白不具有酰胺酶活性所必需的5个保守氨基酸位点(图1)。系统发育分析发现,RfPGRP-L2与赤拟谷盗Triboliumcastaneum和黄粉虫Tenebriomolitor的PGRP-LE聚为一小支,与黑腹果蝇D.melanogaster和骚扰阿蚊Armigeressubalbatus的PGRP-LE聚为一个大支(图2),表明RfPGRP-L2是黑腹果蝇PGRP-LE的直系同源蛋白。有趣的是,该RfPGRP-L2具有一个cRHIM基序——VRIG,该基序是形成功能性淀粉样蛋白进而激活NF-кB信号途径所必需的保守结构域(Kleinoetal., 2017),这暗示RfPGRP-L2可能作为一种识别细菌肽聚糖的免疫识别受体参与调控红棕象甲免疫反应的应答。

图1 红棕象甲RfPGRP-L2核苷酸和推导的氨基酸序列分析Fig. 1 Nucleotide and deduced amino acid sequences of RfPGRP-L2 of Rhynchophorus ferrugineus下划线表示PGRP保守结构域;灰色底纹表示Ami_2结构域;黑色方框表示保守的酰胺酶活性位点;圆圈表示突变的酰胺酶活性位点;红色方框表示RHIM基序。The PGRP domain is underlined. Gray background represents the Ami_2 domain. The black boxes represent the conserved amidase activity sites. Circles represent the mutant amidase activity sites. The red box represents the RHIM motif.

图2 最大似然法构建的基于氨基酸序列的红棕象甲RfPGRP-L2与其他昆虫PGRP蛋白的系统进化发育树(1 000次重复)Fig. 2 Phylogenetic tree of RfPGRP-L2 of Rhynchophorus ferrugineus with PGRP proteins from other insect species constructedby maximum likelihood method based on amino acid sequence (1 000 replicates)PGRP蛋白来源物种和GenBank登录号Origin species of PGRP proteins and their GenBank accession numbers: AsPGRP-LE: 骚扰阿蚊Armigeres subalbatus (AEX31482.1); CqPGRP-LC: 致倦库蚊Culex quinquefasciatus (XP_001842237.1); DmPGRP-LE: 黑腹果蝇Drosophila melanogaster (NP_573078.1); TcPGRP-LE: 赤拟谷盗Tribolium castaneum (XP_968926.1); TmPGRP-LE: 黄粉虫Tenebrio molitor (HF935084.1); AaPGRP-LB: 埃及伊蚊Aedes aegypti (DQ023277.1); DmPGRP-LB: 黑腹果蝇Drosophila melanogaster (AAG23731.1); BtPGRP-LB: 欧洲熊蜂Bombus terrestris (XP_003400160.1); PrPGRP-LF: 菜粉蝶Pieris rapae (XP_022121530.1).
2.2 红棕象甲RfPGRP-L2的组织表达谱
RT-qPCR检测发现,RfPGRP-L2在红棕象甲4龄幼虫的血淋巴、前肠、中-后肠、头、脂肪体、表皮各组织中均有表达,而且在不同组织中的表达量存在显著差异(ANOVA:F5, 12=11.884,P<0.01)(图3)。其中,该基因在血淋巴中的表达量显著高于在中-后肠、脂肪体等其他组织,其中在前肠、中-后肠、头和脂肪体中的表达水平没有显著性差异(P>0.05),说明RfPGRP-L2可能参与介导红棕象甲体内相关的免疫反应。

图3 RfPGRP-L2在健康红棕象甲4龄幼虫不同组织中的相对表达量Fig. 3 Relative expression levels of RfPGRP-L2 indifferent tissues of the healthy 4th instar larvaeof Rhynchophorus ferrugineus图中数据为平均值±标准差;柱上不同字母表示不同组织间基因表达量差异显著(P<0.05, LSD多重比较检验)。Data in the figure are mean±SD. Different letters above bars represent significant difference in the gene expression level (P<0.05, LSD multiple comparison test). 图8同The same for Fig. 8.
2.3 细菌感染对红棕象甲肠道和脂肪体中RfPGRP-L2表达量的影响
比较发现,RfPGRP-L2对革兰氏阴性细菌大肠杆菌的响应更迅速,在被感染6 h后其表达量就显著上调,而该基因的表达量在革兰氏阳性细菌金黄色葡萄球菌感染12 h后才出现明显上调(图4)。在肠道中,注射感染金黄色葡萄球菌12 h后,RfPGRP-L2的表达量显著高于注射大肠杆菌组和对照组(ANOVA:F2, 6=16.46,P<0.01)(图4: A);而注射感染大肠杆菌6, 12和24 h后,其表达量在肠道中均没有显著变化,表明金黄色葡萄球菌的注射感染会影响肠道中RfPGRP-L2表达量的变化。注射感染金黄色葡萄球菌12 h后,脂肪体中RfPGRP-L2的表达量显著增加(ANOVA:F2, 6=6.61,P<0.05)(图4: B)。喂食感染大肠杆菌6 h后,肠道中RfPGRP-L2的表达量显著地高于喂食金黄色葡萄球菌组和对照组(ANOVA:F2, 6=16.99,P<0.01)(图5: A),而且喂食金黄色葡萄球菌不能明显地诱导肠道中RfPGRP-L2的表达量上调。喂食感染大肠杆菌和金黄色葡萄球菌均没有明显地影响该基因在脂肪体中的表达量(图5: B)。以上结果表明,RfPGRP-L2参与调控红棕象甲对革兰氏阴性细菌大肠杆菌的肠道免疫反应。
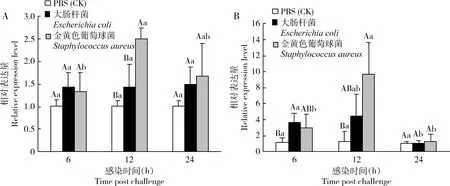
图4 不同细菌注射感染后红棕象甲4龄幼虫肠道(A)和脂肪体(B)中RfPGRP-L2表达量的变化Fig. 4 Changes in expression level of RfPGRP-L2 in the gut (A) and fat body (B) of the 4th instar larvaeof Rhynchophorus ferrugineus after injection challenge with different bacteria各组织分别注射1 μL无菌磷酸盐缓冲液(对照)、大肠杆菌菌液(OD600=1.6)和金黄色葡萄球菌(OD600=1.6)菌液。图中数据为平均值±标准差;柱上大写字母表示同一时间点不同处理间的基因表达量差异显著,小写字母表示同一处理不同时间点间基因表达量差异显著(P<0.05, LSD多重比较检验)。Each tissue was injected with 1 μL sterile phosphate buffered saline (control), Escherichia coli suspension (OD600=1.6) and Staphylococcus aureus suspension (OD600=1.6), respectively. Data in the figure are mean±SD. Capital letters above bars represent significant difference in the gene expression level between different treatments at the same time point, and the lowercase letters represent significant difference in the gene expression level between different time points in the same treatment (P<0.05, LSD multiple comparison test). 图5同The same for Fig. 5.

图5 不同细菌喂食感染后红棕象甲4龄幼虫肠道(A)和脂肪体(B)中RfPGRP-L2表达量的变化Fig. 5 Changes in expression levels of RfPGRP-L2 in the gut (A) and fat body (B) of the 4th instar larvaeof Rhynchophorus ferrugineus after oral challenge with different bacteria幼虫取食涂抹了1 mL OD600=1.6的菌液的甘蔗薄片Larvae were fed with the sugarcane slices smeared with 1 mL bacterial suspension with the OD600 value of 1.6.
2.4 重组蛋白RfPGRP-L2的细菌凝集和抑菌活性
重组蛋白RfPGRP-L2在上清液和沉淀中均有表达,而且沉淀中的表达量明显高于上清液,表明靶蛋白主要以包涵体形式表达。经变复性实验纯化回收和Western blot检测证实,纯化所得RfPGRP-L2的分子量大小符合预期且条带单一,可用于后续功能分析实验(图6)。在没有RfPGRP-L2的情况下,反应体系中的细菌细胞在载玻片上呈现均匀分布的状态;当RfPGRP-L2与大肠杆菌和金黄色葡萄球菌的菌液在25℃ 孵育1 h后, 两种菌液体系都已发生细菌细胞凝集的现象,而且Zn2+的添加对凝集现象没有明显的影响(图7)。结果表明RfPGRP-L2能够识别结合大肠杆菌和金黄色葡萄球菌并引起凝集反应。抑菌测试证实, RfPGRP-L2对大肠杆菌(ANOVA:F3,8=2.92,P=0.10)(图8: A)和金黄色葡萄球菌(ANOVA:F3,8=0.73,P=0.56)(图8: B)的生长都没有显著影响。
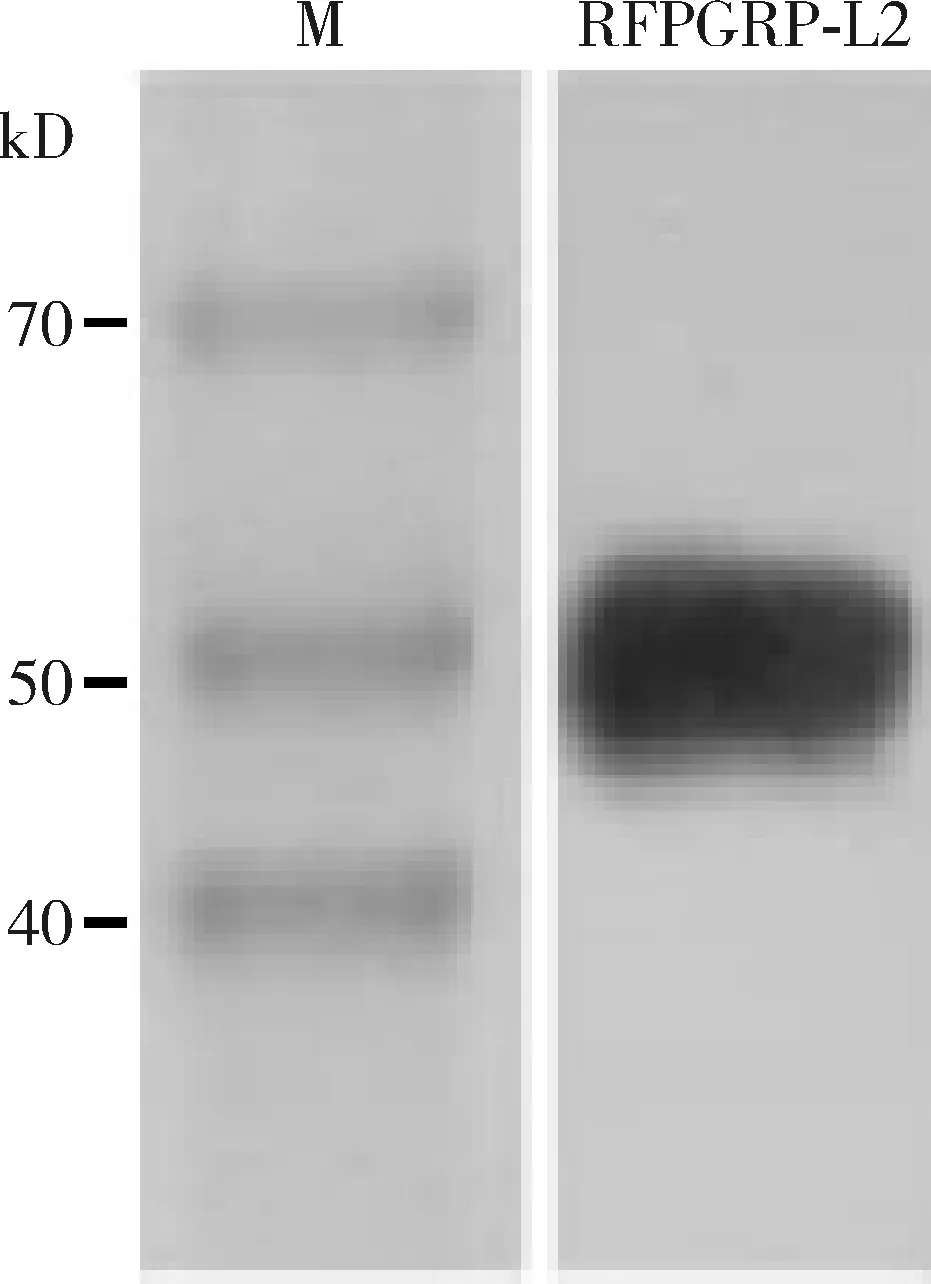
图6 重组蛋白RfPGRP-L2纯化后Western blot检测Fig. 6 Western blot verification of the purifiedrecombinant protein RfPGRP-L2M: 蛋白质分子量标准Protein molecular weight marker.
2.5 RfPGRP-L2的干扰效率
注射dsRNA 48 h后,RfPGRP-L2在红棕象甲4龄幼虫脂肪体(t6=3.10,P<0.05)和肠道(t6=2.59,P<0.05)中的表达量都显著地低于对照组 (图9), 沉默效率分别为66.1%和53.3%, 表明注射dsRfPGRP-L2能够显著地降低RfPGRP-L2在该害虫体内的表达水平。

图7 重组蛋白RfPGRP-L2对大肠杆菌和金黄色葡萄球菌的凝集作用Fig. 7 Agglutination of Escherichia coli and Staphylococcus aureus by the recombinant RfPGRP-L2红色箭头表示观察到的细菌凝集现象;加号表示反应体系中添加重组蛋白RfPGRP-L2或Zn2+,减号表示反应体系中没有添加重组蛋白RfPGRP-L2或Zn2+。The red arrow represents the bacterial agglutination observed. The plus symbol represents the addition of the recombinant protein RfPGRP-L2 or Zn2+ in the reaction system, while the minus symbol represents the absence of the recombinant protein RfPGRP-L2 or Zn2+ in the assays.

图8 重组蛋白RfPGRP-L2对大肠杆菌(A)和金黄色葡萄球菌(B)生长的影响Fig. 8 Effect of the recombinant protein RfPGRP-L2 on the growth of Escherichia coli (A) and Staphylococcus aureus (B)Tris: 只添加Tris盐酸缓冲液Only Tris-HCl buffer was added; Tris+Zn2+: 添加了Tris盐酸缓冲液和Zn2+ Addition of Tris-HCl buffer and Zn2+; RfPGRP-L2: 只添加了重组表达蛋白Only the recombinant protein was added; RfPGRP-L2+Zn2+: 同时添加了重组表达蛋白和Zn2+ Addition of recombinant protein and Zn2+.

图9 红棕象甲4龄幼虫肠道和脂肪体中RfPGRP-L2的RNAi干扰效率Fig. 9 RNAi efficiency of RfPGRP-L2 in the gutand fat body of the 4th instar larvae ofRhynchophorus ferrugineus注射dsEGFP为对照组;图中数据为平均值±标准差;柱上星号表示两组之间基因表达量有显著性差异(P<0.05, t检验)。Injection of dsEGFP as the control group. Data in the figure are mean±SD. Asterisk above bars indicates significant difference in the gene expression level between the two groups (P<0.05, t-test). 图10-12同The same for Figs. 10-12.
2.6 干扰RfPGRP-L2对红棕象甲4龄幼虫清除感染大肠杆菌能力的影响
RfPGRP-L2沉默组试虫血淋巴中的绿色荧光蛋白标记的大肠杆菌菌落数为4 025.00±2 345.74 CFU/mL,是对照组的10倍(t6=3.00,P<0.05)(图10: A),表明RfPGRP-L2的沉默显著降低了血淋巴对感染细菌的清除能力。脂肪体中RfCecropin的表达量显著降低(t6=2.75,P<0.05),而其他3个抗菌肽基因RfDefensin(t6=0.51,P=0.63),RfAttacin(t6=1.60,P=0.16)和RfColeoptericin(t6=2.15,P=0.075)的表达量没有显著变化(图11: A)。肠道中绿色荧光蛋白标记大肠杆菌的菌落数显著增加(t4=2.81,P<0.05)(图10: B),表明该害虫对肠道中感染细菌的清除能力因RfPGRP-L2的沉默而被削弱。肠道中RfCecropin的表达量显著下降(t6=2.78,P<0.05)(图11: B)。上述结果证明RfPGRP-L2不仅参与红棕象甲系统免疫的激活,还介导肠道内的免疫反应来清除所感染的非肠道细菌。
2.7 干扰RfPGRP-L2对红棕象甲4龄幼虫肠道菌群结构组成的影响

图10 大肠杆菌侵染RNAi干扰RfPGRP-L2后的红棕象甲4龄幼虫血淋巴(A)和肠道(B)中菌落数Fig. 10 Number of Escherichia coli colonies in the hemolymph (A) and gut (B) of the 4th instar larvaeof Rhynchophorus ferrugineus after RNAi of RfPGRP-L2

图11 RNAi干扰RfPGRP-L2后红棕象甲4龄幼虫脂肪体(A)和肠道(B)中抗菌肽基因的表达量变化Fig. 11 Changes in the expression levels of antimicrobial peptide genes in the fat body (A) and gut (B)of the 4th instar larvae of Rhynchophorus ferrugineus after RNAi of RfPGRP-L2
RfPGRP-L2被沉默后,肠道中可培养细菌的菌落数为7 733.33±1 950.21 CFU/mL,而对照组肠道中的可培养细菌菌落数为3 300.00±1 452.58 CFU/mL,前者显著大于后者(t4=3.16,P<0.05)(图12),说明RfPGRP-L2的沉默会导致红棕象甲幼虫肠道菌群数量的明显增加。RfPGRP-L2的干扰对菌群物种丰富度(Chao1指数:t6=-0.004,P=0.10; Ace指数:t6=0.34,P=0.75)(图13: A)和群落多样性(Shannon-Wiener指数:t6=-0.25,P=0.81; Simpson指数:t6=-0.11,P=0.92)(图13: B)都没有显著的影响。但是一些肠道细菌的相对丰度因RfPGRP-L2的沉默而发生了改变。例如,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和软壁菌门(Tenericutes)为肠道优势菌(Muhammadetal., 2017),但是RfPGRP-L2被干扰后,软壁菌门的相对丰度增加了41.1%,厚壁菌门的相对丰度减少了67.9%(图14: A)。在科水平上,RfPGRP-L2的干扰导致乳酸杆菌科(Lactobacillaceae)细菌的相对丰度降低了60.9%,而虫原体科(Entomoplasmataceae)和明串珠菌科(Leuconostocaceae)细菌的相对丰度分别增加了68.0%和91.8%(图14: B)。这些数据表明RfPGRP-L2的沉默能够造成红棕象甲幼虫肠道菌群的数量增加并改变肠道菌群的组成结构,说明RfPGRP-L2在红棕象甲肠道菌群稳态的调控中具有重要作用。

图12 RfPGRP-L2干扰后对红棕象甲4龄幼虫肠道中可培养细菌菌落数量的影响Fig. 12 Effect of RNAi of RfPGRP-L2 on the numberof culturable bacterial colonies in the gut of the 4thinstar larvae of Rhynchophorus ferrugineus

图13 RNAi干扰RfPGRP-L2对红棕象甲4龄幼虫肠道细菌物种丰富度(A)和群落多样性(B)的影响Fig. 13 Effect of RNAi of RfPGRP-L2 on the species richness (A) and community diversity (B)of gut bacteria of the 4th instar larvae of Rhynchophorus ferrugineusChao: Chao1指数Chao1 index; Ace: Ace指数Ace index; Shannon: Shannon-Wiener指数Shannon-Wiener index; Simpson: Simpson指数Simpson index. 图中数据为平均值±标准差。Data in the figure are mean±SD.
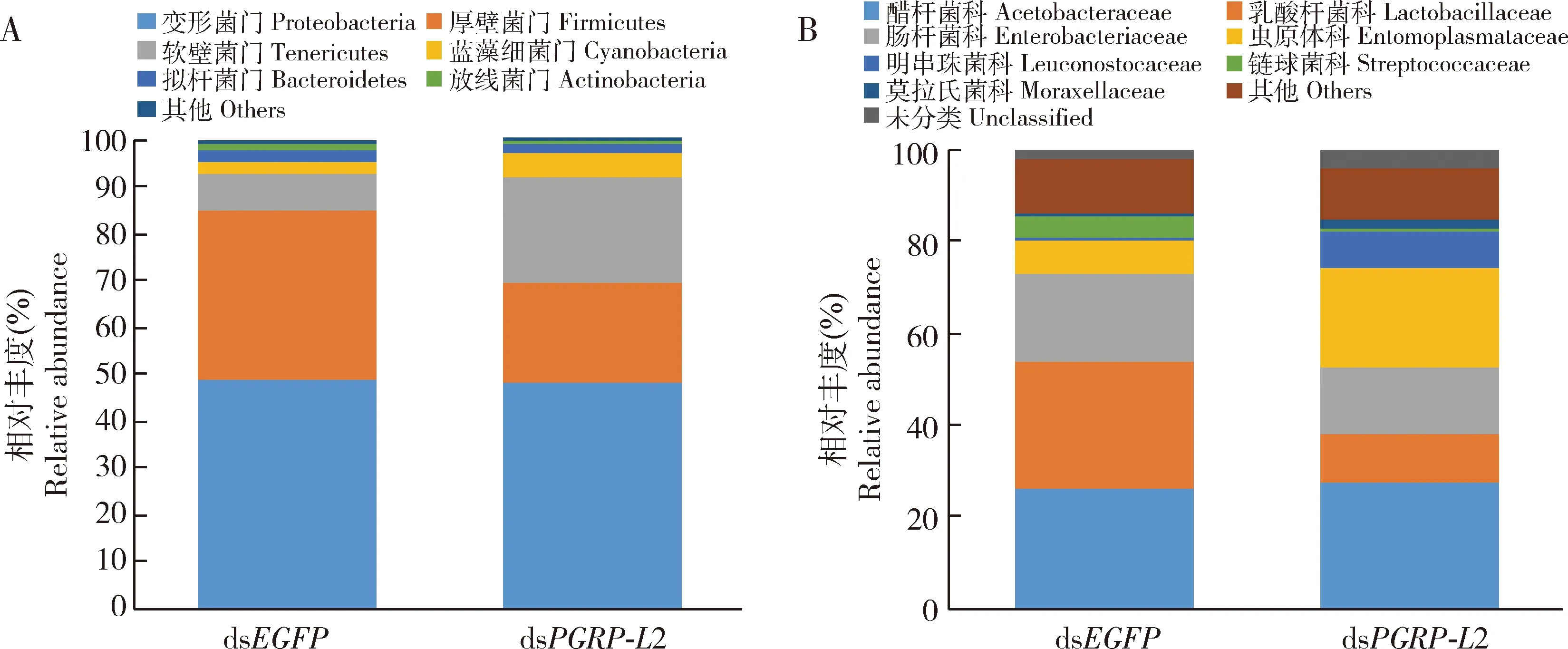
图14 RNAi干扰RfPGRP-L2对红棕象甲4龄幼虫肠道菌群在门(A)和科(B)水平上组成的影响Fig. 14 Effect of RNAi of RfPGRP-L2 on the composition of gut bacteria of the 4th instar larvaeof Rhynchophorus ferrugineus at the levels of phylum (A) and family (B)
3 讨论
本研究发现RfPGRP-L2编码的多肽具有一个PGRP功能结构域(图1),但没有信号肽和跨膜结构域,表明RfPGRP-L2的编码蛋白是一种胞质型肽聚糖识别蛋白(Royetetal., 2011)。现有证据表明具有酰胺酶活性的PGRP一般都有HYHTC 5个保守的氨基酸位点(Chenetal., 2014; Dawadietal., 2018)。但是RfPGRP-L2仅有其中的3个保守酰胺酶活性位点,而另外两个位点均被替换,这暗示红棕象甲的RfPGRP-L2可能不具有酰胺酶活性,从而无法像T7噬菌体溶菌酶和酰胺酶活性PGRPs能够降解肽聚糖(Mellrothetal., 2003; Zaidman-Rémyetal., 2006; Dawadi etal., 2018)。然而有趣的是,我们发现RfPGRP-L2具有一个由VRIG这 4个氨基酸残基所构成的RHIM基序。RHIM基序参与介导形成的功能性淀粉样纤维(Amyloid fibril)为激活IMD免疫信号所必需(Aggarwaletal., 2008; Kleinoetal., 2017)。因此,RfPGRP-L2中的RHIM基序可能在将细菌识别的信号传递至细胞核内、激活相关的免疫信号通路并激发效应因子(如抗菌肽)的产生过程中扮演关键角色。此外,Pirk是NF-кB信号通路中的一个重要负调控因子(Kleinoetal., 2008),可以通过PGRP-LC和-LE中的RHIM基序特异性地与Imd互作进而抑制功能性淀粉样纤维的形成,从而阻碍IMD下游信号的转导(Lhocineetal., 2008; Kleinoetal., 2017)。因此,该保守基序的存在暗示RfPGRP-L2可能是红棕象甲相关免疫信号通路中的一个重要负调控作用靶标,以避免该害虫体内免疫系统的过度激活从而维持健康的免疫稳态。
RT-qPCR检测发现RfPGRP-L2在血淋巴、脂肪体和肠道等免疫相关组织中的表达丰度明显高于其他组织(图3),这暗示RfPGRP-L2可能参与介导调控红棕象甲的免疫反应(Dawadietal., 2018)。大肠杆菌和金黄色葡萄球菌的感染均能显著诱导RfPGRP-L2的表达。Muhammad等(2019b)研究发现,肠道菌群能够上调红棕象甲的相关免疫基因并增强其免疫防御活性。这些证据说明部分对宿主无害的微生物能够刺激宿主体内免疫基因的表达从而提高宿主对病原微生物的免疫力。另外,重组表达的RfPGRP-L2可以引起大肠杆菌和金黄色葡萄球菌发生凝集反应(图7),这说明RfPGRP-L2既可以识别含DAP型PGN的革兰氏阴性细菌,也能识别含Lys型PGN的革兰氏阳性细菌。细菌的喂食感染能够使肠道中RfPGRP-L2的表达显著上调(图5: A),而对脂肪体中的表达量无显著影响(图5: B),这可能是由于脂肪体和肠道中可能存在不同的免疫调控机制(Tzouetal., 2000)。更为有趣的是,RfPGRP-L2被干扰后,红棕象甲幼虫的血淋巴和肠道清除绿色荧光蛋白标记的大肠杆菌的能力被显著地抑制(图10),脂肪体中抗菌肽基因RfCecropin的表达量显著低于对照组(图11: A)。这些数据说明RfPGRP-L2干扰在一定程度上阻碍了该害虫的系统免疫和肠道局部免疫的应答反应。另外,体外研究还证实重组蛋白RfPGRP-L2不能抑制细菌的生长(图8),说明红棕象甲的RfPGRP-L2不具有酰胺酶活性,无法降解细菌PGN抑制细菌的生长。这可能是由于RfPGRP-L2不含有酰胺酶活性所必需的5个保守氨基酸位点所致(Chenetal., 2014; Dawadietal., 2018)。
我们的前期工作发现,相比Toll-like pathway而言,核转录因子RfRelish介导的IMD-like信号通路在红棕象甲与其肠道菌群共生关系的维持中占主导地位,这可能是由于肠道菌群主要由革兰氏阴性细菌所构成(Xiaoetal., 2019; Muhammadetal., 2020)。在本研究中,RfPGRP-L2的沉默造成了肠道中可培养细菌菌落数的显著增加(图12),并且改变了其肠道菌群的组成结构(图14);而且肠道中RfCecropin的表达量也显著低于对照组(图11: B)。这表明RfPGRP-L2的沉默阻碍了肠上皮细胞对来自肠道菌群PGN的识别,进而影响了相关免疫信号通路的激活及抗菌肽的产生。抗菌肽是动物调控其肠道微生物的一种关键免疫效应因子(Ryuetal., 2008)。因此,RfPGRP-L2沉默导致肠道免疫效应基因表达的降低削弱了该害虫对其肠道菌群的调控,从而造成了肠道细菌数量的增加及其组成的改变。在前期研究中,我们发现红棕象甲具有跨膜型、分泌型和胞质型3种不同类型的PGRP,其中两个具有酰胺酶活性的肽聚糖识别蛋白RfPGRP-S1和RfPGRP-LB都能降解肽聚糖而避免肠道免疫的过度激活来调控该害虫的肠道菌群稳态(Dawadietal., 2018; 王兴红, 2018)。然而,调控这些分泌型PGRP产生的机理还不清楚。例如,RfPGRP-L2是否与这些分泌型PGRP之间存在互作?它们之间的互作在该害虫肠道菌群稳态的调控中扮演什么角色?这些问题还需要进一步的深入研究。

