外周血胃饥饿素水平与幽门螺杆菌感染患者胃黏膜萎缩程度的关系研究
胡静娴 张绍仁 蒋 淼
萎缩性胃炎是一种以胃黏膜腺体萎缩和(或)肠上皮化生为主要特征的慢性疾病,其发生、发展是一个复杂的过程,可能是由于长期的幽门螺杆菌(Hp)感染或自身免疫性胃炎所致[1]。一项荟萃分析显示中,Hp感染与萎缩性胃炎患病率比值为2.4~7.6,总估计数为5.0(95%CI:3.1~8.3)[2]。在没有Hp感染的情况下,慢性萎缩性胃炎的发生率较低,提示慢性萎缩性胃炎的发生与Hp感染密切相关。慢性萎缩性胃炎被认为是胃癌发病机制中的首要环节,并且萎缩程度越严重,胃癌的发生率越高[3]。2005年国际萎缩研究小组提出了胃黏膜萎缩程度及范围的分期标准,即慢性胃炎评价标准——OLGA分期系统[4-6],这是基于胃炎新悉尼系统[7]对胃黏膜萎缩程度的半定量评分方法,采用胃炎分期代表胃黏膜萎缩范围及程度, 将慢性胃炎的组织病理学与癌变风险联系起来,为临床医生提供较为直观的信息。然而OLGA分期系统需要在胃镜下取活组织检查,是一种创伤性检查,不能被所有患者接受,因此寻找能替代活组织检查的血清标志物显得尤为重要。
胃饥饿素是生长激素促分泌受体的天然配体,是Kojima等[8-9]于1992年在小鼠胃黏膜里首次发现的,并且被认为是胃内生长激素释放的调节剂。有研究采用免疫组织化学法发现,分泌胃饥饿素的Gr细胞和胃底黏膜X/A细胞同时存在,分别位于胃体和胃底酸腺的较低位置。空腹情况下胃饥饿素被分泌出来进入体循环,而不是进入胃肠道。本研究旨在探究Hp感染患者外周血清胃饥饿素水平与OLGA不同分期之间的关系。
1 资料与方法
1.1 一般资料
选择2018年8月至2019年8月在复旦大学附属金山医院消化内科门诊就诊,并经14C尿素呼气试验检测呈阳性的217例Hp感染患者作为研究对象。所有患者均留取外周血标本,行电子胃镜检查,并取胃黏膜组织(胃窦3块,胃体2块)行病理检查,按OLGA分期系统将胃黏膜萎缩程度分为5期。排除标准:(1)年龄<18岁;(2)有糖尿病;(3)有甲状腺疾病及神经内分泌肿瘤;(4)有糖皮质激素、孕酮、睾酮服用史;(5)肾衰竭或肝衰竭;(6)曾接受化学治疗;(7)酗酒史;(8)近4周内曾使用质子泵抑制剂(PPI)、H2受体拮抗剂、抑酸药、抗生素治疗;(9)体质量指数(BMI)≥30 kg/m2;(10)妊娠期妇女;(11)既往有上消化道切除手术史;(12)胃镜检查未能完成;(13)胃镜活组织取材不完全(按照胃炎新悉尼系统标准[7]分别于胃窦、胃角切迹、胃体取材,否则为取材不完全)。排除上述患者后,胃镜下诊断为胃炎、胃溃疡或胃癌(非神经内分泌肿瘤)等患者均纳入统计。所有患者均签署知情同意书,本研究经医院医学伦理委员会批准(批准号:金医伦理科研-2017-03-01)。
1.2 Hp测定
Hp检测采用14C尿素呼气试验,于清晨空腹时检测,采用UBT-20型Hp测试仪(深圳市中核海得威生物科技有限公司)。
1.3 胃黏膜萎缩程度分期的评定
采用免疫组织化学法对胃镜所取胃黏膜组织进行检查。首先按照胃炎新悉尼系统标准[7],对每块胃黏膜组织进行萎缩程度的4级评分:(1)0分 腺体未发生萎缩;(2)1分 腺体轻度萎缩,萎缩腺体占比≤30%;(3)2分 腺体中度萎缩,萎缩腺体占比>30%、≤60%;(4)3分 腺体重度萎缩,萎缩腺体占比>60%。然后,综合胃窦和胃体黏膜的萎缩评分结果,按照OLGA分期系统将胃黏膜萎缩程度分为5期,分别为0期、Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期,将这5期患者设为5组。见表1。
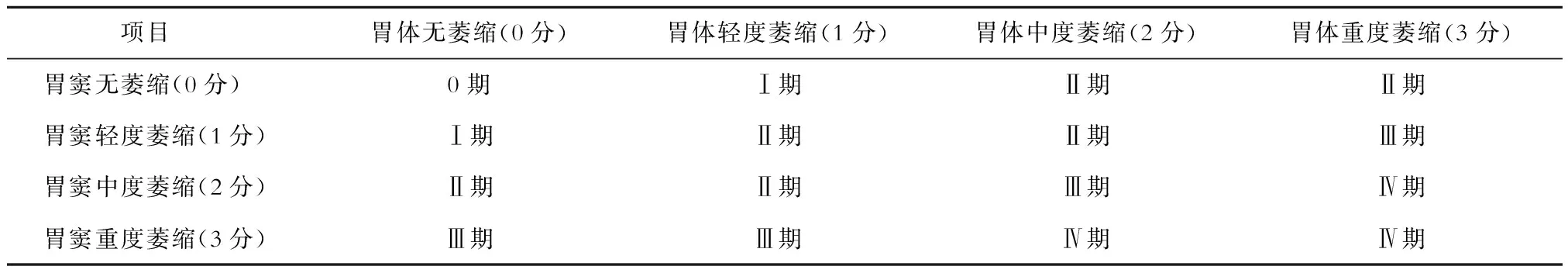
表1 OLGA分期的评定
1.4 检测外周血胃饥饿素水平
本研究所有患者在禁食12 h后,于上午8~10点采集血样,以检测外周血胃饥饿素水平。将收集于血清分离管的全血标本在室温下以1 000r/min离心20 min,取上清液放入EP管中,置于-80 ℃冰箱待测。所有标本分批采用人胃泌素(Gas)酶联免疫吸附测定(ELISA)试剂盒(上海酶联生物科技有限公司)检测外周血胃饥饿素水平,具体操作方法:(1)将试剂盒在室温中平衡20 min后,取出所需板条,剩余板条用自封袋密封放回4 ℃;(2)设置标准品孔和样本孔,每个样本孔设2个副孔;(3)除空白孔外,标准品孔和样本孔每孔加入辣根过氧化物酶(HRP)标记的检测抗体,用封板膜封住反应孔,37 ℃水浴锅或恒温箱温育60 min;(4)弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次;(5)每孔加入底物,37 ℃避光孵育15 min;(6)每孔加入终止液,15 min内在450 nm波长处测定各孔的光密度(OD)值;(8)以所测标准品的OD值为横坐标,标准品的浓度值为纵坐标,在坐标纸上或用相关软件绘制标准曲线,得到直线回归的方程,将样品的OD值代入方程,计算出样品的浓度。
1.5 统计学方法

2 结果
2.1 不同性别患者的外周血胃饥饿素比较
本研究共纳入患者217例,其中男性102例,女性115例,平均外周血胃饥饿素水平分别为(97.37±15.79)fmol/mL、(98.05±13.60)fmol/mL,两组间差异无统计学意义(P>0.05),提示性别与外周血胃饥饿素无明显相关性。
2.2 不同年龄患者的外周血胃饥饿素比较
本研究患者年龄分布在18~84岁,Pearson相关性分析显示,年龄与外周血胃饥饿素无明显相关性(P>0.05)。见图1。
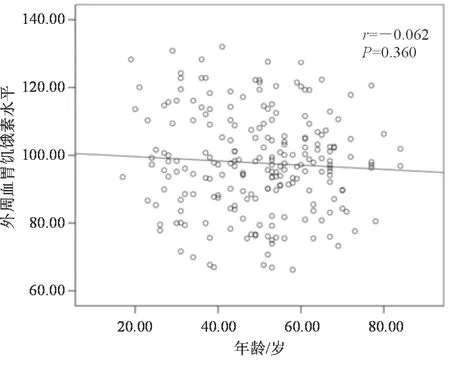
图1 年龄与外周血胃饥饿素的相关性分析
2.3 不同OLGA分期组患者的外周血胃饥饿素比较
不同OLGA分期组患者的性别、年龄及外周血胃饥饿素水平详见表2。卡法检验和方差分析结果显示,不同OLGA分期组性别、年龄间差异均无统计学意义(P均>0.05)。t检验、组间比较结果显示,5组患者的外周血胃饥饿素水平差异有统计学意义(P<0.05)。两两比较结果显示,不同OLGA分期组间外周血胃饥饿素水平差异均有统计学意义(P均<0.05)。 结果提示,胃黏膜萎缩越严重,OLGA分期越高,则外周血胃饥饿素水平越低,两者呈负相关。

表2 不同OLGA分期组患者的外周血胃饥饿素比较
3 讨论
萎缩性胃炎的病因包括Hp感染和自身免疫性胃炎[10]。中国自身免疫性胃炎的发病率较低,绝大多数萎缩性胃炎是由于Hp感染引起的。本研究旨在探讨外周血中活性胃饥饿素与胃黏膜腺体萎缩程度之间的关系,考虑到萎缩性胃炎在消化内科门诊患者中的比例较低,而Hp感染患者中胃黏膜萎缩的比例相对较高,因此选择14C呼气试验阳性的Hp感染患者,这样可提高本研究的可行性。有荟萃分析显示,Hp感染与萎缩性胃炎的患病率比值为2.4~7.6[2],本研究的数据是2.78。
胃饥饿素的羟基有丝氨酸残基,根据丝氨酸残基是否被正辛酸酰基化,分为酰基化胃饥饿素和非酰基化胃饥饿素,这种酰基化作用对胃饥饿素与其受体(GHS-R1a)的结合,以及对生长激素的释放都有至关重要的作用[7,11-13],非酰基化胃饥饿素无太多的生理功能。本研究所检测的是酰基化胃饥饿素,即有生理活性的胃饥饿素。
胃饥饿素主要在胃中产生,少量分泌于其他器官,如肠、胰腺、肾脏、下丘脑等[14-15]。有研究表明,全胃切除后循环胃饥饿激素水平立即下降到术前水平的10%~20%,证明了胃是胃饥饿素的主要来源[16-17]。胃萎缩就是指胃内腺体的消失[18-19],由此推测胃内腺体萎缩越严重,分泌胃饥饿素的Gr细胞和胃底黏膜X/A细胞损伤越严重,外周血胃饥饿素水平也越低。
本研究结果表明,外周血胃饥饿素水平与OLAG分期呈负相关,分期越高,胃黏膜萎缩程度越严重,则外周血胃饥饿素水平越低。此结果提示,外周血胃饥饿素有望成为胃黏膜萎缩程度的血清学标志物,可通过胃饥饿素水平来判断胃黏膜萎缩的程度。本研究存在样本量较小等不足之处,今后还需进行多中心大样本的调查,以进一步验证本研究结论。

