沉默miR-216a对四氯化碳诱导的肝纤维化模型大鼠的保护作用及机制研究
卢帅军 汪 芳 张步荣 王卫华
肝纤维化是一个复杂的病理生理过程,主要病理表现为肝脏中结缔组织异常增生、沉积等,若不及时进行干预,易进展为肝硬化,甚至肝细胞癌[1-2]。目前,临床亟需研发预防和治疗肝纤维化的有效药物,以抑制肝纤维化进展,降低因肝纤维化导致的死亡风险。近年来多项研究指出,肝纤维化的发病机制与第10号染色体缺失性磷酸酶及张力蛋白同源物基因(PTEN)和母亲DPP同源物7(Samd7)有关[3-6]。另有研究表明,miR-216a可靶向心脏成纤维细胞中的PTEN和Samd7,促进成纤维细胞增殖和胶原纤维沉积[7]。基于上述研究,推测miR-216a可靶向PTEN和Samd7参与肝纤维化的发生及发展过程。本文对此展开研究,以期为肝纤维化的预防和治疗提供参考。
1 材料与方法
1.1 实验动物
本实验选取50只SD大鼠,均购自凯斯艾生物科技(苏州)有限公司[生产许可证号:SYXK(苏)2017-0041]。所有大鼠均适应性饲养1周,控制昼夜交替间隔为12 h,期间给予充足的普通饲料和水,室温为25 ℃,湿度为60%。
1.2 试剂与仪器
透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(ⅣC)的酶联免疫吸附测定(ELISA)试剂盒均购自南京道斯夫生物科技有限公司。苏木精-伊红(HE)染色试剂盒、Masson染色试剂盒均购自北京索莱宝公司。DYCZ-24DN型垂直电泳槽、DYY-6C稳流稳压电泳仪均购自北京六一生物科技有限公司。7600型全自动生化分析仪购自日本日立公司。
1.3 肝纤维化大鼠模型制备及干预
采用腹腔注射含四氯化碳(CCl4)的橄榄油溶液方法制备肝纤维化模型大鼠[8]。随机选取10只大鼠作为正常组,其余40只大鼠腹腔注射40%的CCl4溶液,按2 mL/kg的标准给药,每周给药2次,共给药12次。给药8次后,随机抽取4只大鼠处死,采用HE染色和Masson染色方法判断肝纤维化大鼠模型是否制备成功。造模期间有6只大鼠死亡,将造模成功的30只大鼠随机分为模型组、对照组和沉默组,每组10只,对照组尾静脉注射含空载质粒的腺病毒,沉默组尾静脉注射含si-miR-216a质粒的腺病毒。
1.4 指标检测
1.4.1 HE染色和Masson染色 采用HE染色方法观察肝脏组织的病理损伤情况,采用Masson染色方法观察肝脏组织的胶原纤维沉积情况。于末次给药后3 d处死各组大鼠,取其肝脏组织,使用4%多聚甲醛固定,石蜡包埋切片,脱蜡和水化,最后采用HE染色和Masson染色方法观察各组大鼠肝脏组织的病理变化。
1.4.2 HA、LN、PCⅢ和ⅣC表达水平检测 取处死后大鼠的心脏静脉血4 mL,3 500 r/min离心15 min,取上清液,将其保存于-20 ℃冰箱中待测。采用ELISA法检测各组大鼠HA、LN、PCⅢ和ⅣC的表达水平。
1.4.3 miR-216a、PTENmRNA和Samd7 mRNA表达水平检测 采用实时荧光定量聚合酶链反应(real-time qPCR)法检测各组大鼠肝脏组织中miR-216a、PTENmRNA和Samd7 mRNA表达水平[9]。实验步骤:(1)取处死后大鼠的肝脏组织,研磨后得到组织匀浆,离心后取上清液;(2)应用TRIzol试剂(日本TaKaRa公司)提取上清液中的总RNA;(3)应用6011A PrimeScriptTM1st Strand cDNA Synthesis Kit(日本TaKaRa公司)将RNA反转录成cDNA;(4)使用PCR仪(美国Bio-Rad公司)扩增cDNA,扩增条件为95 ℃预变性5 min,之后95 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,共35个循环。以U6作为内参,引物均由上海生工生物工程技术服务有限公司设计,序列见表1。采用2-ΔΔCt表示目的基因的相对表达量。

表1 引物序列
1.4.4 PTEN和Samd7表达水平检测 采用蛋白质印迹法检测各组大鼠肝脏组织中PTEN和Samd7的表达水平[10]。实验步骤:(1)取处死后大鼠的肝脏组织,用RIPA裂解液裂解肝脏细胞,提取总蛋白;(2)采用BCA法进行蛋白定量;(3)用10% SDS-PAGE分离胶进行电泳,电压80~120 V至溴酚蓝跑出胶面;(4)电流300 mA转膜,5%脱脂牛奶室温封闭1 h;(5)滴加一抗(北京百奥莱博科技有限公司),4 ℃孵育过夜;(6)滴加二抗(北京百奥莱博科技有限公司),室温封闭2 h;(7)ELC显影;(8)ImageJ软件读取结果。内参为GAPDH。
1.5 统计学方法

2 结果
2.1 各组肝脏组织的病理变化
如图1所示,HE染色图像显示正常组的肝脏组织细胞未见坏死、炎性细胞浸润;模型组和对照组肝脏组织细胞呈片状坏死,炎性细胞浸润明显;沉默组肝脏组织细胞坏死、炎性细胞浸润情况均较对照组有明显改善。如图2所示,Masson染色图像显示正常组肝脏组织中未见胶原纤维沉积;模型组和对照组肝脏组织中均存在严重的胶原纤维沉积;沉默组肝脏组织中胶原纤维沉积情况较对照组有明显改善。上述结果提示沉默miR-216a对CCl4诱导的肝纤维化模型大鼠有保护作用。
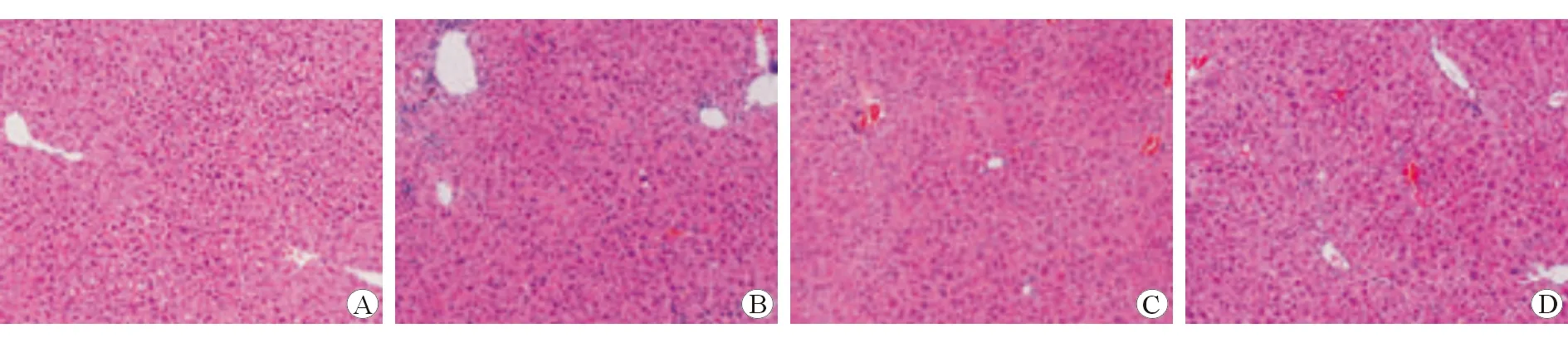
图1 各组肝脏组织病理图像 HE染色 ×100 A 正常组 B 模型组 C 对照组 D 沉默组

注:黄色箭头所示为胶原纤维沉积
2.2 各组HA、LN、PCⅢ和ⅣC表达水平比较
与正常组比较,模型组HA、LN、PCⅢ和ⅣC表达水平均升高,差异均有统计学意义(P均<0.05)。与模型组和对照组比较,沉默组HA、LN、PCⅢ和ⅣC表达水平均降低,差异均有统计学意义(P均<0.05)。见表2。
2.3 各组miR-216a、PTEN mRNA和Samd7 mRNA的相对表达量比较
Real-time qPCR法检测结果显示,与正常组比较,模型组PTENmRNA和Samd7 mRNA相对表达量均降低,miR-216a相对表达量升高,差异均有统计学意义(P均<0.05)。与模型组和对照组比较,沉默组PTENmRNA和Samd7 mRNA相对表达量均升高,miR-216a相对表达量降低,差异均有统计学意义(P均<0.05)。见表3。

表2 各组HA、LN、PCⅢ和ⅣC的表达水平比较/ng·mL-1

表3 各组miR-216a、PTEN mRNA和Samd7 mRNA的相对表达量比较
2.4 各组PTEN和Samd7的相对表达量比较
蛋白质印迹法结果显示,与正常组比较,模型组PTEN和Samd7相对表达量均降低,差异均有统计学意义(P均<0.05)。与模型组和对照组比较,沉默组PTEN和Samd7相对表达量均升高,差异均有统计学意义(P均<0.05)。见表4、图3。

表4 各组PTEN和Samd7的相对表达量比较
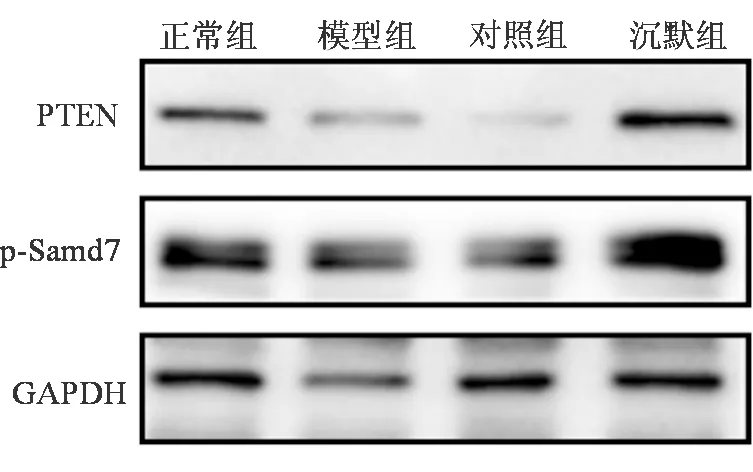
图3 各组PTEN和Samd7表达的蛋白电泳图
3 讨论
微RNA(miRNA)是一类不具备编码蛋白质功能的单链RNA,由18~24个核苷酸组成,已被多项研究证实可参与人类疾病的发生及发展过程[11-12]。近年来,越来越多的miRNA被证实与肝纤维化有关,如miR-146a[13]、miR-29b[14]和miR-214[15]等。miR-216a作为miRNA家族中的一员,已被证实与子宫内膜癌[16]、胰腺癌[17]和乳腺癌[18]等有关,但其与肝纤维化关系的报道较少。本文主要探究沉默miR-216a对CCl4诱导的肝纤维化模型大鼠的干预效果及其作用机制。
本研究采用HE染色和Masson染色判断肝纤维化大鼠模型造模是否成功,通过观察病理图像可知经CCl4诱导后,大鼠肝脏组织细胞呈片状坏死,炎性细胞浸润明显,并伴有严重的胶原纤维沉积,表明肝纤维化大鼠模型造模成功。此外,本研究结果显示沉默组miR-216a的表达水平低于对照组,表明沉默miR-216a表达成功。
HA、LN、PCⅢ和ⅣC的表达水平是反映肝纤维化程度的重要参考指标,常被用于评估患者的肝纤维化程度[19-20]。本研究结果表明,沉默组HA、LN、PCⅢ和ⅣC水平均低于对照组和模型组,提示沉默miR-216a可降低肝纤维化大鼠HA、LN、PCⅢ和ⅣC的表达水平。此外,病理染色图像显示,沉默组肝脏组织细胞坏死、炎性细胞浸润及胶原纤维沉积情况均较对照组和模型组有明显改善。上述结果均表明沉默miR-216a对CCl4诱导的肝纤维大鼠有保护作用。
PTEN和Samd7是miR-216a的靶基因[7],可参与肝纤维化的发病和进展。有报道指出,下调PTEN和Samd7表达可激活纤维化信号通路,从而加重相应组织或器官的纤维化程度[21]。本研究结果显示,模型组和对照组中PTENmRNA、Samd7 mRNA、PTEN和Samd7表达均有不同程度下调,而沉默组PTENmRNA、Samd7 mRNA、PTEN和Samd7水平均升高,提示沉默miR-216a可能通过上调PTEN/Samd7信号通路,发挥其抗肝纤维化作用。
综上所述,沉默miR-216a可降低肝纤维化大鼠HA、LN、PCⅢ和ⅣC的表达水平,改善CCl4诱导的肝纤维化损伤,其机制可能与调控PTEN/Smad7信号通路有关。

