原发性胆汁性胆管炎合并非酒精性脂肪性肝炎一例
何红梅 徐姝嫣 卞兆连
原发性胆汁性胆管炎(PBC)原名原发性胆汁性肝硬化,是器官特异性的慢性胆汁淤积性自身免疫性肝病[1]。PBC患者早期常有轻度乏力和间歇性瘙痒,半数患者有轻度肝肿大,血清碱性磷酸酶(ALP)和(或)γ-谷氨酰转肽酶(GGT)增高常为唯一阳性发现,也可有抗线粒体抗体(AMA)、抗核抗体(ANA)阳性;肝脏活组织病理检查可确诊,并可诊断疾病发展阶段及预测预后。PBC不仅常与骨质疏松、高胆固醇血症等合并存在,也常与类风湿关节炎、干燥综合征、硬皮病等自身免疫性疾病合并存在,然而目前临床上PBC合并非酒精性脂肪性肝炎(NASH)鲜有报道。本文报道1例PBC合并NASH的患者,以期提高临床的认识。
1 临床资料
患者,女性,38岁,身高163 cm,体质量80 kg,腰围90 cm,因“体检发现肝功能异常11 d”于2019年6月27日入院。无乏力、恶心、厌油等不适,既往体健,否认高血压、糖尿病、慢性肝炎等病史。肝功能检测:丙氨酸氨基转移酶(ALT)160 U/L,天冬氨酸氨基转移酶(AST)143 U/L,GGT 150 U/L,总胆红素(TBil)13.8 μmol/L。胃镜示贲门局部黏膜糜烂,慢性浅表性胃炎。CT示脂肪肝。诊断为“肝功能异常,脂肪肝”收住入院。给予异甘草酸镁护肝降酶、泮托拉唑抑酸治疗。
患者入院后完善检查。查体:神志清,精神尚可,皮肤巩膜无黄染,浅表淋巴结未及肿大,腹部平软,无腹壁静脉曲张,无压痛,无反跳痛,未触及包块,肝脾肋下未及,墨菲征阴性,移动性浊音阴性。血液生物化学检测示:ALT 248 U/L(0~40 U/L),AST 208 U/L(0~40 U/L),GGT 165 U/L(0~50 U/L),碱性磷酸酶(ALP)79 U/L(40~140 U/L),空腹血糖 9.14 mmol/L(3.9~6.10 mmol/L),三酰甘油(TG)2.61 mmol/L(0.4~1.88 mmol/L),糖类抗原19-9(CA19-9)69.39 U/mL(0~27 U/mL);铜蓝蛋白 345 mg/L(250~630 mg/L),铁蛋白 314.75 ng/mL(女性4.63~204.00 ng/mL),红细胞沉降率(ESR)30 mm/h(0~20 mm/h),糖化血红蛋白7.0%(3.8%~5.8%)。血常规、乙型肝炎三对半、丙型肝炎、凝血系列、甲胎蛋白(AFP)均未见异常。肝脏B超和瞬时弹性成像示:肝脏硬度明显增加,脂肪衰减明显,提示脂肪肝。上述结果提示这是一例典型的脂肪肝患者。由于患者肝功能异常指标中,GGT的增高与ALT不成比例,故考虑患者可能不是单纯患有脂肪肝,遂检测了自身免疫性肝病抗原谱:抗gp210抗体阳性,抗核抗体(ANA)、AMA-M2型、抗丙酮酸脱氢酶M2亚基抗体、抗Sp100抗体、抗早幼粒细胞白血病蛋白抗体、抗肝肾微粒体抗体、抗肝细胞溶质抗原Ⅰ型、抗可溶性肝-胰抗原、抗Ro52抗体均为阴性;ANA滴度<1∶100,ANA间接免疫荧光分型为阴性。免疫球蛋白G(IgG)12.80 g/L(5.94~16.2 g/L),IgM 4.04 g/L(0.6~2.63 g/L),IgA 2.69 g/L(0.68~3.78 g/L)。结合抗gp210抗体阳性和IgM增高,考虑该患者脂肪肝可能合并PBC。为明确诊断,遂行肝穿刺活组织病理检查,病理示肝脏已存在早期肝硬化的表现,在脂肪肝的基础上,发现汇管区有明显的胆管上皮破损和胆管周围炎,以及淋巴滤泡的形成(图1),结合患者的血清学改变,最终确诊为PBC合并NASH。治疗上予以加用熊去氧胆酸及骨化三醇。经过积极的保肝治疗后,患者肝功能各项指标均有改善(ALT 49 U/L,AST 34 U/L,GGT 110U/L,ALP 75 U/L)。
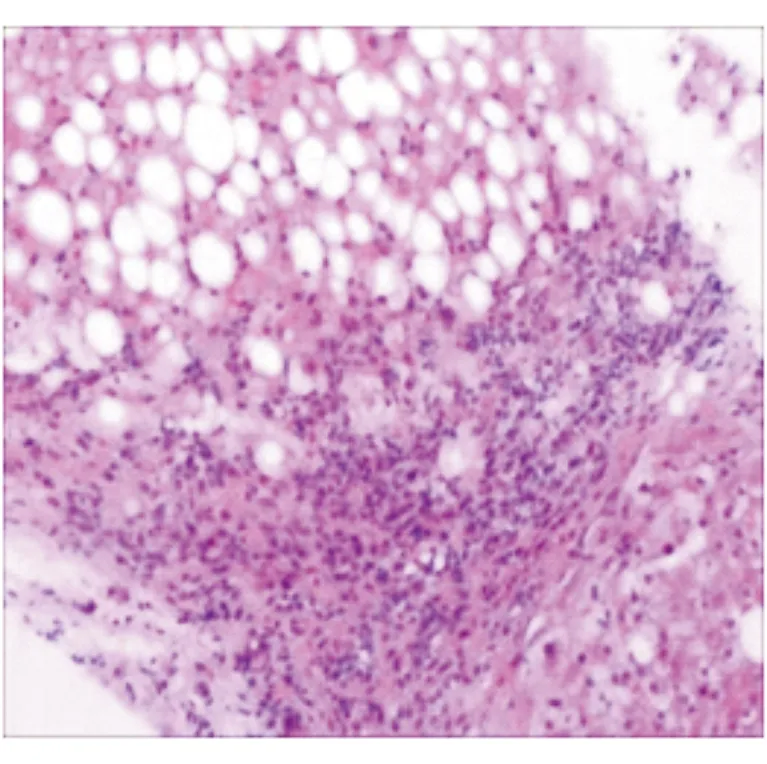
图1 肝穿刺活组织病理图像 苏木精-伊红染色 ×200
2 讨论
随着近年来生活条件的好转,非酒精性脂肪性肝病(NAFLD)的发病率也呈逐年升高趋势,成为中国发病率第1位的慢性肝病[2]。研究报道中国成年人NAFLD患病率高达25%,患病人数约3亿,其中10%~30%可进展为NASH,3%~5%可进展为肝纤维化、肝硬化,甚至进展为肝细胞癌(HCC)[3]。NASH是指除外乙醇和其他明确的损肝因素所致的,以肝细胞内脂肪过度沉积为主要特征的临床病理综合征,是与胰岛素抵抗和遗传易感性密切相关的获得性代谢应激性肝损伤,是以肝细胞脂肪变、肝细胞气球样变性、小叶内和(或)汇管区炎性反应,伴或不伴纤维化为特征的代谢性疾病[4]。《非酒精性脂肪性肝病防治指南(2018更新版)》指出,目前针对NAFLD尚无特效药物,改变不良生活方式(饮食及运动等),降低体质量和缩小腰围是重要的预防和治疗措施[5]。
PBC是一种自身免疫性肝病,好发于中青年女性,通常进展缓慢,绝大多数患者的血清AMA阳性[6]。血清AMA是诊断PBC的特异性指标,尤其是AMA-M2型的阳性率为90%~95%。此外,研究显示约有50%的PBC患者的ANA阳性,在AMA阴性时可作为诊断的另一重要指标。对PBC较为特异的ANA包括抗Sp100、抗Gp210、抗p62等[7]。临床表现为慢性进行性胆汁淤积,主要表现为伴或不伴黄疸的瘙痒,非特异性的症状如乏力、右上腹痛,以及肝硬化失代偿表现如腹水、食管-胃底静脉曲张出血等。多数患者确诊时可无临床症状,因此易漏诊、误诊。目前熊去氧胆酸为唯一推荐的治疗PBC的药物,应尽早使用,长期用药可改善患者的血清学及组织学异常,延缓疾病进展,改善预后。本例患者体型偏胖,肝功能示AST、ALT、GGT升高,ALP正常,肝脏B超和瞬时弹性成像示肝脏硬度明显增加,脂肪衰减明显,提示脂肪肝。由于GGT的增高与ALT不成比例,故检测了自身免疫性肝病抗原谱示AMA阴性、抗Gp210抗体阳性,Ig检测示IgM升高。《2017年欧洲肝病学会临床实践指南:原发性胆汁性胆管炎的诊断和管理》[5]中指出,在AMA呈阴性时,ANA阳性可作为诊断PBC的另一重要指标,由此怀疑该患者脂肪肝可能合并了PBC,随后行肝穿刺活组织病理检查示肝脏存在早期肝硬化表现,在脂肪肝的基础上,汇管区有明显的胆管上皮破损和胆管周围炎,以及淋巴滤泡的形成,最终确诊为PBC合并NASH。
本例PBC合并NASH主要与药物性肝病相鉴别。药物性肝病指因药物或其代谢产物引起的肝细胞毒性损害及过敏反应所致的疾病,可导致慢性肝损伤。PBC与药物性肝病的平均发病年龄相近,且均好发于女性,有疲劳、厌食、上腹部不适和黄疸等症状;两者的区别在于药物性肝病患者的AST、ALT升高较为明显,而PBC患者的ALP、GGT升高较为明显。药物性肝病患者的Ig不升高,病理主要表现为胆管上皮样肉芽肿、肝细胞坏死或丢失、毛细胆管和肝细胞胆汁淤积等。本例患者的肝功能示AST、ALT、GGT升高,ALP正常,易误诊为药物性肝病,详细询问病史得知患者近期无服用损肝药物,结合肝穿刺活组织病理检查结果,排除了药物性肝病。
从本病例的诊断中得到的经验体会是:(1)诊断不能局限于一元论。脂肪肝患者常有肝功能异常、高血脂、高血糖等代谢综合征表现,排除病毒性肝炎、酒精性肝病、药物性肝病后,结合CT及B超均提示脂肪肝。若不注意到GGT的增高与ALT不成比例,就不会考虑进行肝穿刺活组织病理检查,则可能漏诊。(2)肝脏活组织病理检查是诊断的金标准。此患者抗gp210抗体阳性及IgM增高,考虑有PBC可能,及时行肝穿刺活组织病理检查对确诊非常重要。

