抑制miR-152 对低氧诱导子痫前期滋养细胞增殖凋亡侵袭能力的影响及机制
徐曼,安泓润,郝媛媛
河北中石油中心医院,河北廊坊065000
子痫前期(PE)属于妊娠期高血压疾病,是一种严重的产科并发症,以孕妇高血压和蛋白尿为临床特征,对孕妇和胎儿均构成严重威胁,是孕妇和胎儿死亡的主要原因之一[1-2]。目前PE 的发病机制尚不完全清楚,临床上尚缺乏有效的治疗手段。PE 的发生被认为是一个多因素的过程,包括胎盘和内皮功能障碍、螺旋动脉重构异常、滋养细胞侵袭受损和凋亡增加等[3-4]。滋养细胞功能异常已被认为是PE 发病过程中一个极其重要的因素[5]。近年来研究发现,PE 患者的胎盘中存在着数百差异表达的微小RNA(miRNAs),这些异常表达的miRNA 可能通过影响滋养细胞的功能参与PE 的发生[6-7]。miR-152是近年来发现的miRNA 家族重要成员之一,miR-152在PE大鼠胎盘组织[8]和PE患者血清[9]中均明显增高,但具体作用机制尚不明确。2020 年7 月—2020年9月,我们通过低氧诱导建立PE 滋养细胞模型[10]探讨抑制miR-152 对PE 细胞模型增殖、凋亡及侵袭功能的影响及可能的作用机制,为PE的靶向治疗提供新的思路。
1 材料与方法
1.1 主要材料 TRIzol 试剂(美国Invitrogen 公司);LipofectamineTM2000(美国Invitrogen 公司);逆转录试剂盒、qRT-PCR 荧光定量检测试剂盒(北京天根生物公司);miR-152 抑制物miR-152 inhibitor和抑制物阴性对照NC-inhibitor(上海吉玛制药公司);CCK-8 试剂盒(上海碧云天生物公司);Annexin V-FITC 凋亡检测试剂盒(南京凯基生物公司);Transwell 小室(美国Corning 公司);基质胶(美国BD 公司);一抗E-Cadherin、N-Cadherin、GAPDH(美国Santa Cruz 公司);HRP 标记的二抗(武汉博士德生物公司)。
1.2 PE 细胞模型建立及细胞分组 人绒毛膜滋养细胞HTR8/Svneo 购自美国模式菌种收集中心(ATCC),应用RPMI1640 培养基(含10%胎牛血清)置入37 ℃、5%CO2、相对湿度为98%的条件下培养。将培养细胞分为4组:①对照组:细胞置于常氧环境(5%CO2、95%空气)中培养;②低氧组:细胞置于低氧环境(1%O2、5%CO2、94%N2)中培养;③低氧+NCinhibitor 组:首先应用LipofectamineTM2000 转染NCinhibitor 至HTR8/Svneo 细胞,转染后12 h 再将细胞置于低氧环境中培养;④低氧+miR-152 inhibitor组:首先应用LipofectamineTM2000 转染miR-152 inhibitor至HTR8/Svneo 细胞,转染后12 h 再将细胞置于低氧环境中培养。各组细胞培养48 h后进行后续试验检测。
1.3 细胞miR-152 表达检测 应用TRIzol 试剂提取各组细胞中总RNA,紫外分光光度计测定其纯度和浓度。按照逆转录试剂盒说明书操作将其逆转录为cDNA。以cDNA 为模板,加入PCR 引物,应用qRT-PCR 荧光定量检测试剂盒进行PCR 体系进反应。miR-152 引物上游序列:5'-CCAGCTGAGTGGATGACAGA-3',下 游 序 列:5'-GTGCAGGGTCCGAGGTATTC-3';内 参U6 引 物 上 游 序 列:5'-CTCGCTTCGGCAGCACA-3',下游序列:5'-AACGCTTCACGAATTTGCGT-3'。反应条件为:95 ℃10 min,95 ℃15 s,60 ℃60 s,共40 个循环。应用2-ΔΔCt公式计算miR-152的相对表达量。
1.4 细胞增殖活性检测 收集各组细胞,用0.25%胰酶消化后进行细胞计数,细胞接种于96 孔细胞板,铺板密度为1×104个/孔,在24、48、72 h三个时点分别向每孔加入CCK-8 试剂10 μL,继续孵育4 h后,使用酶标仪在450 nm 处测量各孔的吸光度(OD450)值。
1.5 细胞凋亡率检测 收集各组细胞,用预冷1×Binding Buffer 洗涤细胞3 次后,将5 μL Annexin VFITC 和5 μL PI 的混合物加入后,室温避光继续孵育15 min,立即送流式细胞仪上机检测各组细胞的凋亡率。
1.6 细胞侵袭能力检测 取各组细胞用无血清培养基制备1×105细胞/mL 的单细胞悬液,各组取0.3 mL 单细胞悬液加入已经预铺基质胶的Transwell 小室上室,下室加入0.5 mL 含10%胎牛血清的培养基,置入培养箱中继续孵育24 h 后取出小室,轻轻擦拭掉残留在小室膜上表面的细胞,小室膜下表面的细胞用4%甲醛固定10 min 后,应用0.5%结晶紫溶液染色,光学显微镜下观察并计数细胞数目。
1.7 细胞E-cadherin、N-cadherin 蛋白表达检测取各组细胞,细胞裂解液提取蛋白,BCA 法测定蛋白浓度,以30 μg 蛋白的上样量行10% SDS-PAGE,将蛋白电转移至PVDF 膜,加入5 %脱脂牛奶室温条件下封闭4 h,加入抗E-cadherin(1∶1 000)、Ncadherin(1∶2 000)和GAPDH(1∶10 000),4 ℃孵育过夜,TBST 洗膜3遍后加入二抗(1∶10 000),室温孵育2 h后,加入ECL 试剂置于暗室中发光显影,拍照后Quality One软件分析各个条带的灰度值计算相对表达量。
1.8 统计学方法 应用SPSS 21.0 进行统计分析,计量资料符合正常分布以±s表示,组间比较采用单因素方差分析或重复测量的方差分析,进一步两两比较采用SNK 法。P<0.05 表示差异有统计学意义。
2 结果
2.1 各组HTR-8/SVneo 细胞miR-152 表达水平对照组、低氧组、低氧+NC-inhibitor 组、低氧+miR-152 inhibitor 组HTR-8/SVneo 细胞miR-152 表达水平分别为1.06 ± 0.08、2.36 ± 0.21、2.41 ± 0.26、0.53 ± 0.14。与对照组比较,低氧各组HTR-8/SVneo 细胞miR-152 表达升高(P 均<0.05)。低氧组 与 低 氧+NC-inhibitor 组 比 较,HTR-8/SVneo 细胞miR-152 表达差异无统计学意义(P>0.05)。与低氧+NC-inhibitor 组比较,低氧+miR-152 inhibitor 组HTR-8/SVneo 细 胞miR-152 表 达 降 低(P<0.05)。
2.2 各组HTR-8/SVneo 细胞增殖活性 与对照组比较,低氧各组HTR-8/SVneo 细胞24、48、72 h 时点的OD450均降低(P均<0.05)。低氧组和低氧+NC-inhibitor 组HTR-8/SVneo 细胞各时点的OD450比较差异均无统计学意义(P>0.05)。与低氧+NC-inhibitor组比较,低氧+miR-152 inhibitor 组HTR-8/SVneo 细胞24、48、72 h 时点的OD450均升高(P均<0.05)。见表1。
表1 各组HTR8/Svneo细胞不同时点增殖活性比较(±s)
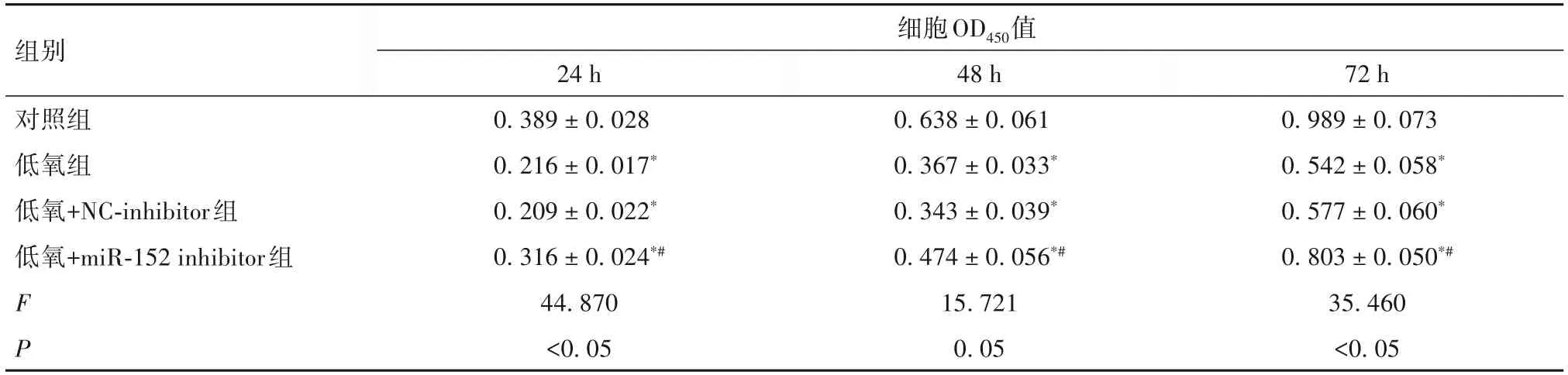
表1 各组HTR8/Svneo细胞不同时点增殖活性比较(±s)
注:与对照组比较,*P<0.05;与低氧+NC-inhibitor组比较,#P<0.05。
组别细胞OD450值72 h 0.989±0.073 0.542±0.058*0.577±0.060*0.803±0.050*#35.460<0.05对照组低氧组低氧+NC-inhibitor组低氧+miR-152 inhibitor组F P 24 h 0.389±0.028 0.216±0.017*0.209±0.022*0.316±0.024*#44.870<0.05 48 h 0.638±0.061 0.367±0.033*0.343±0.039*0.474±0.056*#15.721 0.05
2.3 各组HTR-8/SVneo 细胞凋亡率 对照组、低氧组、低氧+NC-inhibitor 组、低氧+miR-152 inhibitor组HTR-8/SVneo 细胞凋亡率分别为(5.46 ±0.72)%、(27.26 ± 4.47)%、(26.93 ± 5.11)%、(12.54 ± 2.12)%。与对照组比较,低氧各组HTR-8/SVneo细胞凋亡率升高(P均<0.05)。低氧组与低氧+NC-inhibitor 组HTR-8/SVneo 细胞凋亡率比较差异无统计学意义(P>0.05)。与低氧+NC-inhibitor 组比较,低氧+miR-152 inhibitor 组HTR-8/SVneo 细胞凋亡率降低(P<0.05)。
2.4 各组HTR-8/SVneo 侵袭能力 对照组、低氧组、低氧+NC-inhibitor 组、低氧+miR-152 inhibitor 组HTR-8/SVneo 细胞穿膜侵袭细胞数分别为(210 ±65)、(55±19)、(52±14)、(115±20)个。与对照组比较,低氧各组HTR-8/SVneo 细胞穿膜侵袭细胞数减少(P均<0.05)。低氧组和低氧+NC-inhibitor 组HTR-8/SVneo细胞穿膜侵袭细胞数比较差异无统计学意义(P>0.05)。与低氧+NC-inhibitor 组比较,低氧+miR-152 inhibitor组HTR-8/SVneo细胞穿膜侵袭细胞数明显增多(P<0.05)。
2.5 各组HTR-8/SVneo 细胞E-cadherin 和N-cadherin 蛋白表达 与对照组比较,低氧各组HTR-8/SVneo 细胞中E-cadherin 蛋白的表达升高(P均<0.05),N-cadherin 蛋白的表达降低(P<0.05)。低氧组和低氧+NC-inhibitor 组HTR-8/SVneo 细胞中Ecadherin 和N-cadherin 蛋白的表达比较差异均无统计学意义(P均>0.05)。与低氧+NC-inhibitor 组比较,低氧+miR-152 inhibitor 组HTR-8/SVneo 细胞中E-cadherin 蛋白的表达降低(P<0.05),N-cadherin 蛋白的表达升高(P<0.05)。见表2。
3 讨论
目前PE的发生发展机制尚不明确。研究认为,滋养细胞功能异常和螺旋动脉重铸不良导致胎盘缺血和缺氧、异常氧化应激等释放多重胎盘因子,胎盘因子进入母亲血液循环促使母体血管内皮损伤和炎症反应系统激活从而引起PE临床症状的发生,因此PE 也被认为是一种胎盘缺血缺氧性疾病[11]。目前体外缺氧诱导建立PE滋养细胞模型是研究PE 的最常用的细胞模型[12]。研究认为滋养细胞增殖、凋亡、侵袭等细胞功能的异常与PE 的发生密切相关[13]。PE患者胎盘组织中存在大量异常表达的miRNA,可能通过影响滋养细胞的功能参与PE的发生发展[14]。miR-152 是近年来发现的与细胞增殖、凋亡、分化等关系密切的miRNA 家族成员之一[15-17],近期有学者发现PE 大鼠胎盘组织中miR-152 表达水平明显升高[8],且PE 患者血清中miR-152 的表达水平也明显升高[9],提示miR-152 可能与PE 的发生发展有关。但是至今miR-152 在PE 发生发展中的作用机制,以及其对滋养细胞功能的影响目前尚不清楚。本研究中我们通过低氧诱导建立PE细胞模型,结果发现低氧组HTR-8/SVneo 细胞增殖活性明显降低,凋亡率明显升高,侵袭细胞数明显减少,并且发现miR-152在低氧诱导建立的PE细胞模型中亦表达明显升高,与其在PE 动物模型和PE 患者血清中的表达结果一致。
表2 各组HTR8/Svneo细胞E-cadherin和N-cadherin蛋白表达水平比较(±s)

表2 各组HTR8/Svneo细胞E-cadherin和N-cadherin蛋白表达水平比较(±s)
注:与对照组比较,*P<0.05;与低氧+NC-inhibitor 组比较,#P<0.05。
N-cadherin蛋白0.90±0.16 0.40±0.12*0.42±0.14*0.76±0.11*#10.402<0.05组别对照组低氧组低氧+NC-inhibitor组低氧+miR-152 inhibitor组F t E-cadherin蛋白0.13±0.05 0.78±0.16*0.82±0.18*0.30±0.12*#19.091<0.05
胎盘滋养细胞增殖活性下降,凋亡增加,侵袭能力下降可引起胎盘浅着床、螺旋动脉重铸异常,从而造成胎盘形成不良,是PE发生的重要因素。为了探讨miR-152 对PE 细胞模型细胞特性的影响,本研究通过脂质体转染法降低PE 细胞模型中miR-152 的表达,结果发现随着miR-152 表达水平的降低,PE细胞模型增殖活性明显升高,凋亡率明显下降,侵袭能力明显上升,提示抑制miR-152 能够改变PE 细胞模型的异常细胞学特性,为PE的靶向治疗提供了新的研究思路。
上皮间质转化(EMT)是指上皮细胞经特定程序转化成具有间质表型细胞的生物学过程,经过转化的细胞极性、黏附功能均下降,从而获得侵袭和迁移能力。目前EMT 与肿瘤细胞生长、侵袭的研究较多,认为EMT 是恶性肿瘤细胞发生侵袭转移的关键步骤[18-19]。近年来EMT 在PE 发生发展中作用也越来越受到学者们的关注。研究发现PE 患者滋养细胞EMT 过程受损,导致滋养细胞分化和侵袭能力降低,进而造成螺旋动脉重铸过程受损,与PE 的发生发展密切相关[20]。本研究中我们也发现PE 细胞模型中上皮源性标志物E-cadherin 蛋白的表达明显升高,而间质源性标志物N-cadherin 蛋白的表达明显降低,提示PE 细胞模型EMT 过程受损。既往在肾纤维化[21]、肺纤维化[22]和恶性肿瘤[23-24]的研究中均发现miR-152 能够调控EMT 参与疾病的发生发展。进一步研究我们发现抑制miR-152 表达后,PE 细胞模型E-cadherin 蛋白的表达明显降低,而间质源性标志物N-cadherin 蛋白的表达明显升高,提示抑制miR-152 对PE 细胞模型细胞学特性的影响可能与其对EMT的调控有关。
综上所述,异常表达的miR-152 参与了PE 的发生发展,抑制miR-152 能够促进PE 滋养细胞的增殖和侵袭,并抑制其凋亡,其作用可能是通过调控EMT实现的。

