ARTP诱变技术选育黑木耳优良发酵菌株初探*
王 晨,马欣欣,平琳琳,王 谦
(河北大学 生命科学院,河北 保定 071000)
当前食(药)用真菌与发酵工业的交叉,成为食用菌行业进步的标志之一。液体菌种具有培养周期短、不受季节限制、利于规模化、接种方便、菌丝体生长一致等优势[1-2],液体培养的方式能够有效提高菌类产量和效益,而且在现代农业中的黑木耳产业,液体菌种的应用已经成为产业常态。与此同时,对于其液体发酵过程中产生的次生代谢产物如黄酮、多酚、多糖等[3-6]的应用也愈发受到重视,良种选育已经成为发酵工业重要的应用基础研究领域。黑木耳(Auricularia auriculae)作为我国食用菌产量排名第二的菌类,不仅口味鲜美而且营养丰富,还具有抗癌、降血脂、提高免疫力等作用[7]。目前食(药)用菌一般采用孢子分离、杂交育种、紫外诱变等育种方法,近年来出现的ARTP诱变技术育种[8],在黑木耳育种研究中尚无报道。本试验探究了ARTP育种技术在选育发酵性状优良的黑木耳细胞工程菌株方向的应用,并对其在发酵、液体菌种应用、多糖含量等方面开展了初步研究。
1 材料与方法
1.1 材料
1.1.1 供试菌种
供试菌株:出发菌株为黑木耳黑威半筋品种,黑龙江微生物研究所提供;细胞工程菌株:Aa66、Aa98、Aa101、Aa285。以上菌株均保存于河北大学食药用真菌研究所。
1.1.2 供试培养基
PDA培养基:马铃薯(去皮) 20.0%、葡萄糖2.0%、麸皮 2.0%、琼脂 2.0%、KH2PO40.1%、Mg-SO40.1%,pH自然。
液体发酵培养基:葡萄糖2.5%、玉米粉0.5%、豆粕粉0.5%、MgSO40.1%、酵母膏0.2%、KH2PO40.2%,pH自然。
1.2 ARTP诱变育种技术选育黑木耳细胞工程菌株
1.2.1 菌丝体的制备
按液体发酵培养基配方进行配制,500 mL三角瓶中装液量200 mL,通过无菌操作对活化后的PDA斜面黑木耳菌种进行接种[9],并于28℃、160 r·min-1恒温振荡培养5 d[10],获得黑木耳菌丝体。
1.2.2 菌悬液的制备
在超净工作台上,将制备好的黑木耳菌丝体发酵液经80目铜丝网过滤,滤液经移液枪取10 mL至离心管中,8 000 r·min-1离心5 min后弃上清,无菌水冲洗沉淀2次,再次离心后加入无菌水,摇匀后得菌悬液[11]。
1.2.3 ARTP诱变处理
在超净工作台中,用移液枪吸取10 μL菌悬液悬浮于载片上,并放入ARTP诱变仪操作仓中,将各参数分别设置为标准大气压下气流量10 L·min-1、输出功率100 W、辐射距离2 mm[12],诱变时间梯度为 0、10 s、15 s、20 s、25 s、30 s、35 s、40 s、45 s、50 s,在每个时间点设置3个平行样品,0为对照组。将经过诱变处理后的载片夹放于装有1 mL无菌水的EP管中,置于涡旋振荡器上混合均匀,再用移液枪吸取300 μL液体涂布于再生培养基平板,封口膜密封后恒温避光培养5 d~7 d,记录再生菌株数,得到致死率曲线,并确定最佳诱变照射时间。
重复试验,获得大量黑木耳诱变菌株后,挑取再生培养基中长势较好的菌株转接于PDA培养基上,并进行标号记录。
1.2.4 再生菌株的筛选
将经ARTP诱变所获得的再生菌株以出发菌株黑威半筋为对照菌株,进行拮抗试验[13]。选择有明显拮抗反应的再生菌种进行复筛试验,包括萌发定植对比试验[14]、生长速度和长势对比试验、营养生长酶活[15-19]对比试验。
1.2.5 优良菌种的真实性鉴定
经初筛与复筛后,参考中国农业行业标准NY/T 1730-2009食用菌菌种真实性鉴定ISSR法[20],选择性状优良的再生菌株与出发株采用ISSR分子标记技术进行菌种真实性鉴定,确定其分子水平上的遗传距离。
1.3 黑木耳细胞工程株发酵性能对比
1.3.1 发酵培养
按液体发酵培养基配方进行配制,250 mL三角瓶中装液量100 mL,将PDA菌种以8%的接种量[10]转接于制备好的液体发酵培养基中,并于28℃、160 r·min-1恒温振荡培养[10],进入摇床的第1天定时、定瓶(每隔8 h,每个菌种各3瓶) 取100 mL发酵全液进行各项指标检测,并求平均值。
1.3.2 指标数值检测
采用菌丝鲜重评价生物量[21];采用手持糖度计法测定残糖量[22];采用苯酚-硫酸法测定多糖含量[23]。
1.4 发酵菌种的生理指标检测
经上述探究后,对较优菌株进行发酵液pH[22]、氨基氮含量[24]、羧甲基纤维素酶、漆酶、半纤维素酶[15-19]等生理活性指标的检测。
1.5 数据处理
数据采用SPSS软件进行处理与分析。
2 结果与分析
2.1 ARTP诱变育种试验结果
ARTP诱变菌丝体致死曲线见图1。

图1 ARTP诱变致死曲线Fig.1 Lethal curve of ARTP mutation
由图1可知,在40 s时菌丝体的致死率为82.16%;45 s时菌丝体的致死率为91.08%;50 s时菌丝体的致死率为99.06%;55 s后致死率达到了100%。因此选用45 s为ARTP最佳诱变时间。
重复进行ARTP诱变试验,共获得285株长势良好的再生菌株,依次编号为 Aa1、Aa2、Aa3、Aa4、……Aa285。
2.2 再生菌株初筛结果
通过ARTP诱变得到的285株再生菌株与出发菌株进行拮抗试验后,共有36株与出发菌株产生明显的拮抗反应,突变率为12.6%。
2.3 再生菌株复筛结果
经萌发定植对比试验、生长速度和长势对比试验,对36株再生菌株进行比较,有23株生长较慢,菌丝较为稀疏,菌丝体较弱而淘汰。余下菌株筛选后有6株明显优于出发株,其生长情况对比见表1。
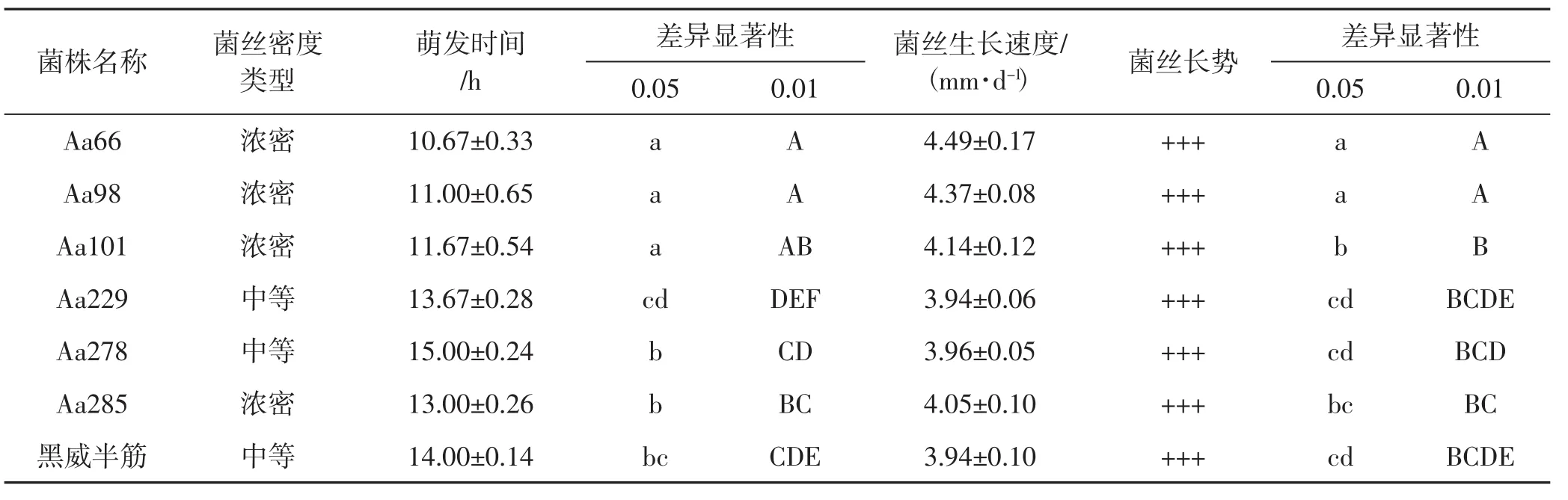
表1 6株再生菌株生长情况对比Tab.1 Growth comparison of 6 regenerated strains
由表1可知,Aa229表现较差,在萌发时间与菌丝生长速度上均弱于出发株黑威半筋,Aa278、Aa285表现与出发株较为接近,而Aa66、Aa98、Aa101表现较好,且与出发株黑威半筋存在极显著性差异。6株再生菌株营养生殖阶段的多酚氧化酶、漆酶、羧甲基纤维素酶酶活的对比情况见表2。

表2 6株再生菌株酶活性对比Tab.2 Comparison of enzyme activities of 6 regenerated strains
由表2可知,6株再生株在3中酶的活性测定中存在差异。综合比较而言,Aa229、Aa278表现较差;其余4株菌株强于出发株黑威半筋、Aa66、Aa98、Aa101、Aa285明显与出发株具有显著性与极显著性差异;Aa66在3种酶的测定中表现最优,且与出发株存在极显著性差异。
2.4 菌株真实性鉴定结果
对筛选出的4株优良菌株与出发株进行ISSRPCR扩增,其扩增图谱见图2。

图2 部分引物对5个菌株的ISSR扩增图谱Fig.2 ISSR amplification map of 5 strains by partial primers
由图2可知,在随机挑选的30条引物中,共有10条引物的扩增图谱效果较好,稳定合理且具有差异性。共获得了42条扩增条带,每条引物可获得2条~5条扩增条带,其中有27条扩增条带与出发株黑威半筋有差异,扩增条带大小在150 bp~2 000 bp内。采用Ntsys 2.10e对4株优良再生菌株以及出发菌株的遗传相似系数进行聚类分析,所构建遗传关系聚类树形图见图3。

图3 优良再生株与出发株遗传关系聚类树状图Fig.3 Dendrogram of genetic relationship between excellent regenerated plant and original plant
由图3可知,4株优良再生菌株与黑威半筋的变异范围为0.650~0.880,表明4株优良再生株均与出发株存在稳定性差异。
2.5 液体发酵过程中生物量的变化
5株黑木耳菌株在液体培养过程中菌丝体鲜重变化结果见图4。

图4 5株黑木耳菌株在液体培养过程中菌丝体鲜重变化结果Fig.4 Changes of mycelial fresh weight of 5 strains of Auricularia auricula during liquid culture
由图4可以得出,随培养时间的增长,各菌株生物量均呈明显上升趋势。其中,4株优良再生株最高生物量均高于出发株,但Aa285与其相差极小。观察曲线走势可看出,Aa101进入增殖生长期时间较晚,且与其他3株细胞工程株相差较大。综合比较而言,Aa66与Aa98表现较为优良,均在48 h时进入增值生长期,但Aa66较快的进入稳定期,在136 h时生物量达到最大值32.96 g·100-1mL-1,明显高于Aa98,更具有优势。
2.6 液体发酵培养中残糖量的变化
5株黑木耳菌株液体培养过程中发酵液内残糖的变化结果见图5。

图5 5株黑木耳菌株在液体培养过程中发酵液中残糖的变化结果Fig.5 Changes of residual sugar in fermentation broth of 5 strains of Auricularia auricula during liquid culture
由图5可以得出,随培养时间的增长,各菌株发酵液的残糖度均呈明显下降趋势,且与生物量的变化时间节点基本一致,这表明在菌丝生长的同时,会大量消耗碳源。对于碳源的分解能力依次为Aa66>Aa98>Aa101>黑威半筋>Aa285。
2.7 发酵液总多糖测定结果
5株黑木耳菌株发酵液多糖测定结果见表3。
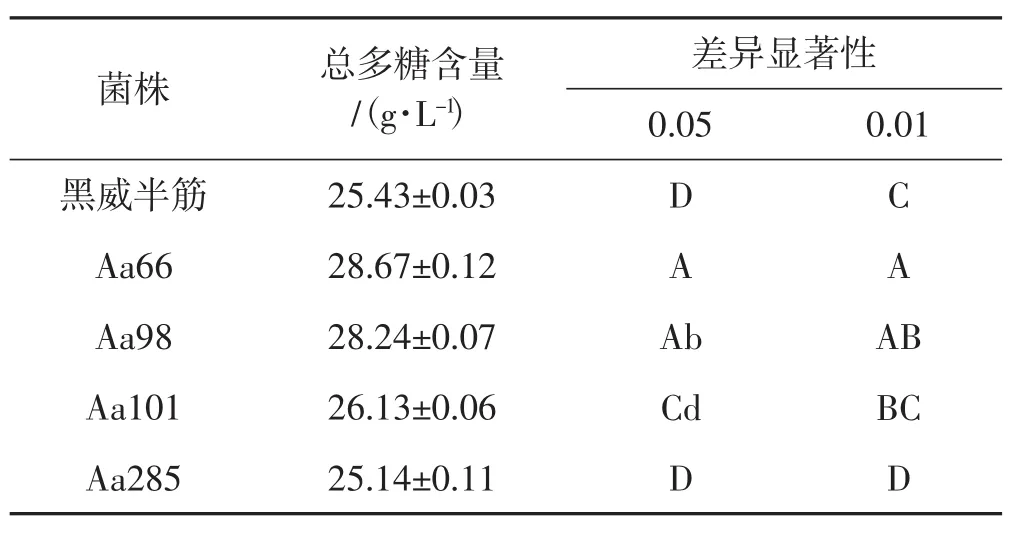
表3 5株黑木耳菌株发酵液多糖测定结果Tab.3 Determination results of polysaccharides in fermented mash of 5 Auricularia auricular strains
在发酵培养过程中生物量达到最大时,取100 mL发酵液,经匀质机机械破碎,进行发酵液总多糖含量的测定,4株再生菌株多糖量均高于出发株,其中Aa66、Aa98与出发株相比有极显著差异,其中Aa66最佳。
2.8 再生株Aa66的生理指标检测结果
2.8.1 pH变化
再生株Aa66发酵过程中pH的变化情况见图6。
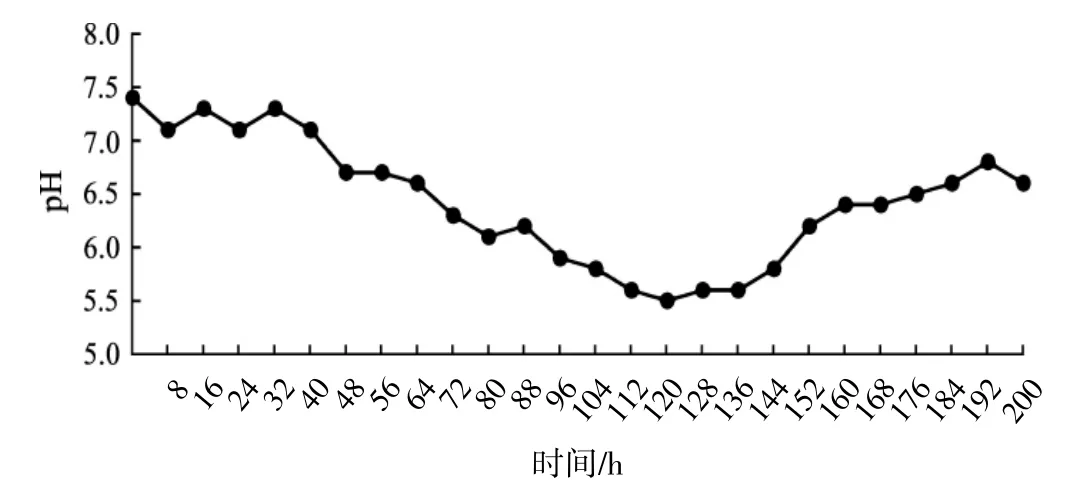
图6 pH变化情况Fig.6 Change of pH
如图6所示,随着发酵的进行,发酵液pH先下降后升高,但变化范围较小,基本在5.5~7.4之间波动。
2.8.2 氨基氮含量测定结果
再生株Aa66发酵过程中氨基氮含量变化情况见图7。
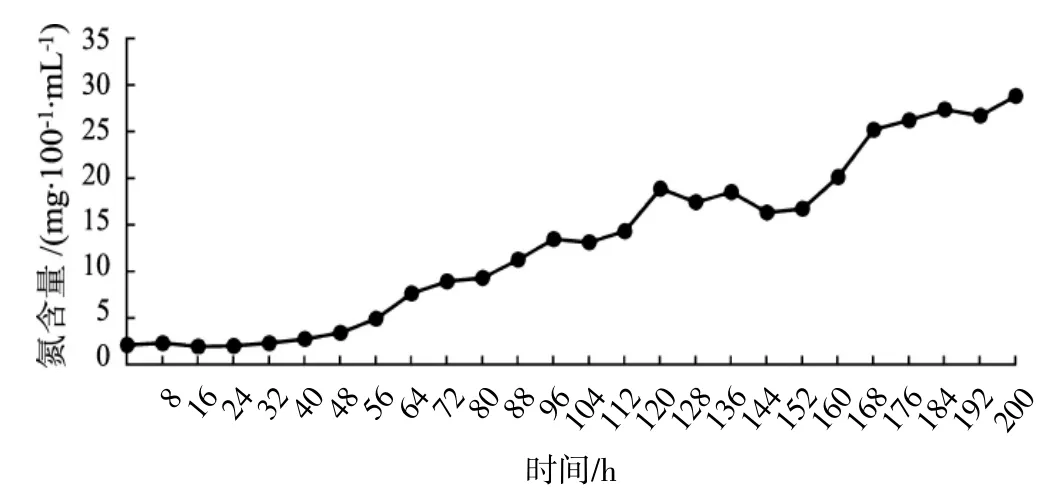
图7 氨基氮含量变化Fig.7 Change of amino nitrogen content
如图7所示,氨基氮含量随发酵时间的上升呈增加趋势,0~48 h时增加缓慢,48 h后增加较快。在160 h后,随着生物量的下降,氨基氮含量呈上升趋势,这表明在培养后期菌丝老化,发生菌球自溶现象,结构性蛋白快速分解,使得发酵液中氨基氮含量增多。
2.8.3 还原糖含量
再生株Aa66发酵过程中还原糖含量变化情况见图8。

图8 还原糖含量变化Fig.8 Change of reducing sugar content
如图8所示,随着发酵的进行,还原糖含量呈先增加后下降的趋势,在迟缓期与对数生长期还原糖含量增加,表明在发酵初期菌丝体分解碳源能力较强,还原糖的生成量远大于消耗量,在120 h时,达到最大值76.66 mg·100-1mL-1。在对数生长期后期以及进入稳定期后,菌丝体大量生长,对于碳源的消耗能力进一步提高,还原糖含量下降。
2.8.4 酶活性测定结果
再生株Aa66发酵过程中3种酶活性变化情况见图9。

图9 酶活性变化Fig.9 Changes of enzyme activity
如图9所示,在发酵培养过程中,3种酶活性均先增高后下降。羧甲基纤维素酶活性变化明显,在0~48 h几乎没有变化,48 h后开始增加,96 h后快速上升,在136 h时达到最大值70.01 U·mL-1。而半纤维素酶与漆酶酶活性变化较小,半纤维素酶酶活性在144 h时达到最大值4.92 U·mL-1,漆酶酶活在120 h时达到最大值7.94 U·mL-1。在对数生长期,菌丝体生长迅速,需要较多的养分,因此产生大量的酶进行基质的分解,酶活性也随之升高。当进入稳定期,菌丝体产生大量次生代谢产物,此时对于养分需求逐步下降,导致酶的活力下降。由于酶易失活的特性,使其在后期呈直线下降。
3 讨论
ARTP诱变育种作为一种微生物育种新技术,在细菌、放线菌、酵母菌上已有应用,在食(药)用真菌领域的应用较少,而在黑木耳的诱变育种试验中尚未报道。通过ARTP诱变育种技术,以黑威半筋为出发株,共获得285株再生菌株,经一系列筛选试验后,共获得4株性状优良的再生株。通过液体发酵试验,对比其发酵性能,通过生物量、分解碳源的能力、多糖产量为指标,确定最适发酵菌株为Aa66。后续试验需要对Aa66菌株发酵的过程进行一系列生理指标的检测,为Aa66菌株在生产上的应用奠定基础。
在当前食用菌的发酵产业中,液体发酵工艺已取得规模性进展,菌种作为生产的第一要素,对食用菌产量与质量起决定性因素。细胞工程菌株Aa66是否可用于工业化生产,以及其在工业生产中实际的发酵性能,仍有待进一步探究。

