脾脏窦岸细胞血管瘤的MDCT/MRI特征分析
王海亮,黎良山
(浙江中医药大学附属嘉兴市中医医院 放射科,浙江 嘉兴 314000)
脾脏窦岸细胞血管瘤(littoral cell angioma,LCA)是一种临床上较为罕见的仅发生于脾脏的血管源性肿瘤,最早由Falk等[1]于1991年报道,由于窦岸细胞仅见于脾脏,且肿瘤组织来源于脾窦内皮细胞,故命名为脾脏窦岸细胞血管瘤。LCA较为少见,大多数为良性肿瘤,但在临床工作及影像学诊断中难以与其他脾脏肿瘤相区别,诊断仍然存在一定难度。笔者对9 例经手术病理证实的LCA完整影像学资料进行回顾性分析,总结其影像学特征,现报道如下。
1 资料和方法
1.1 一般资料
2008 年1 月至2019 年8 月浙江中医药大学附属嘉兴市中医医院经手术病理证实的LCA 9 例,其中男4例,女5例,年龄20~64岁,平均(42.7±12.7)岁。临床表现:左上腹部胀痛4例,体检或其他检查中偶然发现脾脏占位5例,具体见表1。所有患者均行手术切除,病理结果提示为LCA。所有患者术后随访1~3年,无死亡病例。
1.2 影像学检查
1.2.1 CT:7例采用GE Lightspeed 16排CT扫描,其中1例平扫,6例行平扫+增强扫描。扫描参数:扫描层厚1.0 mm,螺距1.25 mm。增强扫描经肘静脉注入对比剂碘氟醇(300 mgI/mL),注射剂量1.5 mL/kg(总注射量上限为100 mL),流速3.0 mL/s。
1.2.2 MRI:采用GE HDE 1.5T MRI超导扫描仪,5例行MRI平扫+增强扫描。平扫扫描序列和参数:横断面FSE T1WI(TR 600~800,TE12)、FSE T2WI(TR 5 500~6 500,TE 100,层厚5 mm),冠状面FSE T2WI(TR 5 500~6 500,TE 100,层厚5 mm)。行横断面3期增强T1WI Lava序列扫描,经肘静脉注射对比剂钆喷酸葡胺(Gd-DTPA),剂量0.2 mmol/kg,流速3.0 mL/s。
1.2.3 图像分析:由2 名影像科高年资医师对9 例LCA的MDCT/MRI资料进行分析,记录其影像学表现,并总结LCA患者的影像学特征;再将这些特征与临床医师进行讨论分析,以探讨MDCT及MRI检查对LCA术前评估的价值。
2 结果
9 例LCA中,脾脏肿大8 例,表现为单发病灶3例、多发病灶6 例,肿块呈类圆形,最大直径0.4~5.3 cm,平均(2.6±1.7)cm,具体见表1。
CT检查:7例LCA肿块MDCT平扫(密度与脾脏相比较)呈等或稍低密度(图1A),其中与正常组织分界不清5例,增强扫描动脉期病灶迅速廓清,其中部分病灶边缘呈“环状”强化4 例(图1B),静脉期及延迟期呈“填湖样”渐进性强化(图1C)。
MRI检查:5 例肿块T1WI表现为等稍低信号,T2WI呈稍高信号(图2A),其中增强扫描2例单发肿块呈“快进慢出”的特性,且三期强化程度均高于脾脏(图2B、2C)。
病理结果:9例病理均诊断为LCA,均为良性病灶。8例伴有脾脏体积增大,切面多为灰红色,可见多个0.2~3.0 mm大小不等的结节。镜下常见互相吻合呈网的窦状腔隙构成肿瘤组织,部分呈囊性扩张,扩张的窦腔内可见假乳头状凸起,腔壁衬覆单层内皮细胞,胞质内含铁血黄素可见,胞核呈卵圆形,核分裂象少见(图3)。SFT免疫组化:CD31(+)、CD68(+)9例,CD34(+)7例,SMA(+)7例,CD20(+)5例。
3 讨论
3.1 LCA的临床与病理特点
本组患者年龄20~64岁,平均(42.7±12.7)岁,男女比例4:5,与文献报道相符[2]。LCA可有腹胀、腹痛等表现,如本组病例中4例表现为上腹部胀痛,余5 例未见异常临床症状,在体检或其他检查中偶然发现脾脏占位。有部分LCA患者会伴发脾功能亢进[3]。
脾内多为多发结节,单发少见,边界较清楚,切面多为灰红色。镜下肿瘤由互相吻合呈网的窦状腔隙构成,部分呈囊性扩张,扩张的窦腔内可见假乳头状凸起,腔壁衬覆单层内皮细胞,胞质内含铁血黄素可见,胞核呈卵圆形,核分裂象少见。由于LCA具有向组织细胞及内皮细胞双向分化的特征,故能同时表达CD68、组织蛋白酶等组织细胞标志物及CD31、CD34 等内皮细胞标志物[4],其免疫组化CD31(+)、CD68(+)对于诊断LCA有提示作用。本组9例LCA均见CD31(+)、CD68(+)。
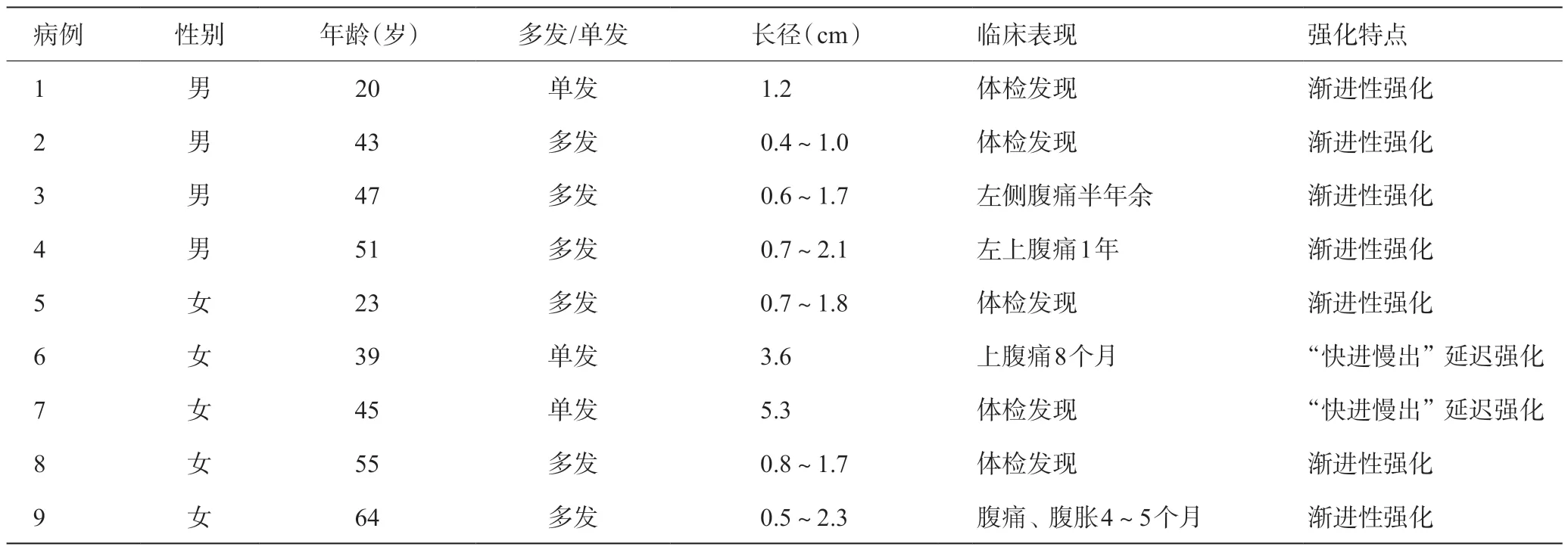
表1 9例LCA病灶大小、临床表现及强化特点

图1 脾脏多发LCA的CT表现(病例4)

图2 脾脏单发LCA的MRI表现(病例7)

图3 术后病理(HE,×200)
3.2 LCA的影像学表现
本组9例LCA的MDCT/MRI表现具有如下特点:(1)肿瘤大小、数目:脾脏LCA多发肿块常见,单发者少见,而孤立性单发肿块多较大。本组2 例单发LCA肿块长径>3 cm,其余7例LCA病灶最大径0.4 cm,与文献报道[5-6]相符合。(2)脾脏肿块外凸。高慧等[7]提出LCA常伴有不同程度的脾脏肿大。本组2 例脾脏单发肿块体积较大,局部向外凸出于脾脏,致邻近组织结构脂肪间隙变窄。由于LCA孤立性肿块与脾脏密度或信号接近,平扫易漏诊,故孤立性单发结节外凸出于脾脏的表现对LCA的检出很有意义,笔者认为应该重视。(3)假包膜。薛红红等[8]认为LCA肿块无包膜,而本组中有2 例单发肿块可见假包膜,且包膜较完整,笔者认为可能是由于肿瘤体积较大,在缓慢生长过程中压迫邻近脾脏组织从而形成了纤维样结构。本研究结果显示当脾脏内孤立性肿块出现假包膜时,应需考虑脾脏LCA的可能。(4)肿瘤的平扫表现:本组7例脾脏LCA病灶表现为等或稍低密度,其中有5 例病灶边界与邻近脾组织分界不清。LCA病灶T1WI一般呈等或稍低信号,T2WI呈稍高信号,3例病灶内T2WI可见点片状低信号影,即所谓“雀斑”征,这是由于含铁血黄素沉积于肿瘤细胞内且铁质有顺磁性的作用,此征象具有一定特征性。LCA肿块在DWI上扩张受限大部分呈高信号[9],而本组中另有2例LCA肿块在DWI上未见明显扩散受限,究其原因笔者认为,肿块主要由不规则扩张血管腔构成,其内肿瘤组织成分相对较少。(5)肿瘤的强化方式:本组7例MDCT扫描LCA肿块在增强扫描动脉期迅速廓清,与周围正常脾脏组织分界清晰,有5 例多发LCA肿块部分病灶边缘可见“环状”较明显强化,静脉期及延迟期本组7 例LCA表现为由病灶周边向中央缓慢填充的渐进性强化征象[10],即“填湖样”渐进性强化模式。本组3例MRI动态增强和CT增强表现相似,且其强化程度等或略低于脾脏[11];另外本组有2例单发较大肿块呈明显较均匀强化,且其三期强化程度均高于脾脏,表现为“快进慢出”延迟强化的特性,这与程冰雪等[12]报道相符合。以上两种强化方式的出现笔者认为可能与肿块内窦状腔隙的数量多少、体积大小、吻合程度,以及肿瘤内纤维组织成分、血管结构的含量及分布有关,从而导致造影剂进入瘤体的时间长短不一,最终LCA肿块表现为多种强化方式。
3.3 LCA的影像学鉴别诊断
本组脾脏LCA有两种强化方式,其中“渐进性强化”需要与如下疾病相鉴别:(1)脾脏海绵状血管瘤肿块较大时易伴有出血、坏死及纤维化,钙化较常见,多发脾血管瘤很少见;而脾脏LCA未见钙化的相关报道,LCA脾组织内有较特异性的铁质沉积表现,呈长T1短T2且增强不强化;(2)脾脏转移瘤一般有原发肿瘤病史,病灶多发常见,但可见肿大脾门淋巴结,增强后呈特征性的“牛眼征”表现。与LCA“快进慢出”的延迟强化方式需要与如下疾病相鉴别:(1)脾脏错构瘤。所谓错构瘤是指脾脏内瘤变组织及非瘤化组织之间相互错构,终合并成新的肿瘤。钙化较常见[13],T2WI和DWI病灶信号低于正常脾脏组织,具有一定特征性,增强扫描呈轻度不均匀强化或明显强化,延迟期病灶强化程度接近或略高于脾脏;(2)脾脏血管淋巴管瘤(脉管瘤)。该病较少见,属一种先天性发育畸形,常表现为肿大的脾脏内见多发大小不等囊性低密度影,边界清或不清,增强后部分病灶被造影剂充填而表现为“病灶数目减少”征,此征象与脾LCA表现较相似,有时二者难以鉴别;(3)脾脏硬化性血管瘤样结节性转化。该病单发多见,多发罕见,典型影像学征象包括在T2WI序列及动脉期的“轮辐征”,延迟期病灶中心可见星芒状纤维组织延迟强化。
综上所述,脾脏LCA常为多发肿块,其MDCT及MRI表现为肿瘤局部外突、假包膜及“雀斑”征,增强扫描有“填湖样”渐进性强化、“快进慢出”延迟强化等。当脾脏肿瘤出现以上影像学表现时,要考虑LCA的可能。