鸢尾素在脓毒症大鼠头端延髓腹外侧区的心血管效应
赫 曼 杜 杰 杨 磊 李 斌 杨 毅 徐 时 柴 琛
脓毒症(sepsis)是宿主对感染的反应失调引起的危及生命的器官功能障碍,尽管国内外已经对脓毒症的病理生理学有了深入的研究,但目前仍没有十分有效的治疗方法,在发达国家每年约有530万例脓毒症死亡[1,2]。脓毒症可引起低血压休克,中枢的头端延髓腹外侧区(RVLM)是调控中枢心血管活动的关键部位,位于RVLM的前交感神经元产生交感冲动,最终决定心输出量和血管阻力[3]。有研究表明鸢尾素在外周有调节血压作用,但脓毒症时鸢尾素在中枢RVLM的作用未见报道[4]。本研究通过免疫组织化学检测鸢尾素在脓毒症大鼠RVLM中表达的水平,并在中枢RVLM区域微量注射鸢尾素,以观察其对心血管效应的调控,探讨鸢尾素是否通过RVLM参与脓毒症的病程,为临床防治脓毒症寻找新的思路和实验依据。
材料与方法
1.主要实验试剂与仪器:鸢尾素购自德国Phoenix Pharmaceuticals公司;兔抗大鼠鸢尾素多克隆抗体购自英国Abcam公司;RM6250型生物信号记录系统购自成都仪器厂;XTL-3500型解剖显微镜购自上海光学仪器厂;大鼠脑MP-805型立体定位仪同购自深圳沃瑞德科技有限公司;小动物DW-3000型呼吸机购自上海嘉鹏科技有限公司。
2.实验动物及分组:清洁级成年雄性SD大鼠60只,体质量250~300g,购自甘肃中医药大学实验动物中心[实验动物许可证号:SCXK(甘)2017-0001]。实验分为两部分,每部分均采用数字表法随机进行分组。(1)鸢尾素在脓毒症大鼠RVLM的表达水平:共15只雄性SD大鼠分为正常对照组、假手术组和脓毒症模型组,每组5只。(2)鸢尾素在脓毒症大鼠RVLM产生的心血管效应:造模成功的28只雄性脓毒症SD大鼠采用数字表法随机分为4组,每组7只,对照组RVLM预先给予注射人工脑脊液;实验组分别在RVLM注射10、100和1000pmol鸢尾素,观察并记录鸢尾素在RVLM产生的心血管效应。药物剂量参考有关文献报道[5,6]。
3.建立脓毒症大鼠模型:适应性饲养大鼠5天,室温条件下自由进食水,昼夜交替。术前禁食12h,饮水不限,参照笔者前期研究[7]以盲肠结扎穿刺法(CLP)建立大鼠脓毒症模型。2%戊巴比妥钠(40mg/kg)腹腔注射麻醉,取腹部正中1.5cm的竖行切口,进腹后游离盲肠系膜,在盲肠末端中外1/3处丝线结扎,用16号针头于结扎盲肠远端横向贯穿两次,用手轻轻挤压盲肠使少量肠内容物溢出,还纳肠管并分层缝合腹壁切口。假手术组在开腹后只提出盲肠并翻动,然后关腹。手术操作后给予大鼠腹部皮下注射30ml/kg 0.9%NaCl注射液,以补充大鼠术中体液损失。术后将大鼠置于25℃的环境中,并给予充足的饲料和饮水。大鼠脓毒症模型制作成功的表现为:精神萎靡、竖毛、畏寒、眼角分泌物增多。
4.大鼠脑组织免疫组化:将大鼠脑组织石蜡切片进行脱蜡和水化,用柠檬酸钠进行热修复,PBS缓冲液冲洗后以3%的过氧化氢封闭15min,加入正常的山羊血清在室温孵育,滴加一抗(1∶200)4℃冰箱过夜,37℃水浴箱复苏后PBS缓冲液洗涤,滴加二抗后37℃的水浴箱孵育,PBS洗涤,滴加SP试剂盒中辣根过氧化物酶标记的链霉卵白素工作液,水浴箱孵育后DAB显色(1∶20),显微镜下观察显示为棕黄色时终止反应,苏木精复染,梯度乙醇脱水后封片。
5.大鼠中枢核团微量注射及定位:将大鼠成功麻醉后行气管插管,进行右侧股静、动脉插管,动脉连接到压力换能器以记录血压和心率。俯卧位将大鼠头部固定在脑立体定位仪上,开颅暴露延髓,待大鼠血压和心率稳定后进行注射。参考脑立体定位图谱以大鼠的延髓栓部为零点,向头端移动2.5~2.9mm,旁开1.6~2.0mm,向下进针深度3.0~3.4mm。用玻璃微电极自制三通玻璃微电极灌注鸢尾素100nl,给药时间5~10s。RVLM微量注射后,在同一给药部位注射2%滂胺天蓝染色,将大鼠脑组织切片,对照脑立体定位图谱验证注射部位(图1)。以上所有手术操作方法参考相关文献[8,9]。

图1 大鼠延髓冠状切面图RVLM注射部位定位图

结 果
1.鸢尾素在RVLM的表达水平:免疫组化法检测在RVLM鸢尾素表达水平,黄色颗粒为表达阳性。与正常对照组比较,鸢尾素在脓毒症组中低表达(P<0.05);假手术组与正常对照组比较表达相似(图2)。

图2 鸢尾素在RVLM的表达(HE染色,×200)A.正常组;B.假手术组;C.脓毒症组;D.与正常对照组比较,*P<0.05
2.鸢尾素在RVLM产生的心血管效应:脓毒症模型大鼠单侧RVLM微量注射人工脑脊液对大鼠的血压和心率没有明显影响(P>0.05),微量注射鸢尾素(10、100、1000pmol)可产生剂量依赖性加快心率和升高血压的作用,其中低剂量、中剂量以及高剂量组血压均显著升高(P<0.05),高剂量组心率显著升高(P<0.05)。鸢尾素在RVLM所产生的心血管效应约在给药后10s后产生,10~30s左右升高至最高点,持续约120~200s,然后逐渐下降恢复正常水平(图3)。
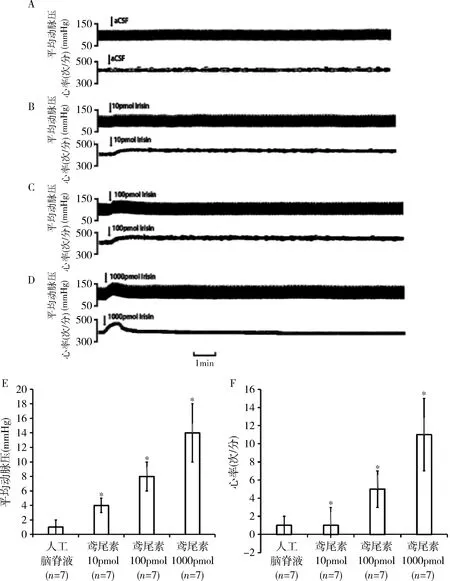
图3 RVLM单侧微量注射鸢尾素对大鼠血压和心率的影响A~D.RVLM单侧微量注射人工脑脊液(aCSF)、鸢尾素(10、100、1000pmol)后脓毒症大鼠的心血管效应;E~F.与aCSF组比较,*P<0.05
讨 论
近年来,脓毒症的发生率和病死率在逐渐增加。国际指南提出了“集束化”的综合治疗方案,但结果仍不尽人意[10, 11]。若脓毒症发展为脓毒性休克在临床治疗困难,病死率极高。本研究发现,脓毒症时一些小分子物质在RVLM起到了调控心血管的作用[9, 12]。RVLM主要接受来自外周多种感受器信息传入,以及中枢孤束核 (NTS)等心血管调节相关核团的信息传入,并将整合后的信息传至交感节前神经元,从而在维持交感静息张力,在调节各种心血管反射活动中发挥作用[13]。
鸢尾素是近年来发现的由运动诱导产生的一种肌肉因子。在过氧化物酶增殖受体γ激活因子-1α(PCG-1α)调控下,Ⅲ型纤连蛋白组件蛋白5(FNDC5)基因转录激活,FNDC5经剪切、修饰、分泌后入血,形成的多肽片段为鸢尾素[14]。鸢尾素最初被发现是一种肌动蛋白,对糖尿病、病理性肥胖等代谢性疾病具有保护作用,近年来还发现具有抗炎和抗氧化等作用[15,16]。鸢尾素有望成为炎性疾病诊断的生物学标志物和治疗的靶点,具有广阔的研究前景。
本研究结果表明,脓毒症大鼠RVLM中鸢尾素的表达显著降低,这提示内源性鸢尾素可能参与了脓毒症的病理过程。鸢尾素在脓毒症大鼠中枢部位的表达变化尚未见报道,但有研究者发现原发性高血压模型大鼠中枢微量注射鸢尾素可以显著增加下丘脑神经元的c-Fos蛋白表达,表明中枢鸢尾素水平与大鼠心血管活动相关[5]。
为进一步探讨鸢尾素是否为脓毒症低血压的始动因素,本研究以不同浓度的鸢尾素进行了RVLM微量注射,结果表明脓毒症模型大鼠单侧RVLM微量注射人工脑脊液对大鼠的血压和心率没有明显影响(P>0.05);微量注射鸢尾素(10、100、1000pmol)可产生剂量依赖性加快心率和升高血压的作用,鸢尾素在RVLM所产生的心血管效应约在给药后10s后产生,10~30s左右升高至最高点,持续约120~200s,然后逐渐下降恢复正常水平。这表明鸢尾素在脓毒症早期可能参与了脓毒性休克的血压下降过程。有研究显示,大鼠第三脑室微量注射鸢尾素可以显著升高血压,而对原发性高血压大鼠静脉给予鸢尾素时则产生与之相反的降压作用,提示鸢尾素可能通过激活下丘脑神经元来生产血管加压素,从而达到升高血压的效果[5]。有研究表明鸢尾素通过AMPK-Akt-eNOS-NO信号通路在外周显示出降压效果,然而鸢尾素在中枢产生升压作用的机制尚未见相关报道[17]。本课题组将进一步研究鸢尾素在脓毒症大鼠中枢RVLM调控心血管活动的作用机制。
——鸢尾花

