奥利司他胶囊联合胰岛素强化治疗初诊肥胖2型糖尿病患者的疗效分析
熊承云,周艳红,李江雁,赵建林
(新乡市中心医院内分泌科,河南新乡 453000)
糖尿病(DM)是由遗传因素及环境因素共同导致、以高血糖为主要特征的一组慢性代谢性疾病,其分为1 型糖尿病(T1DM)和2 型糖尿病(T2DM)[1]。T2DM 最为常见,主要由胰岛素抵抗及胰岛素分泌不足引起,而胰岛素抵抗与肥胖有直接联系,故减重可明显减轻初诊肥胖T2DM 患者的胰岛素抵抗,从而改善血糖水平。胰岛素注射为T2DM 的一种治疗方法,可弥补患者胰岛素分泌不足情况,但对胰岛素利用效率并无影响,不利于患者自身糖代谢恢复。有研究表明,体重降低约5%~10%可明显改善与肥胖相关的高血糖因素[2],而奥利司他作为脂抑素衍生物,对体重控制效果佳。本文旨在进一步证实奥利司他的临床应用价值,现报道如下。
1 资料与方法
1.1 临床资料
选取2019 年2 月至2020 年2 月新乡市中心医院收治的86 例初诊肥胖T2DM 患者,采用随机数字表法分为联合组与对照组,每组43 例。联合组男性27 例,女性16 例;年龄42~66 岁,平均(51.23±5.78)岁;病程1~6 年,平均(3.28±0.58)年;合并症:周围神经病变5 例,视网膜病变2 例,肾病1 例。对照组男性25 例,女性18例;年龄44~65 岁,平均(52.34±5.21)岁;病程1~6 年,平均(2.93±0.49)年;合并症:周围神经病变4 例,视网膜病变3 例,肾病1 例。实验对象选取标准参照《中国2 型糖尿病防治指南(2017 年版)》[3]。纳入标准:①空腹血糖(FPG)≥7.0 mmol/L,随机血糖≥11 mmol/L;②体重指数(BMI)>28 kg/m2,年龄30~70 岁。排除标准:①伴胃、肠道疾病或心血管、肝、肾并发症;②神经性厌食、贪食;③妊娠或哺乳期妇女。本研究通过医院伦理委员会批准,患者及其家属知情同意。两组性别、年龄、病程及合并症等临床资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
两组患者均给予饮食控制、适量运动等常规生活辅助方法。
1.2.1 对照组 加胰岛素强化治疗:患者三餐前15 min 行门冬胰岛素注射液[规格:3 mL∶300 单位(笔芯);国药准字:S20 153001;生产厂家:诺和诺德(中国)制药有限公司]皮下注射,20 u/次,3 次/d;并于睡前行甘精胰岛素注射液[规格:3 mL∶300 单位(笔芯)注射剂;国药准字:S20 160009;生产厂家:珠海联邦制药股份有限公司]皮下注射,16 u/次,1 次/d。
1.2.2 联合组 在对照组基础上加奥利司他胶囊(规格:0.12 g×21 粒;国药准字:H20 103180;生产厂家:重庆华森制药股份有限公司)随餐口服,0.12 g/次,3 次/d。治疗过程中严密监测两组患者血糖水平,两组均持续治疗3 个月。
1.3 指标检测
两组患者治疗前及治疗3 个月后,使用TANITA 百利达人体脂肪测量仪分别测量早餐前体重、BMI 及体脂量(PBF)。同时采集两组患者静脉血,分离血清后冷藏保存待测。采用Bio-Rex70阳离子树脂微柱层析法检测糖化血红蛋白(HbAlc)水平,采用博科全自动生物化学分析仪检测FPG、餐后2 h 血糖(2 hPG)、血清甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平。
1.4 评估标准
①HbAlc 正常值为4%~6%,当HbAlc<7% 时提示近2~3 个月血糖情况较为稳定,并发症发生概率低,HbAlc 值越高,DM 微血管病变及并发症发生概率越高。②FPG>7.1 mmol/L、2 hPG>7.8 mmol/L即可判断为血糖偏高,DM 患者FPG 及2 hPG 值越低,提示血糖控制效果越明显。③血脂正常范围:TC<5.20 mmol/L,TG<1.70 mmol/L,HDL-C>0.91 mmol/L,LDL-C<3.12 mmol/L,T2DM 患者TC、TG、LDL-C 一般水平高于正常范围,HDL-C则明显低于正常值,当血脂四项趋近正常范围常提示T2DM 患者血脂代谢控制效果良好[4]。
1.5 观察指标
比较两组患者治疗前及治疗3 个月后一般体格检查(体重、BMI、PBF)、糖代谢指标(HbAlc、FPG、2hPG)及脂代谢指标(TG、TC、LDL-C、HDL-C)水平变化情况。记录并及时处理两组患者治疗过程中药物不良反应的发生情况。
1.6 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差()表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前治疗3 个月后一般体格检查变化水平比较
两组治疗3 个月后体重、BMI 及PBF 水平较治疗前降低,且联合组低于同一时间对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组治疗前治疗3 个月后一般体格检查变化水平比较(n=43,)
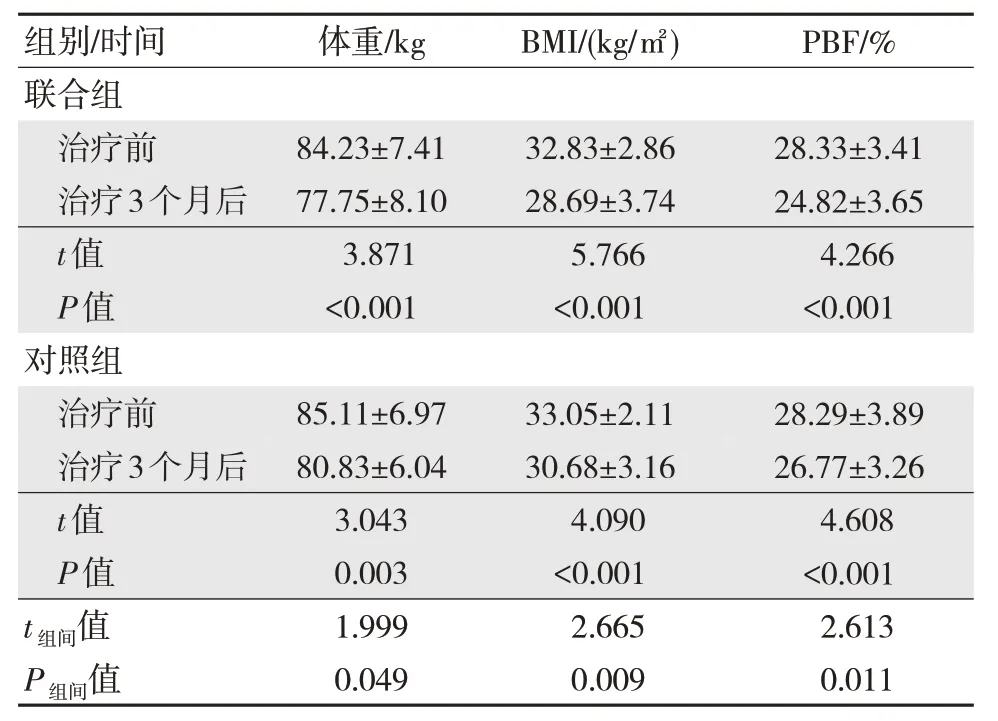
表1 两组治疗前治疗3 个月后一般体格检查变化水平比较(n=43,)
2.2 两组治疗前及治疗3 个月后糖代谢指标水平比较
两组治疗3 个月后HbAlc、FPG、2 hPG 水平较治疗前降低,且联合组低于同一时间对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组治疗前及治疗3 个月后糖代谢指标水平比较(n=43,)

表2 两组治疗前及治疗3 个月后糖代谢指标水平比较(n=43,)
2.3 两组治疗前及治疗3 个月后脂代谢指标水平比较
两组治疗3 个月后TC、TG、LDL-C 水平较治疗前降低,且联合组低于同一时间对照组;而两组HDL-C 水平较治疗前升高,且联合组高于同一时间对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组治疗前及治疗3 个月后脂代谢指标水平比较(n=43,,mmol/L)

表3 两组治疗前及治疗3 个月后脂代谢指标水平比较(n=43,,mmol/L)
2.4 两组药物不良反应发生率比较
治疗期间,联合组出现头痛2 例(4.65%),低血糖1 例(2.33%),消化道反应1 例(2.33%),共计4(9.31%)例;而对照组出现头痛3 例(6.98%),低血糖1 例(2.33%),消化道反应1 例(2.33),共计5 例(11.64%)。两组药物不良反应发生率比较,差异无统计学意义(χ2=0.000,P=1.000)。
3 讨论
T2DM 多发于>40 岁成年人,占所患DM 总数约>90%,而其中大多数为肥胖患者[5]。DM 治疗效果很大程度上取决于患者体重,由于肥胖容易造成病情加重及并发症的产生,因此针对性药物治疗对改善患者临床症状,提高治疗效果具有重要意义。
肥胖T2DM 患者体内的胰岛素分泌能力并未完全丧失,部分患者胰岛素分泌能力正常,但作用效果差,使患者体内胰岛素呈现出相对性缺乏状态。注射胰岛素可暂时降低患者血糖水平,但其长期效果并不明显。奥利司他作为半合成脂抑素衍生物,是一种胃肠道胰脂酶抑制剂,可选择性抑制胃脂肪酶及胰脂肪酶,作用效果较强,而对其他如淀粉酶、胰蛋白酶等消化酶影响不明显[6]。奥利司他可与脂肪活性残基结合,使其活性残基减少,从而减少甘油三酯的水解效率,机体摄入游离脂肪酸减少。本研究结果显示,联合组治疗3 个月后体重、BMI、PBF、TC、TG、LDL-C 水平均明显低于同一时间对照组,而HDL-C水平则明显高于同一时间对照组,说明奥利司他联合胰岛素对T2DM 患者引起的脂代谢异常改善效果更佳,对患者体质量的减轻也有明显改善。探究其原因,奥利司他对人体所摄食物中甘油三酯有明显的吸收抑制效果,可以帮助患者减缓胃肠道排空时间。在同一饮食控制情况下,减少患者能量摄取,达到减重、减脂目的。
HbAlc 可反映患者测定前2~3 个月血糖平均水平,不受每日血糖波动及食物运动影响,客观表达DM 病情控制程度,且相对于FPG 及糖耐量试验,HbAlc 对DM 诊断具有高度的敏感性及特异性[7]。根据检测结果,可指导医疗人员制定更适宜患者的治疗方案。HbAlc 能更有效地预测DM 患者并发症的发生,故维持患者体内HbAlc 水平稳定,对DM 慢性并发症的发生、发展及预后有重要意义。本研究结果还显示,联合组HbAlc、FPG、2 hPG 水平均明显低于同一时间对照组,提示奥利司他联合胰岛素治疗,不仅对患者血糖水平控制情况更佳,且可延少并发症发生风险,更有利于肥胖T2DM 患者的治疗及预后。推测其原因,肥胖与胰岛素抵抗作用直接相关,奥利司他在减轻患者体重的同时降低了胰岛素抵抗作用,提高了机体胰岛素的敏感性,从而增加胰岛素利用率,使患者血糖控制效果更佳。此外,两组在用药过程中均出现药物不良反应,比较无差异,说明奥利司他联合胰岛素治疗并未增加患者药物不良反应发生风险,药物治疗方案安全性得以证实。
综上所述,针对肥胖T2DM 患者采用奥利司他胶囊联合胰岛素强化治疗效果更明显,对患者体质量、糖脂代谢均有明显改善,且该方案安全性高,对患者的预后具有重要临床意义。

