老龄兔心房电生理特征及其与心房颤动的易感性
胡伟芳 张兵 刘磊 吴萍 李小红 黄雪渊
心房颤动(atrial fibrillation,AF)是临床上最常见的房性心律失常,老龄化是其最常见的病因,具有独立危险性[1]。其原因可能与老龄化心房出现电冲动传导速度下降,动作电位形态异常,心房肌细胞离子通道结构和功能选择性改变为特征的电重构密切相关[2]。笔者观察老龄兔电生理活动的改变,探讨老龄易于发生AF的原因。
1 材料与方法
1.1 实验动物及分组 青龄和老龄的雄性新西兰大耳白兔,各15只,购自武汉生物制品研究所实验动物养殖中心。青龄兔为性成熟成年个体[兔龄5~10个月,体重(2 500.9±55.3)g];老龄兔为老年个体[兔龄22±3个月,体重(5 000.6±100.8)g]。动物从购回到用于实验前均饲养于实验动物室。实验分为青龄组和老龄组,饲养2周后进入相关实验。
1.2 主要实验溶液和试剂 Tyrode 液成分(mmol/L):NaCl 135.0、KCl 5.4、CaCl21.8、MgCl21.0、Na H2PO40.33、HEPES 10.0、Glucose 10.0,p H用NaOH 调至7.35。无Ca2+Tyrode液和含有0.2 mmol/L Ca2+的Tyrode液分别为Tyrode 液中无CaCl2和仅加0.2 mmol/L CaCl2。短暂外向钾电流(Ito)细胞外液成分(mmol/L):NaCl 35.0、氯化胆碱100.0、KCl 5.4、MgCl21.0、Na H2PO40.33、HEPES 10.0、Glucose 10.0,p H 用NaOH 调 至7.35。Ito电极内液成分(mmol/L):KCl 45、K-aspartate 85、Na-pyruvate 5、Mg ATP 5.0、EGTA 10.0、HEPES 10.0、Glucose 10.0,p H 用KOH 调至7.3。其中,用于阻滞Ca2+和Na+电流的Cd Cl2和BaCl2,以及消化心肌组织的胶原酶Ⅰ和蛋白酶E 均购于Sigma公司,TTX 购于大连水生研究所,其他试剂为国产分析纯。
1.3 ECG 记录 随机选取各组兔(每组10只)背仰卧捆绑于带有温控(37℃)电热毯的动物台上,用16导电生理系统(Power Lab 16/30,澳大利亚)记录兔清醒状态下(非麻醉)2 h的Ⅱ导联心电图(normalⅡelectrocardiogram,ECG-Ⅱ,滤过率为0.1~100 Hz)。后用系统自带兔的标准化记录和分析模块(LabChart Pro V7,澳大利亚)测量和分析连续记录、无干扰和走形稳定的20个P-QRS波群。观察测量P波间 期、P波 离散度、PR 间期、RR 间期、QT间期和心率。
1.4 单相动作电位(MAP)记录 用戊巴比妥钠(300 mg/Kg)经兔耳缘静脉麻醉上述记录完ECG的兔,按外科无菌手术操作开胸,开睑器撑开胸廓充分暴露心脏视野,剪开心包膜,用与生物电放大器、连接的微电极接触自律心率下离左心耳稍远、靠近房间隔的左心房前壁,记录电信号经16导数模转换器转换并由滤波器(0.3 Hz~1 KHz)滤过形成MAP后显示到计算机上。用系统自带记录和分析模块测量、分析和统计。观察主要参数及其意义同参考文献[3],包括从动作电位0期开始除极到1期开始复极恢复到10%、20%、90%的时程(APD10、APD20和APD90)、动作电位平台期电位(plateau potential,plateau P)和最大上升速率(maximum upstroke velocity,Maxdv/dt)。
1.5 心房有效不应期(AERP)和AF 诱发 记录MAP电极位置、记录信号及其数模转换形成动作电位图形不变,将另一对连接刺激器(Grass S88,美国)的电极(用银丝自制而成)置于右房心外膜对心房进行程控刺激,按每8个基础刺激周长(basic cycle lengths,BCLs)S1后发出一个期前刺激S2进行,BCLs分别为300、200和150 ms,刺激电压为2倍的舒张期阈值,偶联间期分别从300、200和150 ms开始,以5 ms步长反扫递减,直到S2诱发激动被夺获,此时的S1S2偶联间期分别定义为300、200和150 ms的AERP。系统自带的兔标准化记录和分析模块测量、分析和统计,同一部位重复起搏3次并记录3次,取平均值。观察指标包括BCLs分别为300、200 和150 ms的AERP 的平均值,AERP离散度(dispersion of AERP,d ERP,即同一个BCLs过程中记录到最长与最短AERP的差值),和频率自适应性(frequency self adaptation of AERP,f ERP,即最长与最短BCLs测得的AERP差值)。
完成上述实验,兔依然存活的情况下,按S1S1的BCLs依次为200 ms至20 ms,按10 ms递减,每个BCLs的脉宽为2 ms,持续时间10 s,直至诱发AF(心房频率超过500次/分,并伴有不规则的房室传导)。观察指标包括诱发AF的BCLs、诱发率。
1.6 Ito记录及其电流-电压(I-V)拟合 将各组做完电生理实验剩下兔经耳缘静脉注射戊巴比妥钠(300 mg/Kg)麻醉和肝素钠(500 IU/Kg)抗凝,10 min后手术摘下整体心脏,行Langendorff灌流(流速18~20 ml/min,37℃,100% O2饱和),先用正常台式液灌流10 min,再用含2种消化酶(胶原酶Ⅰ0.33 mmol/L;蛋白酶E 0.25 mmol/L)的无Ca2+台式液灌流10 min,后用正常台式液冲洗5 min终止消化,取下心脏去除心室,留下心房肌组织在正常台式液中剪碎,震荡,过滤反复3 次,最后离心、稀释,获得密度为5×105/ml的心房肌细胞悬液,供膜片钳实验。
先将细胞悬液加于倒置显微镜(IX70-122,Olympus,日本)的载物台上的细胞记录槽中,等细胞静置沉底贴壁,用记录Ito细胞外液循环灌流10 min。后在Pulse+Pulsefit软件(version8.31,HEKA,德国)的控制下,使指令程序和记录信号经放大器(EPC-9,HEKA,德国)转换和放大,通过充灌Ito电极内液、电阻为2.5~3.5 MΩ 的玻璃微电极与细胞封接直到电阻达1 GΩ 以上,补偿快电容,施加负压吸破细胞膜并作慢电容和漏电容补偿,形成全细胞膜片钳记录模式。设置电压钳制方案:先给一个-80 m V 至-50 m V、持续时间20 ms预钳制电压,再给予钳制电压-50 m V,指令电压由-50 m V 到+50 m V,跃阶10 m V,钳制时间300 ms。获得各组电流的数据经Pulse软件采集并存储于计算机的硬盘中,后用分析软件(version 3.31,Igor Pro,美国)对实验图形进行拟合分析处理。为消除每个细胞大小对统计结果造成误差,电流大小用电流密度(p A/p F)表示。Ito的I-V 曲线是以各自指令电位为横坐标,相对应的电流密度为纵坐标作图完成。
1.7 统计学分析 采用Origin 6.0(Microcal公司,美国)软件进行统计学分析。计量资料用±s表示,正态分布采用方差分析,两组间比较采用t 检验。计数资料用率表示,采用卡方检验。以P<0.05为差异有显著性。
2 结果
2.1 二组ECG 参数比较 与青龄组比较,老龄组P波间期、P波离 散 度、PR 间 期、RR 间 期 和QT 间期均延长,心率减慢(P 均<0.05),见表1。
2.2 二组MAP比较 与青龄组比较,老龄组平台期变窄,复极相增宽,同步记录MAP个数减少。老龄组兔的APD10和APD20缩短,平台期电位绝对值增高,APD90延长以及最大上升速率加快(P 均<0.05),见图1,表2。

表1 二组兔的ECG 主要参数比较

图1 二组MAP形态特征比较

表2 二组MAP参数比较
2.3 两组心房肌组织程控刺激主要参数比较 与青龄组比较,老龄组兔AERP 和f ERP 缩短,d ERP和诱发AF的BCL延长更加明显(P 均<0.01),AF诱发率增加亦更显著(P<0.05),表现为AMP变为形态不规则,且持续时间较长的触发性电活动。见表3,图2。
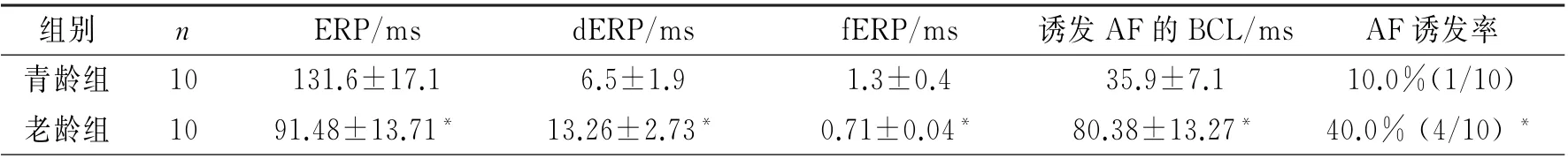
表3 二组兔心房肌组织程控刺激主要参数比较
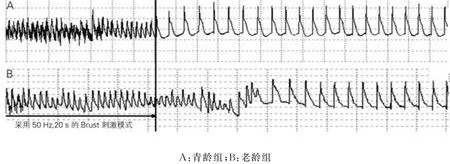
图2 二组在Burst刺激模式诱发AF的形态特征比较
2.4 二组心房肌细胞Ito及其I-V 曲线比较 在电压钳制方案下,2组心房肌细胞Ito随着钳制电压的增加均在上升,且在相同钳制电压下,老龄组兔心房肌细胞Ito较小。从I-V 曲线中发现,老龄组兔心房肌细胞Ito的I-V 曲线明显下移,处于青龄组兔心房肌细胞Ito的I-V 曲线以下。当钳制电位为+50 m V时,老龄组兔心房肌细胞Ito为(12.8±0.9)p A/p F,较青龄组兔心房肌细胞Ito的(16.8±0.7)p A/p F 显著减小(P<0.01,n=10)。见图3。

图3 二组心房肌细胞Ito及其I-V 曲线
3 讨论
本实验观察发现,老龄兔心率明显减慢,心电图的P波和PR 间期等主要参数均显著延长,特别是P波离散度增加严重,这些体表心电图数据的变化预示老龄心脏电生理特性发生了改变,另一方面提示老龄化心房电活动基础特征与青龄心脏有明显不同[4]。这在本实验进一步的观察结果中也可发现,在老龄兔心房肌组织上,动作电位平台期缩短,电位降低,而终末复极相动作电位时程明显延长,最大上升速率减小,提示人的心脏在从青龄进入老龄阶段中,心脏电生理基本特征发生了电重构,表现为行进于心房组织中电冲动形成和下传放缓、受抑制或间断,正常电活动不能按规律性生成或下传,心房舒张间期拥有更长的时间窗口,甚至出现电冲动扩布的不均一性[5]。本实验发现,老龄心房的ERP明显缩短,其离散度在增大,自适应性在减小此为折返性房性心律失常发生提供了条件和途径。从而在额外刺激下,即使较长程控刺激条件下,就能诱发房性心律失常甚至AF,对AF发生具有明显易感性[6]。
本实验结果表明老龄化心房发生了电重构,对房性心律失常或AF具有显著易感性。而对于老龄化心脏出现的电冲动减慢,动作电位复极化时程延长,平台期电位降低,其细胞离子通道基础多与外向钾电流下调和(或)内向电流上调,引起电压依赖性复极化K+电流激活减缓,外向性钾电流流动减少相关[7]。本实验结果表明,在电压钳制方案下,老龄兔心房肌细胞Ito的电流密度明显减小,I-V 曲线下移,提示兔的心脏在老龄后心房肌细胞外向型钾电流出现显著减少改变,允许心房肌细胞浆中K+经细胞膜流出道胞外数量减小,离子通道的流速、流态放缓,出现离子通道重构,从而引起动作电位复极化时程延长,平台期电位下降[8]。
——从一道浙江选考生物学试题谈起

