新疆地区汉族、哈萨克族心房颤动患者CD4+、CD8+T细胞程序性细胞死亡受体-1表达水平及特点研究*
包针 白雯 王姣 杨玉春 刘志强 何鹏义 木胡牙提
免疫反应是炎症反应的中心环节,尤其是T 细胞的免疫应答和免疫调节。程序性死亡受体-1(PD-1)被认为在T 细胞反应调控中发挥重要作用,目前在恶性肿瘤、自身免疫性疾病中得到了广泛研究。有研究指出PD-1 或PD-1配体(PD-L1)的下调均可导致小鼠心肌的自身免疫损伤,甚至诱发致死性心肌炎[1]。PD-L1的基因缺失,以及PD-L1阻抗剂的治疗,会加剧心脏的炎症反应[2],表明PD-1/PDL1信号通路介导的免疫反应对心肌免疫应答有重要的影响。目前心房颤动(简称房颤)的发生机制尚未完全阐明,大量研究表明房颤患者血浆中的免疫炎性标志物较健康个体明显升高[3],提示免疫反应参与了房颤的发生与发展。笔者通过观察房颤患者PD-1在CD4+T、CD8+T 细胞的表达,探讨PD-1/PD-L1信号通路在房颤中的可能机制,为房颤的防治提供新的治疗靶点。
1 资料与方法
1.1 研究对象 2017年5月至2018年12月间新疆医科大学第一附属医院心脏中心住院人群,按照纳入及排除标准入选研究对象,非瓣膜性房颤患者为房颤组,其中汉族房颤50例(汉族房颤组),哈萨克族房颤50例(哈萨克族房颤组);同时选择同期住院的非房颤患者作为对照组,汉族对照50例(汉族对照组),哈萨克族对照50例(哈萨克族对照组)。
纳入标准:房颤组为有明确房颤病史和(或)心电图/动态心电图有明确房颤心律的汉族和哈萨克族房颤患者;对照组为无房颤病史,且入院后经心电图/动态心电图排查无房颤心律的汉族和哈萨克族非房颤患者。
排除标准:经病史询问、心脏超声、血液生物化学检查排除心脏瓣膜病、先天性心脏病、房颤家族史、肝肾功能不全、1个月内有外伤或炎症疾病史、风湿免疫性疾病、恶性肿瘤、近1年内因其他疾病接受过免疫抑制剂治疗。
1.2 样本收集 采集所纳入研究对象的血液样本,采血前空腹8 h,入院后隔日清晨每例采集3 ml静脉血液,经处理后使用流式细胞仪检测研究对象外周血中CD4+和CD8+T 淋巴细胞表面PD-1 的表达水平。
1.3 检测方法 分离外周血单个核细胞:取新鲜抗凝血1 ml,与生理盐水1∶1混匀后,在液面上加入2 ml外周血淋巴细胞分离液;以1 500 rpm 离心20 min,取第二层环状乳白色层为淋巴细胞,将收集的细胞放入含生理盐水4~5 ml的试管中,充分混匀,以1 500 rpm/min离心20 min,沉淀用无菌磷酸盐缓冲盐水(PBS)洗涤两次。然后用RPMI 1640 培养基重新悬浮,调整细胞密度为1×107/ml。
流式细胞术检测:取流式试管4支,2支分别设为抗体对应的同型对照组,1支加入荧光抗体CD3 PERCP-CY5.5(560835,BD Pharmingen)、CD4 FITC(561842,BD Pharmingen)、PD-1 PE(560795,BD Pharmingen)各20 ul;1 支加入荧光抗体CD3 PERCP-CY5.5、CD8 FITC(561947,BD Pharmingen)、PD-1 PE 各20 ul;混匀后室温避光孵育15 min,流式洗液洗涤三次后上流式细胞仪(美国BD流式细胞仪,型号:FACSAria II)检测PD-1 阳性率,结果用CellQuest软件分析。
1.4 统计学方法 采用SPSS 23.0统计学软件进行数据处理,计量资料以(±s)表示,符合正态分布的资料,两组间比较采用t检验,多组间均数比较方差齐时采用单因素方差分析,方差不齐时采用秩和检验,多组间两两比较采用Bonferroni法调整P值,统计图使用GraphPad Prism 7完成。以P<0.05 为差异有显著性。
2 结果
2.1 研究对象的一般临床资料分析 同民族的房颤组与对照组年龄、性别、高血压、糖尿病、冠心病分布无差异,汉族与哈萨克族房颤组的左房内径均大于同民族对照组。见表1。
2.2 CD4+T、CD8+T 淋巴细胞PD-1的阳性表达率 汉族房颤组、哈萨克族房颤组CD4+T 淋巴细胞PD-1的阳性表达水平均低于同民族对照组;哈萨克族对照组CD4+T 淋巴细胞PD-1的阳性表达水平高于汉族对照组。汉族、哈萨克族对照组和房颤组CD8+T淋巴细胞上PD-1的阳性表达水平无显著差异,哈萨克族人群中CD8+T 淋巴细胞上PD-1的阳性表达水平高于汉族人群。见图1、2、表2。
在不区分民族的统计分析中,对照组CD4+T淋巴细胞上PD-1的阳性表达水平高于房颤组(12.71±4.81 vs 7.12±3.32,P<0.01),两组间CD8+T淋巴细胞上PD-1的阳性表达水平无显著差异(4.23±2.31 vs 3.81±2.04,P>0.05)。
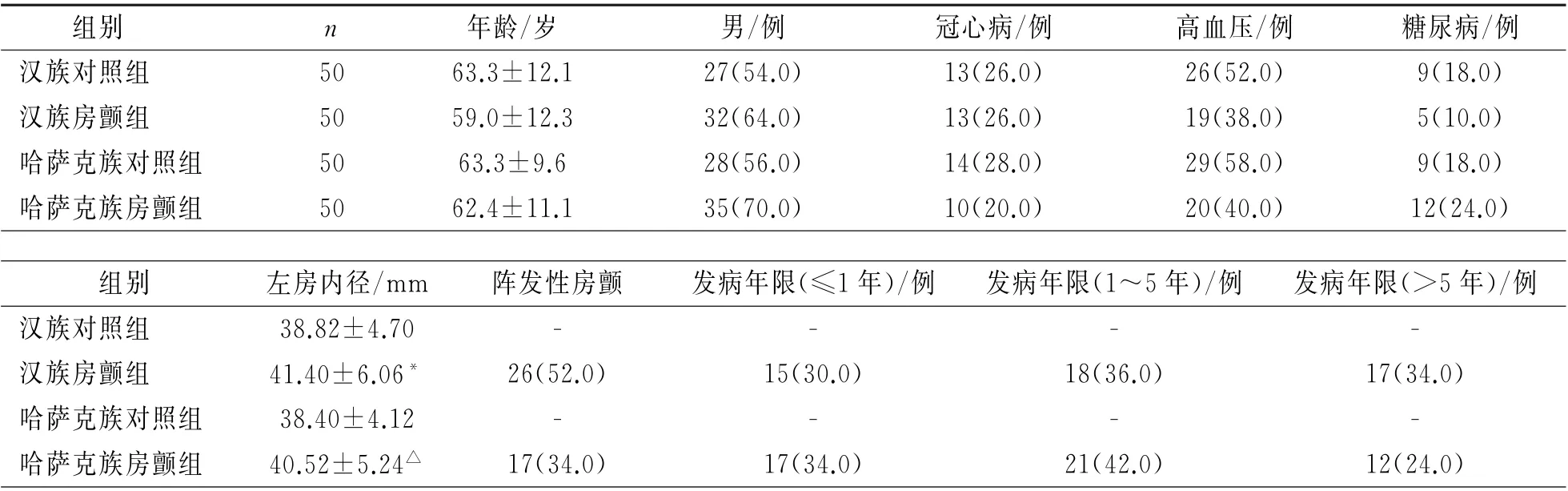
表1 四级一般临床资料比较
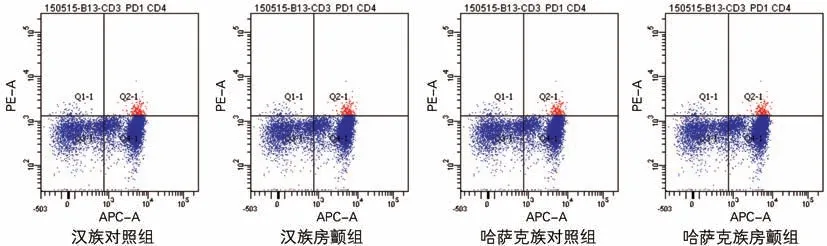
图1 PD-1在各组患者外周血CD4+T 淋巴细胞表面的阳性表达率
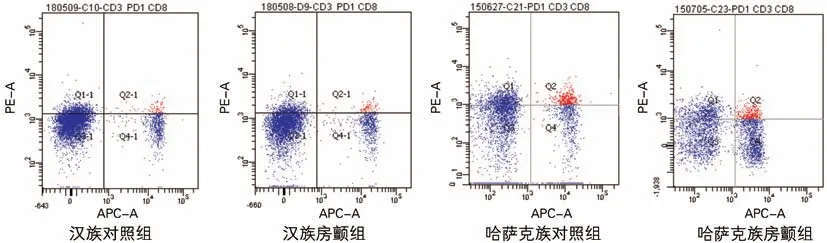
图2 PD-1在各组患者外周血CD8+T 淋巴细胞表面的阳性表达率
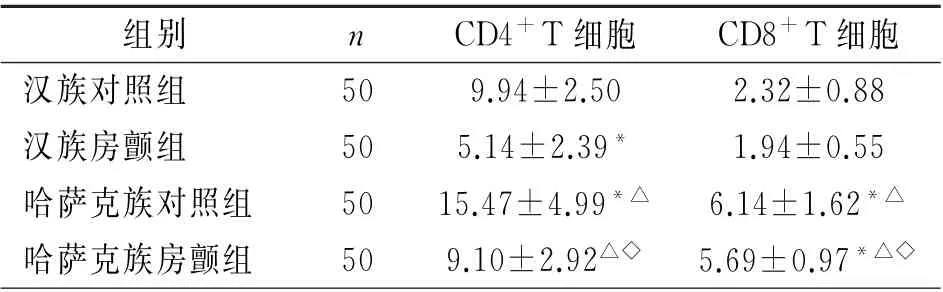
表2 四组外周血CD4+、CD8+T淋巴细胞表面PD-1的表达
3 讨论
PD-1是CD28免疫调节分子家族的一员,可被诱导表达于T 细胞表面,激活T 细胞上的抑制受体,向T 细胞传递抑制信号。树突状细胞(Dendritic cells,DC)是激活初始T 细胞功能最强大的抗原递呈细胞,在启动、调控及维持特异性免疫应答中发挥重要作用[4]。在外周器官中DC 细胞表面的PDL1与CD4+、CD8+T 细胞表面的PD-1结合后,可抑制T 细胞活化、增殖,阻碍免疫应答,诱导T 细胞衰竭,甚至凋亡[5],在诱导和维持自身免疫耐受中起着关键作用。此外,PD-1 还通过与DC 细胞表面PD-L1结合而向DC 细胞传递反向信号,使DC 细胞分泌抑制性细胞因子IL-10 增加,从而介导DC成熟障碍并抑制DC细胞的抗原递呈功能[6]。实体肿瘤利用PD-1/PD-L1信号通路介导的抑制途径,减弱抗肿瘤免疫,逃避免疫系统的破坏,从而促进肿瘤的生存[7]。
在本研究中,汉族、哈萨克族房颤组CD4+T 淋巴细胞表面PD-1的表达水平低于同民族的对照组,且在总房颤组中CD4+T淋巴细胞表面PD-1的表达水平低于对照组,表明在房颤患者体内PD-1的表达是下调。Cochain等[8]以PD-1-/-小鼠为实验组的研究发现,PD-1 的缺失可显著上调小鼠CD4+T 和CD8+T的表达,同时表现出更为显著的T细胞活化。有研究通过建立依赖CD4+T、CD8+T细胞介导的心肌炎模型中发现,PD-1缺陷小鼠心肌炎症程度增加,心肌损伤的血清标志物增加,炎性细胞浸润增加[9]。这些实验证实在心肌细胞中PD-1也能通过抑制T细胞活化,降低组织中的免疫反应。相反,PD-1表达的下调减弱了对心肌组织中T 细胞活化的抑制作用,进而增加心肌细胞的免疫反应并发生心肌细胞的损伤,这提示PD-1对保护心脏免受T细胞介导的免疫损伤的重要性。因此,PD-1可能是通过调节T 细胞介导的心肌细胞免疫损伤,导致心肌炎症增加,参与房颤的发生。在本研究中,房颤组CD8+T 淋巴细胞表面PD-1阳性表达率与对照组相比无差别。此外,CD4+T 细胞上PD-1 阳性的表达率明显高于CD8+T细胞。这可能是由于T细胞介导的免疫应答在不同的炎症反应通路并不完全相同,例如PD-1在结核分枝杆菌感染的特异性CD4+T 细胞上的表达,而不是CD8+T 细胞[10]。因此考虑在房颤患者中免疫应答主要以CD4+T细胞为主。
我国哈萨克族人群的房颤患病率低于全国平均水平,考虑与哈萨克族的饮食习惯所致低尿酸水平及民族间的差异相关[11]。本研究中对比了汉族与哈萨克族人群中房颤组与对照组T 细胞表面PD-1的阳性表达率的差异发现:哈萨克族人群CD4+T、CD8+T 淋巴细胞表面PD-1的表达均高于汉族人群。提示哈萨克族人群PD-1/PD-L1信号通路存在上调,这可能是哈萨克族较低的房颤患病率的潜在机制。在肿瘤细胞中,PD-1/PD-L1 信号通路通过作用于下游的酪氨酸磷酸酶(SHP1/2)[12],使其对下游靶分子发挥去磷酸化作用,下调PI3K-AKT、MAPK 信号通路,促进T 细胞的衰竭、凋亡[13-14]。目前阻断PD-1/PD-L1通路的靶向药物已用于治疗依赖T 细胞免疫反应的肿瘤,并且取得了一定的效果[15-16]。房颤人群中PD-1/PD-L1 信号通路是否具有相同的分子机制仍需进一步的研究证实,但通过本研究可以确定的是,房颤患者体内PD-1 的表达相对于健康人群是下调的,并且在一定程度上可以解释哈萨克族较低的房颤患病率。

