肿瘤突变负荷对初诊野生型晚期非鳞状细胞非小细胞肺癌化疗效果的影响
林贵南,彭杰文,陈可绪(广东省中山市人民医院化疗二区,广东中山528403)
肺癌现今是世界上发病率、致死率以及致畸残率最高的一种恶性肿瘤,近年来由于环境和人群生活方式改变导致肺癌发生率不断增高[1],多数患者确诊时病情已发展至晚期,不适合接受手术治疗而进行化疗[2]。野生型晚期非鳞状细胞非小细胞肺癌主要采用一线化疗,相较于二线、三线化疗对患者更为经济、理想。肿瘤突变负荷(TMB)是近年临床肺癌治疗疗效预测和预后评估的研究热点[3-4]。本研究对TMB与初诊野生型晚期非鳞状细胞非小细胞肺癌化疗疗效、预后关系进行探讨。
1 资料和方法
1.1 一般资料
选取2014 年1 月-2018 年12 月在本院进行化疗的野生型晚期非鳞状细胞非小细胞肺癌患者,依据均数抽样公式,U 为检验水准α 对应的U 值,σ 为总体标准差,δ 为容许误差,依据实验得出标准差σ=1.06,取α=0.05,δ=0.1,得出样本量为100,考虑到失访率以及抽样误差在100 人的样本量基础上增加20%的样本数,扩展为120 例。纳入标准:(1)均为初诊非鳞状细胞非小细胞肺癌;(2)影像学检查可见有远处器官转移;(3)基因检测为表皮生长因子受体(EGFR) 常见突变和间变性淋巴瘤激酶(ALK) 融合基因阴性;(4)一线接受培美曲塞和顺铂方案;(5)有化疗前组织标本用于TMB 检测;(6)临床资料完整。排除标准:(1)合并其他恶性肿瘤者;(2)肿瘤突变负荷检测前已接受放疗、化疗者;(3)妊娠期者。经本院医学伦理委员会批准,将入组患者按肿瘤突变负荷水平分为3 组,高水平组TMB≥20 mut/Mb(n=25),中水平组6 mut/Mb≤TMB<20 mut/Mb(n=47),低水平组TMB<6 mut/Mb(n=48)。
1.2 方法
所有患者化疗前均利用二代测序方法检测肿瘤组织标本TMB 水平,具体为:采集患者肿瘤组织标本,采集完成后利用甲醛固定并进行石蜡包埋,然后采用苏木精-伊红进行染色,经病理专家判定选取肿瘤细胞含量超过10%组织。同时采集患者静脉血作为阴性对照,采集8~10 mL 外周血并置于EDTA抗凝管中,然后进行离心,其白细胞沉淀则作为阴性对照。样本处理完成后进行组织、白细胞DNA 提取,试剂盒购自于Qiagen 公司,文库制备试剂盒购自于Kapa biosystems 公司,文库纯化和PCR 扩增结束后开始目标基因富集及测序。对DNA 文库添加标签并混合样本,在文库416 个癌症相关基因编码区域以及16 个基因的内含子利用定制生物素型DNA 探针捕获、杂交,并采用Illumina p5、p7 引物和Kapa biosystems 公司提供的新一代测序文库扩增高保真热启动聚合酶预混液扩增文库DNA,文库富集后测序。测序数据采用Trimmomatic25 软件过滤排除低质量/N 碱基,利用GATK 软件对单核苷酸变异、插入缺失突变进行分析并剔除常见变异。TMB 由编码区域单核苷酸变异、插入缺失突变组成,同时剔除原发性肺癌驱动基因突变以及移码突变、抑癌基因截短突变,并将组织标本和白细胞进行对比剔除种系突变。化疗方案为:培美曲塞[齐鲁制药有限公司,国药准字H20060672,规格0.2 g(按C20H21N5O6计)]500 mg/m2,静滴,第1 天;顺铂(江苏豪森药业集团有限公司,国药准字H20040812,规格2 mL ∶10 mg)75 mg/m2,静滴,第1 天;每3 周一疗程。首次接受培美曲塞前1 周肌注维生素B121 000 μg,口服叶酸400 μg/d,并于培美曲塞用药当天、隔天、前1 d 口服地塞米松4 mg,2 次/d。以首次治疗时间为观察起点,对患者以电话或上门形式进行随访,末次随访时间为2018 年12 月31 日。
1.3 观察指标
(1)肿瘤突变负荷与患者临床指标相关性。(2)临床疗效[5]:客观缓解率(ORR)、无进展生存时间(PFS)和总生存时间(OS),ORR=(完全缓解(CR)例数+部分缓解(PR)例数)/总例数×100%;PFS 为接受治疗开始时间至患者病情进展或死亡时间,OS 为接受治疗开始时间至患者死亡、末次随访时间。(3)TMB 临界值。(4)不同水平TMB 与PFS、OS 关系。
1.4 统计学处理
采用统计学软件SPSS22.0 分析和处理,计量资料采取±s表示,多组间比较采用单因素方差分析;计数资料采取率(%)表示,比较行χ2检验。利用Spearman 秩相关性分析TMB 与临床指标相关性;利用ROC 统计方法计算肿瘤突变负荷的最佳临界值;Log-rank 检验方法比较不同TMB 水平PFS 及OS 时间;Cox 回归分析TMB 对PFS 及OS 的预后影响。以P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料
高水平组有吸烟史者多(P<0.05),见表1。
2.2 临床疗效
高水平组ORR 最高,OS 时间最长(P<0.05),见表2。
2.3 TMB 对PFS、PS 的影响
对所有肺癌化疗患者年龄、性别、吸烟史、临床类型、临床分期、ECOG-PS 评分、家族肿瘤史、TMB 水平等行单因素分析,结果显示TMB 水平对患者PFS、OS 影响作用明显(P<0.05)。多因素Cox 回归分析显示高水平TMB 对PFS、OS 预后影响显著(P<0.05),低、中水平TMB 影响削弱,见表3、4。

表1 3 组患者临床资料的比较 (例)
3 讨论
野生型晚期肺腺癌属于异质性肿瘤,选择有效疗效预测和预后指标对于临床意义重大。TMB 是目前一直在研究的生物标志物,有利于临床筛查适合接受免疫治疗的患者,促进临床有效治疗[6-7]。因多数晚期癌症患者无法提供足够肿瘤组织进行检测,而液体活检在临床肿瘤中已逐渐应用,为TMB 发展提供了良好基础。当患者体内TMB 水平较高时,肿瘤细胞所产生的新抗原数量、种类增加,从而提高免疫识别概率,同时机体抗肿瘤免疫应答反应被免疫检查点抑制剂激活使肿瘤细胞杀伤率增加。2019 年NCCN 指南将TMB 检测列入,快速推动了TMB 在临床治疗中的应用。一项研究表明高水平TMB 与各癌症类型生存率明显相关,可提高整体生存率[8]。
本研究结果显示3 组不同水平TMB 患者其吸烟史比较有统计学意义,提示吸烟可能影响肺癌患者TMB 水平,分析其原因可能与吸烟致使大量诱变剂暴露有关。在Wang 等[9]研究中也指出高水平TMB与吸烟有关。本研究中高水平TMB 患者ORR 明显高于低、中水平TMB 患者,提示高水平TMB 患者ORR 较低、中水平TMB 患者改善明显,其原因可能是受TMB 水平和化疗响应率之间影响。在非小细胞肺癌临床治疗相关报道中,多个研究均表明高水平TMB 患者ORR、PFS、OS 优于低水平TMB 患者[10-13],并可提高患者免疫应答。但本研究中PFS 与临床报道不具有一致性,分析原因认为可能与驱动突变因素影响有关,为进一步对此进行论证可考虑在之后研究中对驱动突变因素进行具体分析。本研究结果显示,高水平TMB 患者的OS 长于低、中水平TMB 患者,提示TMB 对患者的OS 具有预测作用,可在临床治疗中提示有关治疗方案制定。高水平TMB 患者OS更长的原因可能是高水平TMB 患者体内癌细胞产生新抗原较多,因此可被免疫细胞识别可能性大,故而患者在免疫治疗中获益更多,总生存时间随之延长。有关报道显示高水平TMB 与临床预后较好有关,Owada-Ozaki[14]、Devarakonda 等[15]研究指出高水平TMB 是影响非小细胞癌预后的重要因素,可辅助预测免疫检查点抑制剂疗效从而改善患者生存状况。本研究Cox 回归分析显示,高水平TMB 对患者PFS、OS 影响显著,可见在临床中对其预后有预测作用。虽然TMB 是一项简单、容易获得的临床标志物,且被证实可用于临床非小细胞肺癌疗效及预后预测,但关于TMB 检测尚无统一标准,临床操作中可受肿瘤组织标本数量或质量、检测时间长、检测方法、肿瘤组织异质性等因素影响限制其应用。
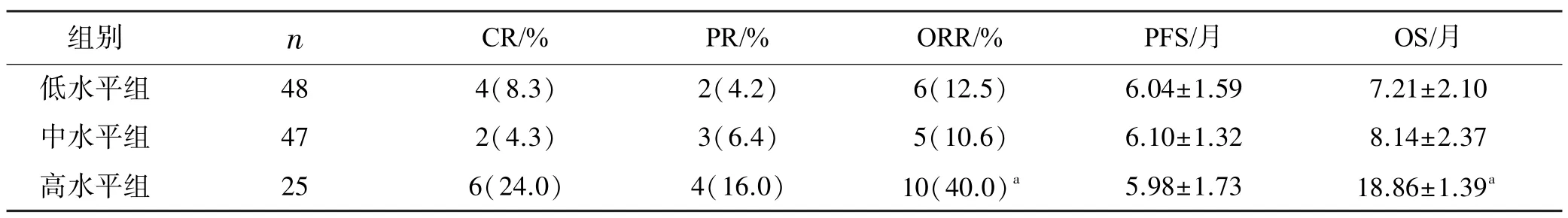
表2 3 组临床疗效的比较

表3 TMB 水平对患者PFS 的影响

表4 TMB 水平对患者OS 的影响

