Gefitinib 对人结肠癌Caco-2 细胞增殖与凋亡的影响
孙锦辉,李春潮,范旋燕,黄 聪,全娟花* (.广东医科大学附属医院消化内科,广东湛江 5400;.北京大学深圳医院皮肤性病科/皮肤病研究所,广东深圳 58036)
结肠癌由遗传和环境因素相互作用引起[1],目前早期癌可予内镜黏膜下剥离术治疗,中晚期癌首选根治性手术并辅以化疗,但肿瘤的复发转移以及耐药等问题使近30 年结肠癌的5 年生存率维持在50%~60%。近年来,肿瘤的靶向治疗可特异性作用于特定的分子,且对正常组织损伤较小,这为结肠癌的治疗提供了新的方向[2]。Gefitinib 是一种酪氨酸激酶受体抑制剂,有研究报道Gefitinib 对多种肿瘤有明显的抑制作用,而正常组织表现出良好的耐受性[3-4]。本研究主要通过体外实验探讨Gefitinib 对Caco-2 细胞增殖凋亡的影响及其潜在机制,为其应用于结肠癌的治疗提供理论依据。
1 材料和方法
1.1 材料
1.1.1 主要试剂与仪器 Gefitinib(美国Sigma 公司),人结肠癌细胞株Caco-2 购于中科院上海细胞库,胎牛血清FBS(乌拉圭Lonsera 公司),RPMI1640 培养基(美国HyClone 公司),100×青霉素/链霉素双抗(美国Gibco 公司),胰蛋白酶含0.25% EDTA(美国Sigma 公司),10×PBS 缓冲液(美国Solarbio 公司),Cell Banker2冻存液(日本ZENOAQ 公司),MTS(美国Promega公司),AnnexinV-FITC/PI 细胞凋亡检测试剂盒(日本Dojindo 公司),Texas RedTM-X Phalloidin 试 剂(美国Life Technologies 公司),DAPI (美国 Vector Laboratories 公司),JC-1 线粒体膜电位试剂盒、免疫染色固定液、免疫染色洗涤液、SDS-PAGE 凝胶配制试剂盒(中国碧云天公司),CETi Lysis Buffer(韩国Trans Lab 公司),BCA 试剂盒(中国Genstar 公司),0.2 μm PVDF 转印膜(美国Millipore 公司),20×TBS(美国Solarbio 公司),发光液(美国MILLIPORE 公司),α-Tubulin(美国SANTA CRUZ 公司),兔抗IgG-HRP、鼠抗IgG-HRP(美国Cell Signaling 公司),p-p38、p38、p-ERK、ERK、p-JNK、JNK、Caspase-3、PARP(美国Cell Signaling 公司),超声细胞破碎仪(中国宁波新芝生物公司),酶标仪(美国Thermo 公司)Azure c500(美国Azure Biosystems 公司),荧光显微镜(德国Leica 公司),流式细胞仪(美国BD 公司)
1.2 方法
1.2.1 细胞培养 将Caco-2 细胞培养于含10%胎牛血清、1%抗菌-抗真菌剂(青霉素、链霉素、两性霉素B)的RPMI1640 培养基中,置于37 ℃、5% CO2环境下培养,每3 d 更换培养基,待细胞融合度达到80%~90%,用含0.25%-EDTA 胰蛋白酶消化、传代备用。
1.2.2 MTS 检测Gefitinib 对Caco-2 细胞增殖的影响 取对数生长期的细胞,经胰酶消化后,用含10%胎牛血清的培养基配成活细胞密度为5×103个/mL 的细胞悬液,按每孔100 μL 接种于96 孔培养板中,培养24 h 后,更换含浓度为0、2.5、7.5、15、30 μmol/L Gefitinib 的完全培养基,每个浓度设4 个复孔。处理24、48、72 h 后参照MTS 试剂盒说明书操作,用酶标仪在492 nm 波长处测定各孔吸光值并计算细胞增殖抑制率,抑制率(IR)=(对照组吸光值-实验组吸光值)/对照组吸光值,统计并分析。
1.2.3 流式细胞术检测Gefitinib 对Caco-2 细胞凋亡的作用 取对数生长期的细胞,经胰酶消化后,用含10%胎牛血清的培养基配成活细胞密度为3×105个/mL 的细胞悬液,接种于6 孔板中,培养24 h 后,更换含浓度为0、2.5、7.5、15、30 μmol/L Gefitinib 的完全培养基,每个浓度设3 个复孔。处理48 h 后胰酶消化,收集细胞,用预冷PBS 漂洗1 次。Binding Solution 重悬细胞,调整细胞浓度为1×106个/mL,取100 μL 细胞悬液转移至流式管中,各加入FITC-Annexin V 和PI 溶液5 μL,室温避光孵育30 min 后加Binding Solution 400 μL,流式细胞仪检测。
1.2.4 细胞免疫荧光染色
1.2.4.1 细胞免疫荧光染色检测Gefitinib 对Caco-2细胞形态的影响 取对数生长期的细胞均匀接种于置有灭菌盖玻片的12 孔板(2×104个/孔)培养。用Gefitinib 处理后,取出细胞爬片,免疫染色固定液室温固定30 min。0.1% Triton X-100 透化10 min。滴加Texas Red®-X 鬼笔环肽(1 ∶100 稀释)暗盒室温放置30 min,染色细胞骨架。用DAPI 抗荧光淬灭封片剂封片,倒置荧光显微镜下观察细胞并采集图像。
1.2.4.2 细胞免疫荧光染色检测Gefitinib 对Caco-2细胞线粒体膜电位的影响 取对数生长期的细胞均匀接种于置有灭菌盖玻片的12 孔板(2×104个/孔)培养。用Gefitinib 处理后,每孔加入1 mL 配置好的JC-1染色工作液后于细胞培养箱中37 ℃孵育20 min,用预冷的JC-1 染色缓冲液洗涤3 次。取出细胞爬片,用甘油抗荧光淬灭封片剂封片,倒置荧光显微镜下观察细胞并采集图像。
1.2.5 Western-blot 检测细胞MAPK 通路及凋亡相关蛋白表达 取对数生长期的Caco-2 细胞接种于培养皿中,细胞贴壁后,用不同浓度的Gefitinib 处理Caco-2细胞48 h 后,收集上清液和贴壁细胞,用CETi Lysis Buffer 蛋白裂解液和超声细胞破碎仪裂解提取细胞蛋白并制备蛋白样品,进行SDS-PAGE 凝胶电泳,将蛋白电转至PVDF 膜。5%脱脂奶粉封闭液孵育1 h,一抗孵育过夜,二抗室温孵育1 h。用Azure Biosystems C500 近红外成像系统图像采集并利用Image J软件分析蛋白条带灰度值,进行统计分析。
1.3 统计学处理
采用Graphpad Prism 8.0 软件进行数据分析,计量资料以±s表示,组间差异采用单因素方差分析(One-way ANOVA)及LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 Gefitinib 对Caco-2 细胞增殖的影响
不同浓度(0、2.5、7.5、15、30 μmol/L)的Gefitinib处理Caco-2 细胞24、48、72 h 后,MTS 法检测细胞增殖。结果显示,在同一时间点,Caco-2 细胞的生长抑制率随着Gefitinib 浓度的增加而升高,而且在药物浓度相同的情况下,Caco-2 细胞的生长抑制率随着处理时间的延长而升高,提示Gefitinib 对Caco-2 细胞增殖的抑制呈浓度-时间依赖性,Caco-2 细胞的生长抑制率升高,与对照组比较,差异有统计学意义(P<0.05)。见表1、图1。
表1 不同浓度Gefitinib 处理Caco-2 细胞的细胞生长抑制率(±s,n=3,%)

表1 不同浓度Gefitinib 处理Caco-2 细胞的细胞生长抑制率(±s,n=3,%)
同一时间点,与0 μmol/L 组比较:aP<0.01;与2.5 μmol/L 组比较:bP<0.01;与7.5 μmol/L 组比较:cP<0.01;与15 μmol/L组比较:dP<0.01

图1 各组Caco-2 细胞生长抑制率的变化趋势
2.2 Gefitinib 对Caco-2 细胞凋亡的作用
以不同浓度(0、2.5、7.5、15、30 μmol/L)的Gefitinib处理Caco-2 细胞48 h 后,流式细胞术检测结果显示随着Gefitinib 浓度的递增,Caco-2 细胞的晚期凋亡率(Q2)和早期凋亡率(Q3)呈递增趋势;各实验组与0 μmol/L 组相比,晚期凋亡率(Q2)、早期凋亡率(Q3)和总凋亡率(Q2+Q3)差异有统计学意义(P<0.05),且呈浓度依赖性。结果提示Gefitinib 能促进Caco-2 细胞凋亡并呈浓度依赖性。见表2、图2。
2.3 免疫荧光染色观察Gefitinib 对Caco-2 细胞凋亡的作用
以不同浓度(0、2.5、7.5、15、30μmol/L)Gefitinib 处理Caco-2 细胞48 h 后,利用鬼笔环肽对细胞染色。图3 结果显示,0μmol/L 组的细胞微丝结构分布相对均匀,相互连成网状,周围边界清晰,有少量微丝触角,细胞核椭圆形,边界清晰,染色均匀。实验组的细胞随着Gefitinib 浓度的递增,细胞骨架微丝结构分布不均匀,边缘模糊,局部可见溶解或断裂现象,细胞体积逐渐缩小,细胞浆浓缩,细胞核固缩呈均一的团块状致密物,进而断裂为大小不一的片段。以上提示Gefitinib 可诱导Caco-2 细胞核碎裂和改变骨架微丝结构及分布。
表2 Gefitinib 处理Caco-2 细胞48 h 后的Q2、Q3、Q2+Q3凋亡率 (±s,n=3,%)

表2 Gefitinib 处理Caco-2 细胞48 h 后的Q2、Q3、Q2+Q3凋亡率 (±s,n=3,%)
同一时间点,与0 μmol/L 组比较:aP<0.01;与2.5 μmol/L 组比较:bP<0.01;与7.5 μmol/L 组比较:cP<0.01;与15 μmol/L组比较:dP<0.01

图2 AnnexinV-FITC/PI 双染法检测Gefitinib 对Caco-2 细胞凋亡的影响
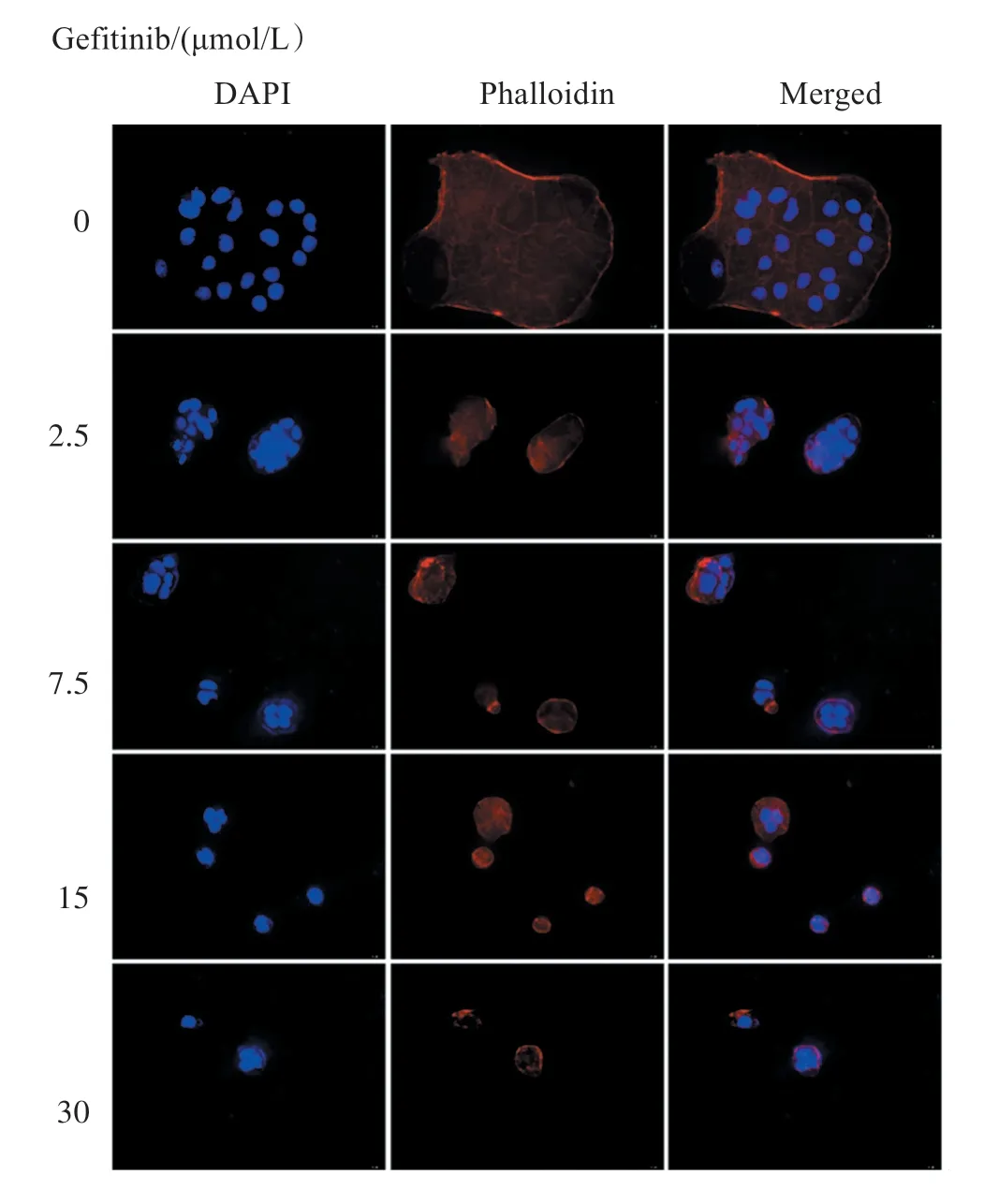
图3 免疫荧光染色观察Gefitinib 处理Caco-2 细胞核与细胞骨架微丝结构变化(×400)
2.4 免疫荧光染色观察Gefitinib 对Caco-2 细胞线粒体膜电位的影响
细胞线粒体膜电位的下降是细胞凋亡早期的标志性事件。在线粒体膜电位较高时,JC-1 聚集在线粒体的基质中,形成聚合物(aggregate),可产生红色荧光;在线粒体膜电位较低时,JC-1 不能聚集在线粒体的基质中,此时JC-1 为单体(monomer),可产生绿色荧光。以不同浓度(0、2.5、7.5、15、30 μmol/L)Gefitinib处理Caco-2 细胞48 h 后,JC-1 染色荧光显微镜下观察线粒体膜电位。图4 结果显示,实验组的细胞随着Gefitinib 浓度的递增,红色荧光逐渐减弱,绿色逐渐增强,提示Gefitinib 可通过降低Caco-2 细胞线粒体膜电位从而诱导凋亡。
2.5 Western-blot 检测细胞MAPK 通路相关蛋白表达
以不同浓度(0、2.5、7.5、15、30 μmol/L)的Gefitinib处理Caco-2 细胞48 h 后,Western-blot 检测MAPK 信号通路及凋亡相关蛋白表达。结果显示,Gefitinib 浓度依赖性显著上调p-p38、p-JNK MAPK 通路相关磷酸化蛋白和Cleaved-PARP 蛋白(89 kDa) 表达。同时随Gefitinib 浓度的增加,磷酸化p-ERK 和凋亡相关蛋白Caspase-3(35 kDa)表达量逐渐下调。见图5、6。
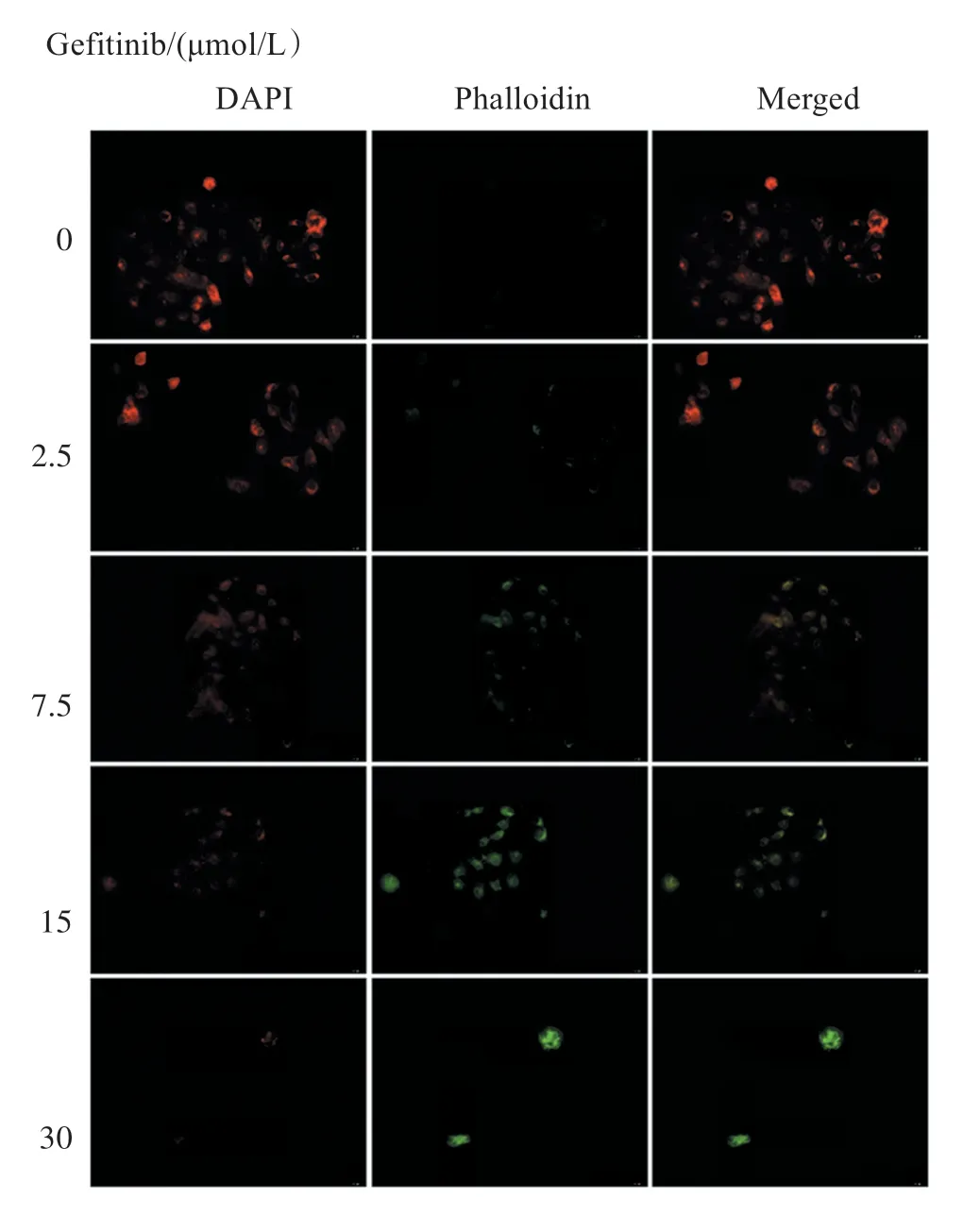
图4 免疫荧光染色观察Gefitinib 处理Caco-2 细胞后膜电位变化(×200)

图5 Gefitinib 处理Caco-2 细胞中Western-blot 检测MAPK 通路及凋亡相关蛋白表达水平
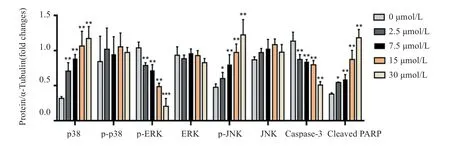
图6 Gefitinib 处理Caco-2 细胞中检测MAPK 通路及凋亡相关蛋白相对表达水平
3 讨论
直肠癌是常见的恶性肿瘤,发病率及病死率在国内外有逐年上升的趋势,目前临床治疗以根治性手术结合化疗为主,但传统的放化疗效果差,毒性不良反应明显,且细胞存在耐药性,患者5 年生存率并不理想[5]。分子靶向治疗是近年肿瘤治疗的热点领域,在对抗肿瘤方面具有较强的针对性,且对正常细胞的毒性不良反应相对较小[6]。
有研究表明EGFR 在结直肠癌等多种实体瘤中存在过表达或异常表达的情况,是目前最为主要的靶点之一[7]。Gefitinib 作为EGFR 通路抑制剂,可竞争性结合受体,抑制MAPK 活化,从而抑制肿瘤组织血管生成,并诱导肿瘤细胞凋亡[3,8]。
细胞凋亡是指为了维持内环境稳定,由基因控制细胞的自主有序的死亡,这是一个主动的过程,涉及细胞形态学变化及一系列基因的激活、表达、调控等作用[9]。MTS 以及AnnexinV-FITC/PI 双染检测细胞凋亡结果提示,在0~30 μmol/L 的浓度范围和24~72 h 的时间范围内,Gefitinib 对Caco-2 细胞增殖的抑制呈浓度-时间依赖性,并且使细胞早期和晚期凋亡率逐步升高。在细胞形态学方面,本研究的荧光双标记结果提示,随着Gefitinib 浓度的递增,细胞核固缩破裂,染色质皱缩浓集,骨架微丝溶解断裂,进一步验证Gefitinib 能促进Caco-2 细胞凋亡。
细胞信号通路是细胞凋亡的重要调控机制。由于细胞凋亡启动阶段的差异,可分为:(1)线粒体通路,受到内源性刺激使线粒体膜电位降低,释放凋亡酶激活因子激活caspase 级联反应;(2)死亡受体通路,由于外界凋亡信号启动,TNFR 及其配体介导进而激活cspase8 及随后的级联反应;(3)内质网通路,由内质网失常引起,从而破坏Ca2+平衡和蛋白合成,引起凋亡[10]。
有丝分裂原活化蛋白激酶(MAPK)是一种可被多种信号激活的丝/苏氨酸激酶,经磷酸化后可参与多种生物活性,如调节基因转录、细胞周期、诱导凋亡等[11-12]。现已发现MAPK 有p38、ERK、ERK5、JNK4个亚族,其中p38、ERK、JNK3 条通路与肿瘤细胞凋亡尤为密切。有研究发现Gefitinib 能通过JNK 通路影响Bax/Bcl-2 比例从而促进线粒体释放细胞色素c,进而诱导小细胞肺癌和前列腺癌细胞发生凋亡[13-14]。本文结果发现,不同浓度Gefitinib 处理细胞后,p-p38、p-JNK 和Cleaved-PARP 蛋白发生不同程度的浓度依赖性上调,而p-ERK 和凋亡关键蛋白Caspase-3 表达逐渐下降。此外JC-1 免疫荧光染色观察显示随着Gefitinib 浓度升高,红色/绿色荧光逐渐降低。这些结果提示Gefitinib 可能通过MAPK 通路介导线粒体膜电位减低,从而诱导人结肠癌Caco-2发生凋亡。
综上所述,本研究在细胞层面证明了Gefitinib 对Caco-2 增殖有明显抑制作用,可促进细胞凋亡。其机制可能为Gefitinib 通过调节Caco-2 细胞中p-p38、p-ERK、p-JNK 磷酸化蛋白的表达介导线粒体膜电位的降低,释放出凋亡酶激活因子激活caspase 级联反应,使Caspase-3 活化进而使PARP 蛋白在内的多种关键细胞底物发生裂解,最终诱导细胞发生凋亡。但本实验仅限于体外实验,Gefitinib 对Caco-2 细胞周期的影响,以及在动物体内的抗肿瘤活性尚不明确,相关机制还有待进一步研究。

