一次性尾静脉注射大剂量链脲佐菌素建立大鼠糖尿病性白内障模型
彭伟康,梁嘉乐,卢铭珊,陈晓佳,丁 航,马卫列,张志珍* (.广东医科大学医学技术学院;.广东医科大学基础医学院,广东东莞 53808)
糖尿病是一组以高血糖为特征的代谢性疾病。随着人们生活水平的提高、生活方式及饮食结构的改变,糖尿病的发病率和死亡率逐年上升[1]。2013 年全球有3.82 亿人患糖尿病,预计到2035 年糖尿病患病人数将增至5.92 亿[2]。中国是全球糖尿病发病率增长最快的国家之一,随着患病率的上升,糖尿病所带来的疾病负担越来越重[3]。糖尿病会伴有心血管疾病、糖尿病肾病、糖尿病白内障、糖尿病神经病等并发症,其发病率和死亡率高于无并发症的人群[4-5]。糖尿病主要通过其大血管和微血管并发症影响患者健康,其中糖尿病性白内障是其重要的并发症之一[6-7]。因此,建立稳定性好的糖尿病性白内障模型对研究糖尿病白内障的发病机制、预防和治疗有着重要意义。目前建立糖尿病性白内障模型常用的方法有注射链脲佐菌素(STZ)、注射或者口服D-半乳糖、注射四氧嘧啶等[8]。但利用一次性注射STZ 建立糖尿病性白内障模型的报道甚少,且注射大剂量STZ 伴有较高的死亡率,为此本文旨在摸索利用尾静脉注射STZ 建立一种死亡率低、成模率高、稳定性好的大鼠糖尿病性白内障模型的实验方法。
1 材料和方法
1.1.1 仪器 台式低温离心机(Beckman 公司);血糖检测仪(ONE TOUCH 公司);7180 型全自动生化分析仪(HITACHI 公司)。
1.1.2 材料 50 只雄性SPF(specific pathogen free)级Wistar 大鼠,日龄为42 d,体质量为160~180 g,由广东省医学实验动物中心提供。STZ 和戊巴比妥钠购自Sigma 公司;其他试剂为国产分析纯。0.22 μm 过滤器购自Millipore 公司;10 号灌胃针购自上海金钟医疗器械有限公司。
1.2 方法
1.2.1 动物饲养 雄性Wistar 大鼠单独房间饲养,室温24~26 ℃,湿度50%,昼夜交替时长12 h,自由进食饮水。水为高压灭菌水,饲料为SPF 级普通维持饲料(购自广东省医学实验动物中心),每3 d 更换1 次垫料。
1.2.2 糖尿病性白内障动物模型建立 50 只雄性Wistar 大鼠,适应性饲养1 周后,随机分为模型组(30只)、枸橼酸钠缓冲溶液组(10 只,简称缓冲溶液组)和正常对照组(10 只)。造模前1 d 大鼠禁食12 h,模型组腹腔注射2%戊巴比妥钠麻醉(50 mg/kg)后,以60 mg/kg 剂量一次性尾静脉注射10% STZ 溶液(STZ 溶于0.1 mol/L pH 4.5 枸橼酸钠缓冲液中,0.22 μm 滤器过滤,避光保存,现配现用);缓冲溶液组用2%戊巴比妥钠麻醉后,尾静脉注射等量0.1 mol/L pH 4.5 枸橼酸钠缓冲液。正常对照组不做任何处理,自由进食饮水,每日观察大鼠生长情况,并于1、4、8 和16 周末称量大鼠的体质量。
1.2.3 血糖测定 注射10% STZ 后,于1、4、8 和16周末分别测定不同组的空腹血糖水平。测定前1 d晚上禁食,95%乙醇消毒鼠尾后取静脉血,用血糖仪测量血糖水平。大鼠空腹血糖>11.6 mmol/L 视为糖尿病模型建立成功。继续观察,直至晶状体皮质浑浊白内障出现。
1.2.4 血脂测定 注射10% STZ 后,于16 周测定不同组大鼠的血脂4 项。测定前1 d 晚上禁食,后颈椎脱臼法处理大鼠,右心室取静脉血于5 mL 离心管,室温放置15 min,4 ℃4 000 r/min 离心10 min,分离血清,-80 ℃保存。采用全自动生化分析仪通过质控,按标准化值标定后开始测定血清甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平。
1.2.5 晶状体浑浊观察 每日观察大鼠眼睛变化,拍照并记录浑浊出现的时间。实验过程中根据晶状体出现浑浊的程度分为:晶状体完全透明/未出现浑浊(-)、浑浊出现(+)、浑浊严重(++)、完全浑浊(+++)4 个等级[8-10]。
1.3 统计学处理
采用GraphPad Prism 7.0 软件进行统计学分析,计量资料以±s表示,采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 注射STZ 前后大鼠体质量的变化
造模前(0 周)3 个组的大鼠体质量差异无统计学意义(P<0.05);造模3 d 后,模型组大鼠的精神状态变差,进食量、饮水量、尿量增多,尿液呈烂苹果味道。正常对照组和缓冲溶液组的大鼠体质量在0~16 周内持续上升,至16 周分别达487.0 和478.2 g;模型组体质量增长缓慢,从4 周开始糖尿病“三多一少”的症状逐步明显,与正常对照组和缓冲溶液组相比,4~16周各阶段的体质量比较差异有统计学意义(P<0.01)。整个造模期间,模型组有2 只大鼠于第1 周时死亡,死亡率为6.7%。造模4 周时,有6 只大鼠空腹血糖<11.6 mmol/L,从模型组剔除。见表1。

表1 注射STZ 后不同时间Wistar 大鼠体质量的比较 (g)
2.2 不同组大鼠血糖水平
正常对照组和缓冲溶液组大鼠空腹血糖均处于正常范围(<11.6 mmol/L),各阶段组间血糖差异无统计学意义(P<0.05)。造模1 周后,模型组大鼠空腹血糖逐渐升高,与造模前相比,差异有统计学意义(P<0.01)。造模16周时,模型组空腹血糖升高至25.3 mmol/L,各阶段空腹血糖与正常对照组和缓冲溶液组相比,差异有统计学意义(P<0.01)。见表2。
2.3 不同组大鼠血脂水平
造模16 周后,与正常对照组和缓冲溶液组相比,模型组大鼠的血清HDL-C 水平升高(P<0.05),而血清TG、TC 和LDL-C 水平则差异无统计学意义(P<0.05),见表3。
2.4 大鼠晶状体浑浊的变化
正常对照组和缓冲溶液组大鼠晶状体,整个造模期间一直保持澄清透明。模型组大鼠从第5 周开始晶状体逐渐出现浑浊,且晶状体浑浊非双眼同时出现。晶状体开始出现病变1 周内,浑浊情况加重,1~2 周后出现乳白色浑浊。模型组大鼠晶状体完全浑浊主要集中在实验6~9 周,晶状体浑浊变化见图1。16 周后共有15 只大鼠出现晶状体浑浊,成模率达68.2%,见表4。

表2 Wistar 大鼠不同时间的血糖水平 (mmol/L)

表3 Wistar 大鼠16 周后血脂水平 (mmol/L)
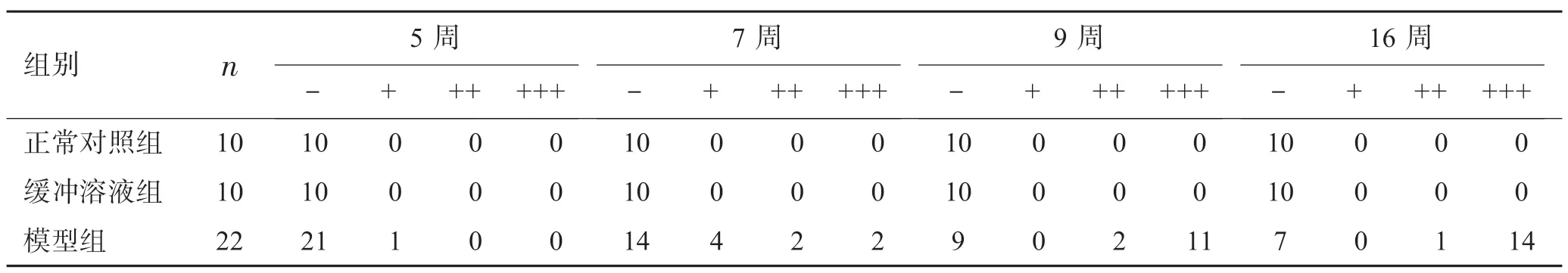
表4 Wistar 大鼠不同阶段晶状体混浊程度的发生情况
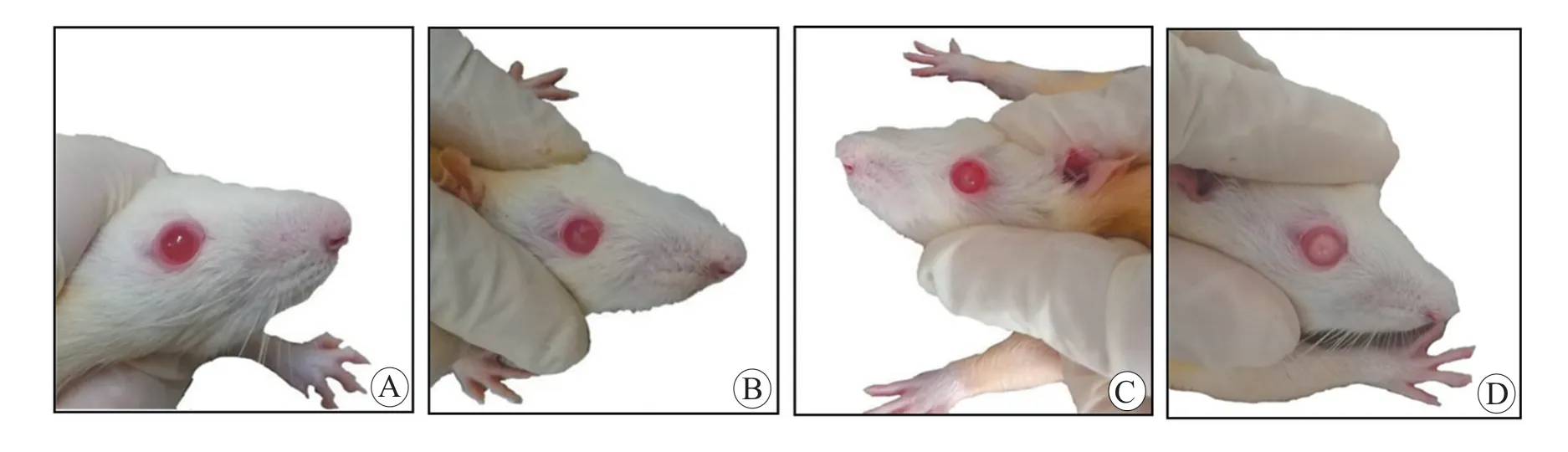
图1 Wistar 大鼠晶状体浑浊变化
3 讨论
糖尿病性白内障是糖尿病最常见的眼部并发症之一,建立糖尿病性白内障动物模型首先要建立糖尿病动物模型,使用STZ 诱导建立糖尿病动物模型被广泛应用于糖尿病和并发症的研究,该方法成模率高[8,11]。STZ 的作用机制是通过破坏胰岛β 细胞,使胰岛素分泌不足导致糖尿病,模型动物在高血糖的基础上进一步并发白内障,但是该动物模型的诱导成功率受STZ 浓度、给药途径、动物年龄、性别及体质量多方面因素的影响,尤其是高剂量的STZ 会引起动物死亡[12]。目前,全世界糖尿病发病以Ⅱ型糖尿病为主。腹腔注射STZ 操作简单、快速,是建立糖尿病模型的常用方法。已有文献报道,小剂量连续多次注射STZ 与人类Ⅰ型糖尿病相似,大剂量一次性注射与人类Ⅱ型糖尿病相似,而且一次性尾静脉注射较一次性腹腔注射成模率更高[13],但是大剂量注射STZ 一直没有一个确切规定的范围。
利用一次性注射STZ 建立糖尿病性白内障动物模型的常用方法是腹腔注射1% STZ,剂量为50 mg/kg[9-10],但注射1% STZ 建立模型,仍出现较高死亡率,可能与输液量过多、体循环血容量增加有关,此时大鼠处于麻醉状态,心率减慢,心容量负荷增加,出现心力衰竭而导致死亡[9,12]。除常用50 mg/kg STZ剂量外,还有使用腹腔注射50~65 mg/kg STZ 剂量,也有使用腹腔注射70 mg/kg STZ 及35 mg/kg STZ 剂量建立模型。综合考虑实际病情和成模率,本实验采用以60 mg/kg 剂量一次性尾静脉注射10% STZ 的方法建立糖尿病性大鼠模型。尾静脉注射10% STZ 1 周后,大鼠空腹血糖明显升高,达到17.3 mmol/L,与造模前相比差异有统计学意义(P<0.01)。造模4 周时,有6 只大鼠空腹血糖低于11.6 mmol/L,糖尿病模型成功率达80%。观察发现,大鼠血糖稳定升高4 周后,白内障病程进展较快,晶状体出现病变后1~2周,出现乳白色浑浊,晶状体完全浑浊主要集中在实验6~9 周。白内障的发病率也与实验大鼠的性别、年龄等相关,由于雌鼠的胰岛素水平比雄鼠高,有更大的胰岛素抵抗效应,为此我们选用体重160~180 g的雄性Wistar 大鼠进行实验,在糖尿病及白内障模型的建立方面耗时更短,本实验中糖尿病性白内障大鼠成模率达68.2%。
另外,模型组血脂测定发现,与正常对照组和缓冲溶液组相比,模型组大鼠的血清HDL-C 水平升高(P<0.05),而血清TG、TC 和LDL-C 水平则差异无统计学意义(P<0.05),这可能是机体存在适应性代偿机制,使得HDL-C 出现暂时性代偿性升高。
综上所述,本实验采用60 mg/kg 剂量一次性尾静脉注射10% STZ 的方法成功建立大鼠糖尿病性白内障模型。该模型具有糖尿病发病率高、死亡率低、稳定性好,且白内障发病时间较早、成模速度快等优点。后续实验中,需进一步优化STZ 的剂量,以提高糖尿病性白内障模型的成模率。

