对甲苯磺酰维达列汀抑制巨噬细胞焦亡和促进其凋亡的研究*
聂颖青,熊宝萍,刘海林,刘颖菊
(1重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室,重庆 400016;2重庆两江新区第一人民医院药剂科,重庆 401121)
炎症反应参与多种疾病的发生发展,其特征大多伴随炎症因子的释放。在机体炎症反应发生的同时,抗炎机制会同时启动以避免过度和持久的炎症反应造成机体的损伤[1-2]。其抗炎机制包括促进致炎细胞凋亡、释放抗炎细胞因子,如白细胞介素10(in⁃terleukin-10,IL-10)等。近年来有研究报道焦亡区别于细胞凋亡,可在不发生核碎裂的情况下诱导炎症反应,使细胞肿胀,释放IL-1β 和IL-18等大量炎症因子[3-4]。这意味着细胞焦亡参与炎症的发生,但其与细胞凋亡的关系还未阐明。
对甲苯磺酰维达列汀(para-toluenesulfonyl vilda⁃gliptin,PV)是金刚烷磺酰胺类化合物,分子式为C24H31N3O4S(分子量457.5),结构式见图1。本课题组已有研究结果显示,金刚烷磺酰胺类化合物可抑制脂多糖(lipopolysaccharide,LPS)刺激诱导的RAW264.7 巨噬细胞的增殖,并减少由后者产生的炎症因子[肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和IL-1β]的表达,具有显著的抗炎作用[5-6],但是,其抗炎作用机制至今未阐明,是否与影响焦亡和凋亡有关,以及其涉及的相关通路有待研究。脂多糖作为革兰氏阴性细菌细胞壁的一个组成部分不仅能引起巨噬细胞的炎性增殖,也可通过TLR4通路刺激caspase-1 活化,或直接刺激caspase-11 活化引起焦亡的发生。因此,本项工作选用LPS 刺激RAW264.7 巨噬细胞增殖,构建体外焦亡炎症模型,研究对甲苯磺酰维达列汀对焦亡和凋亡及炎症因子产生的影响[7]。通过检测炎症因子的浓度、焦亡和凋亡及相关蛋白和mRNA 表达,明确对甲苯磺酰维达列汀是否参与影响焦亡与凋亡从而产生抗炎作用。
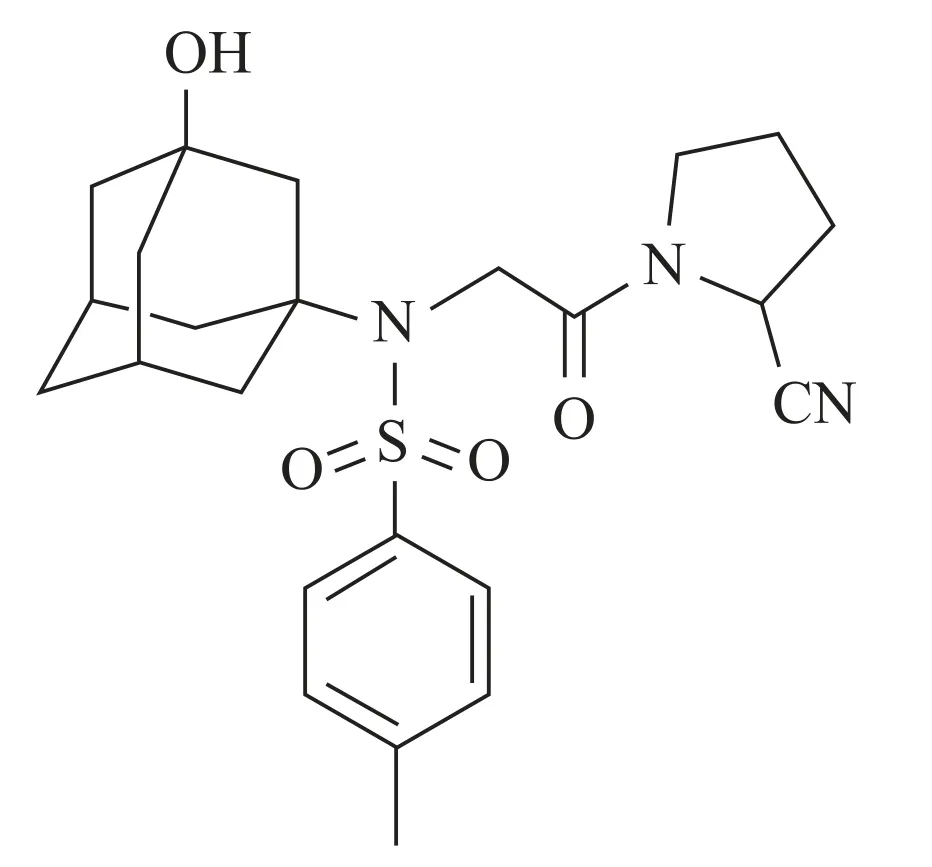
Figure 1.Chemical structure of para-toluenesulfonyl vildagliptin.图1 对甲苯磺酰维达列汀的化学结构
材料和方法
1 材料
小鼠巨噬细胞RAW264.7 由重庆医科大学药学院生化与分子药理实验室提供。对甲苯磺酰维达列汀(含量≥95.1%,由重庆医科大学药学院药化教研室提供);脂多糖购自Sigma;胎牛血清(fetal bovine serum,FBS)购自重庆赛米克生物科技有限公司;DMEM 高糖培养液购自Gibco;细胞凋亡检测试剂盒和超敏显影液购自碧云天生物技术有限公司;噻唑蓝(MTT)、二甲亚砜(DMSO)、小鼠IL-1β、TNF-α 和IL-6 酶联免疫吸附(enzyme linked immunosorbent as⁃say,ELISA)试剂盒和BCA 蛋白定量试剂盒均购自北京鼎国昌盛生物技术有限责任公司;抗caspase-1抗体、caspase-3 抗体、α-Tublin 抗体和HRP 标记山羊抗兔IgG(H+L)购自武汉三鹰生物技术有限公司;SYBR 购自南京诺唯赞生物科技有限责任公司;逆转录试剂盒和引物均购自TaKaRa。
2 方法
2.1 细胞培养及对甲苯磺酰维达列汀及LPS 的配制 RAW264.7 巨噬细胞用含10%的FBS、90%的DMEM 高糖培养液于37℃、5% CO2的细胞培养箱中培养,并取对数生长期时的细胞用于实验。对甲苯磺酰维达列汀(以下用PV 表示),用DMSO 配成可稳定保存的母液浓度为0.2 mol/L 的均匀混悬液,并用含有10%的FBS完全培养液稀释成不同终浓度的PV溶液用于实验,并且保证DMSO稀释倍数大于2 000,排除对细胞本身的影响。LPS 用PBS 配成可稳定保存的浓度为1 g/L 的均匀溶液,并用含有10%的FBS完全培养液稀释成经济有效的1 mg/L 的终浓度用于实验[8]。并选用LPS 刺激RAW264.7 巨噬细胞焦亡炎性增殖模型作为本次的试验模型。
2.2 MTT 法检测细胞活力 将细胞按照每孔1×104个接种于96 孔培养板中,并分为对照(control)组、对甲苯磺酰维达列汀阴性对照组(PVNC 组)、LPS 组、LPS+DMSO 组和不同浓度PV+LPS 组,每组设置6 个复孔。药物处理组分别加入不同浓度PV 预处理24 h,然后除PVNC 组外其余每组再加入等体积的1 mg/L 的LPS 继续培养4 h。每孔加入20 μL MTT 溶液(5 g/L),避光孵育4 h 后,弃去上清液,每孔加入150 μL的DMSO,避光振摇15 min,酶标仪上于波长490 nm处测各孔吸光度(A)值。重复以上实验3次。
2.3 流式细胞术检测细胞的凋亡 将RAW264.7细胞按照每孔1×106个接种于6 孔板中,并分为对照组、LPS 组、LPS+DMSO 组和LPS+PV 组,每组设置3个复孔。PV+LPS 组加入0.3 μmol/L PV(药物浓度根据MTT实验结果选择)预处理24 h后,每组再加入1 mg/L 的LPS 继续培养4 h,后按照Annexin V-FITC细胞凋亡检测试剂盒的操作步骤收集细胞,并在30 min内流式上机。重复以上实验3次。
2.4 ELISA 检测TNF-α、IL-1β 和IL-6 含量 将RAW264.7 细胞按照每孔1×106个接种6 孔板中,同2.3的方法分组做相同处理后,收集培养细胞的上清液,按照ELISA 试剂盒说明书操作,以IL-6 为例,加入标准品和待测样品50 μL,酶标试剂50 μL,37 ℃温育120 min 后洗板5 次,加底物显色剂A、B 各50 μL,避光15 min,加终止液50 μL,振荡10 min,15 min内在波长450 nm处测A值。重复以上实验3次。
2.5 Western blot检测细胞中caspase-3和caspase-1蛋白的表达 将RAW264.7 细胞按照每孔1×106个接种于6 孔板中,同2.3 的方法分组做相同处理后,收集细胞提取蛋白并用BCA 蛋白定量检测蛋白浓度。用SDS-PAGE 分离蛋白,转移至PVDF 膜上,5%的BCA 封闭液在室温下封闭2 h,分别孵育caspase-3(1∶1 000)抗体,caspase-1(1∶2 000)抗体,α-Tublin(1∶1 0000)抗体,4 ℃过夜。TBST洗膜3次,每次10 min,在室温下孵育相对应的Ⅱ抗50 min,TBST 洗膜3 次,每次10 min,ECL进行曝光。使用ImageJ软件分析条带灰度值。重复以上实验3次。
2.6 RT-qPCR 检测细胞中NLRP3、caspase-1、GSD⁃MD、IL-1β、IL-18、caspase-11、caspase-3 和Bax 的mRNA 的表达 将RAW264.7 细胞按照每孔1×106个接种于6 孔板中,同2.3 的方法分组做相同处理后,收集细胞,用Trizol 提取出总RNA。按照逆转录试剂盒说明书,以RNA 为模板进行反转录,得到cD⁃NA。加入表1中引物,进行扩增。扩增程序:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s;40 个循环。以β-actin为内参照基因,采用2-ΔΔCt方法,计算mRNA的相对表达量。重复以上实验3次。

表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
3 统计学处理
采用SPSS 19.0统计软件进行统计分析,数据以均数±标准差(mean±SD)表示;多组间比较采用单因素方差分析(one-way ANOVA);组间两两比较采用SNK-q检验;以P<0.05表示差异有统计学意义。使用GraphPad Prism 7.0软件作图。
结果
1 PV抑制LPS诱导的RAW264.7巨噬细胞活力
与对照组相比,RAW264.7 细胞受LPS 刺激后,LPS 组和LPS+DMSO 组细胞活力均显著升高(P<0.01),证明炎症模型造模成功。LPS 组与LPS+DMSO 组之间无显著差异(P>0.05),证明DMSO 对药物及细胞无显著影响。与对照组相比,PV(10 μmol/L)+DMSO 组细胞活力无显著差异(P>0.05),证明药物对细胞无显著毒性。与LPS+DMSO 组相比,给予PV(3、1、0.3、0.1 和0.03 μmol/L)预处理后,巨噬细胞增殖均受到显著抑制,且呈剂量依赖性地降低(P<0.01),见图2。后续实验选用有效中间浓度0.3 μmol/L作为给药浓度。
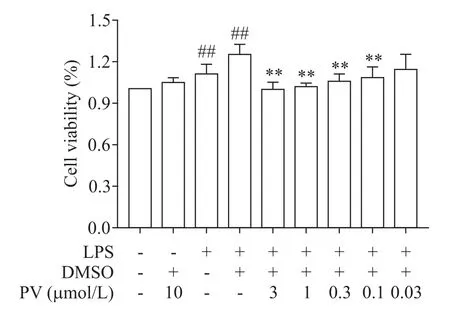
Figure 2.Effect of para-toluenesulfonyl vildagliptin(PV)on the proliferation of RAW264.7 macrophages induced by LPS.Mean±SD.n=3.##P<0.01 vs control group;**P<0.01 vs LPS+DMSO group.图2 对甲苯磺酰维达列汀对LPS诱导的RAW264.7巨噬细胞增殖的影响
2 PV促进LPS诱导的RAW264.7巨噬细胞凋亡
与对照组[(8.3±0.4)%]相比,LPS+DMSO 组细胞凋亡率[(11.1±0.3)%]提高,提示LPS刺激后巨噬细胞增殖活化同时凋亡细胞也增多(P<0.05);对甲苯磺酰维达列汀预处理后,0.3 μmol/L 药物组[(27.3±1.9)%]与LPS+DMSO 组相比促凋亡效应显著增强(P<0.01),见图3。
3 PV抑制LPS诱导的RAW264.7巨噬细胞炎症因子的产生
LPS+DMSO 组中TNF-α、IL-6 和IL-1β 与对照组中TNF-α、IL-6 和IL-1β 表达量分别比较均显著升高(P<0.01);0.3 μmol/L PV组以上各炎症因子表达量与LPS+DMSO 组相比均显著降低(P<0.01),见图4。
4 PV 对LPS 诱导RAW264.7 巨噬细胞caspase-3和caspase-1蛋白表达的影响
与对照组相比,LPS+DMSO 组caspase-1 蛋白表达显著上调,证明炎症模型造模成功;0.3 μmol/L PV 可显著抑制LPS 诱导的巨噬细胞caspase-1 蛋白表达(P<0.01),并且可显著上调caspase-3 和cleaved caspase-3 的表达(P<0.01),见图5。这表明PV 可促进巨噬细胞凋亡并抑制由LPS诱导的焦亡。
5 PV 对LPS 诱导RAW264.7 巨噬细胞NLRP3、caspase-1、GSDMD、IL-1β、IL-18、caspase-11、cas⁃pase-3和Bax的mRNA表达的影响
与对照组比较,LPS+DMSO组中焦亡相关mRNA(NLRP3、caspase-1、GSDMD、IL-1β、IL-18 和caspase-11)表达均显著升高(P<0.05);0.3 μmol/L PV 组与LPS+DMSO 组比较,以上指标均显著下调(P<0.05),且凋亡相关mRNA(caspase-3 和Bax)的表达与LPS+DMSO 组比较均显著上调(P<0.01),见图6。
讨论
炎症反应的发生涉及多条信号通路交互作用,近年来焦亡被发现在其中扮演着重要角色。细胞焦亡也是一种程序性细胞死亡,它不同于凋亡和坏死,是一种炎症性细胞死亡。细胞焦亡途径分为经典焦亡途径和非经典焦亡途径。经典焦亡途径的激活是当机体受到外来微生物感染或无菌性的损伤刺激后,可激活细胞的模式识别受体,进而与信号接收器凋亡相关微粒蛋白(apoptosis-associated speck-like protein,ASC)和pro-caspase-1 等形成炎症小体复合物,由此激活焦亡标志蛋白caspase-1。活化的cas⁃pase-1 使焦亡执行者Gasdermins(如GSDMD)被裂解为Gasdermins-N(GSDMD-N)端,与自抑制的Gasder⁃mins-C 端,同时剪切pro-IL-1β 和pro-IL-18 生成细胞因子IL-1β 和IL-18,其中GSDMD-N 端插入细胞膜中,在细胞膜定位成孔,导致胞内容物,包括炎症因子IL-1β 和IL-18外漏到胞外,细胞肿胀,质膜破碎最后细胞溶解,释放大量炎症因子,产生细胞焦亡[9-12];非经典途径则依赖于caspase-4/caspase-5/caspase-11激活。一些细胞外的细菌刺激物,如革兰阴性菌特征物内毒素(lipopolysaccharide,LPS),通过外膜囊泡(outer membrane vesicles,OMVs)内吞作用而到达胞质内,激活caspase-4/caspase-5/caspase-11(小鼠cas⁃pase-11 的人类对应物caspase-4/caspase-5),caspase-11也可剪切GSDMD 为GSDMD-N端和GSDMD-C端,从而导致细胞焦亡的发生,caspase-11 同时可激活caspase-1,使IL-1β 和IL-18 生成释放到细胞外[13-14]。细胞焦亡是机体应对外来微生物感染先天免疫的重要组成部分,在炎症反应放大和继发损伤中起着重要作用。因此深入探究焦亡与炎症的关系及其寻找药物作用的靶点具有研究价值。

Figure 3.Effect of para-toluenesulfonyl vildagliptin(PV)on apoptosis rate of RAW264.7 macrophages induced by LPS.Mean±SD.n=3.#P<0.05 vs control group;**P<0.01 vs LPS+DMSO group.图3 对甲苯磺酰维达列汀对LPS诱导的RAW264.7巨噬细胞凋亡率的影响
诱导炎症细胞凋亡是糖皮质激素类药物的重要抗炎机制。细胞凋亡是由半胱氨酸蛋白酶诱导的程序性死亡。激活的半胱氨酸蛋白酶启动凋亡后,细胞会发生DNA 片段化、核浓缩、凋亡小体形成、凋亡小体被临近细胞和巨噬细胞吞噬清除等现象。凋亡过程中细胞质膜完整,无内容物释放,不直接引起炎症反应,不影响其他细胞正常功能。在半胱氨酸蛋白酶被激活后,水解级联反应放大凋亡途径中cas⁃pase-2、caspase-8、caspase-9和caspase-10是起始凋亡蛋白酶,caspase-3、caspase-6 和caspase-7 为效应凋亡蛋白酶[15-16]。

Figure 4.Effect of concentration of TNF-α,IL-6 and IL-1β in supernatant of RAW264.7 macrophages induced by LPS after treated with para-toluenesulfonyl vildagliptin(PV).A:TNF-α;B:IL-6;C:IL-1β.Mean±SD. n=3.#P<0.05,##P<0.01 vs con⁃trol group;**P<0.01 vs LPS+DMSO group.图4 对甲苯磺酰维达列汀对LPS诱导的RAW264.7巨噬细胞培养液中TNF-α、IL-6和IL-1β浓度的影响
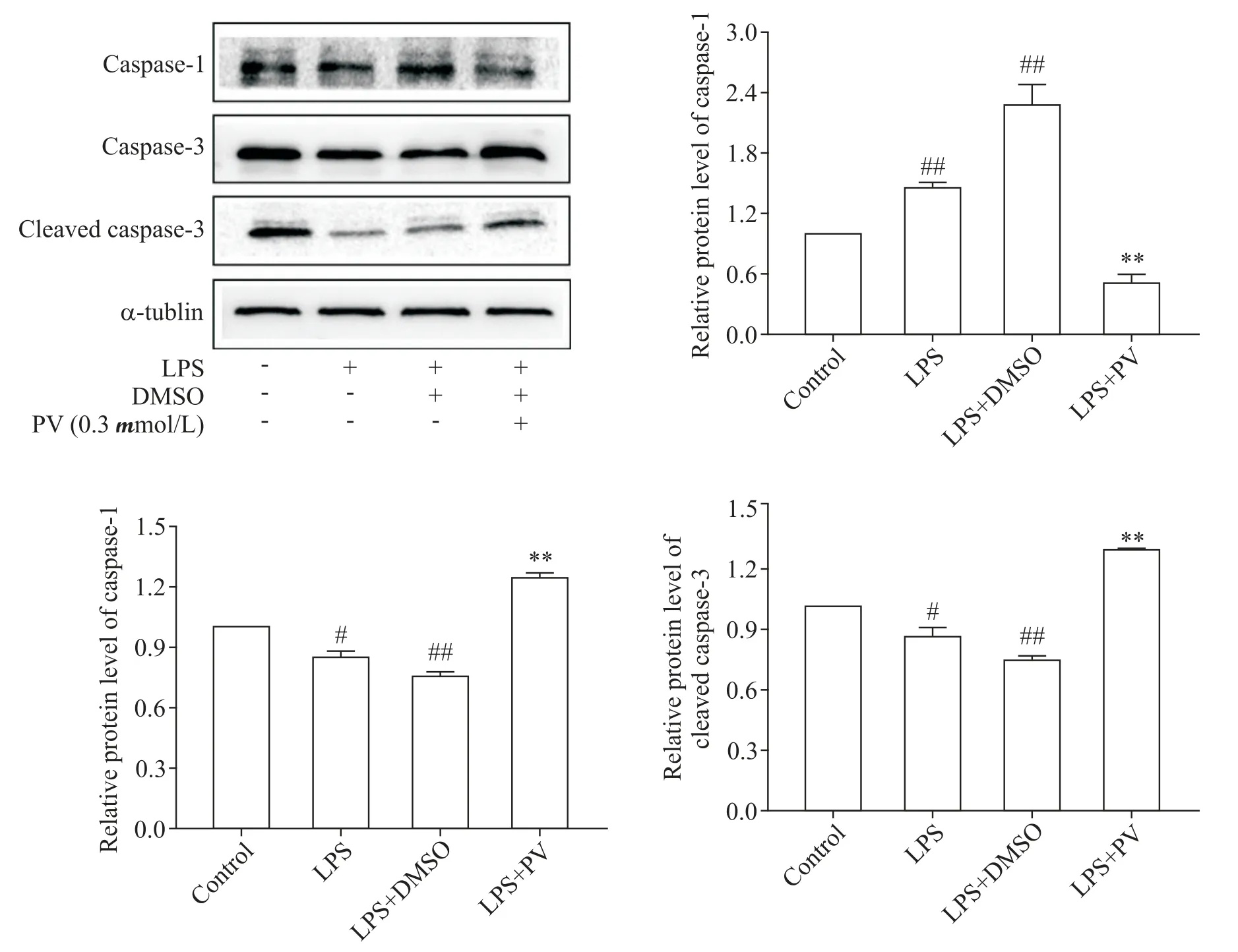
Figure 5.Protein expression of caspase-1,caspase-3 and cleaved caspase-3 of RAW264.7 macrophages induced by LPS after treated with para-toluenesulfonyl vildagliptin(PV).A:caspase-1 protein;B:caspase-3 protein;C:cleaved caspase-3 protein.Mean±SD. n=3.#P<0.05,##P<0.01 vs control group;**P<0.01 vs LPS+DMSO group.图5 对甲苯磺酰维达列汀对LPS诱导RAW264.7巨噬细胞表达caspase-1、caspase-3和cleaved caspase-3蛋白的影响

Figure 6.Effect of expression of NLRP3,caspase-11,IL-1β,IL-18,caspase-11,GSDMD,caspase-3 and Bax in RAW264.7 mac⁃rophages induced by LPS after treated with para-toluenesulfonyl vildagliptin(PV).A:NLRP3 mRNA;B:caspase-1 mRNA;C:GSDMD mRNA;D:IL-1β mRNA;E:IL-18 mRNA;F:caspase-11 mRNA;G:caspase-3 mRNA;H:Bax mRNA.Mean±SD. n=3.#P<0.05,##P<0.01 vs control group;**P<0.01 vs LPS+DMSO group.图6 对甲苯磺酰维达列汀对LPS 诱导RAW264.7 巨噬细胞表达NLRP3、caspase-1、IL-1β、IL-18、caspase-11、GSDMD、cas⁃pase-3和Bax mRNA的影响
因此为了解PV 对焦亡和凋亡的影响,本实验首先建立了LPS 刺激巨噬细胞的炎症模型。LPS 可被位于质膜上的模式识别受体TLR4识别,从而转录激活NF-κB,使NLRP3(Nod-like receptors)转录增加,进而与ASC 和pro-caspase-1 形成NLRP3 炎症小体复合物,从而启动焦亡。LPS 也通过非经典途径启动焦亡。实验结果显示,LPS刺激可引起RAW264.7巨噬细胞炎性增殖(图2)及炎性因子(IL-1β、IL-6 和TNFα)的释放(图4),并引起caspase-1 的表达增加(图5),同时焦亡通路中NLRP3、caspase-1、GSDMD、cas⁃pase-11、IL-1β 和IL-18 等mRNA 的表达均显著增高(图6A、B、C、D、E、F),证实LPS 作用于巨噬细胞,可通过经典和非经典途径引起巨噬细胞焦亡和炎症因子释放,此结果与已有的报道是一致的[17]。也说明细胞炎症模型建立成功。同时检测LPS 刺激后凋亡及相关蛋白表达显示LPS 刺激后RAW264.7 巨噬细胞表达凋亡相关蛋白caspase-3 和Bax 的mRNA 表达显著降低(图5B、C、G、H),说明LPS刺激主要引起巨噬细胞焦亡,而不是凋亡。进一步,本实验检测了PV 对焦亡和凋亡的影响,实验结果显示PV 可抑制LPS 刺激引起的RAW264.7 巨噬细胞的炎性增殖及炎症因子(IL-1β、IL-6 和TNF-α)的释放,下调LPS 刺激的caspase-1 的表达以及焦亡通路中NLRP3、cas⁃pase-1、GSDMD、caspase-11、IL-1β 和IL-18 等mRNA的表达,说明PV 对焦亡激活的经典通路和非经典通路均有抑制作用,可抑制焦亡的发生及炎症因子的释放。前期研究中显示的金刚烷磺酰胺类化合物对TLR4-NF-κB 通路具有抑制作用[6-7]支持此结果。这可能是PV 产生抗炎作用的机制之一。通过流式细胞术检测药物对凋亡的影响,结果则显示PV 可促进LPS 诱导后巨噬细胞的凋亡(图3),结合其上调凋亡执行蛋白caspase-3 的表达(图5)、以及caspase-3 和BaxmRNA 的表达(图6G、H),说明PVB 可促进LPS刺激后巨噬细胞凋亡。综合以上结果可认为PV 抑制LPS 刺激后巨噬细胞焦亡,促进其凋亡,从而产生抗炎作用。
研究显示有关焦亡和凋亡的关系较为复杂,至今尚不清楚。有研究报道,凋亡通路启动后caspase-3 的激活,促进细胞焦亡的发生[18]。而Caspase-1 可激活caspase-7使嗜肺军团菌感染的巨噬细胞出现早期凋亡[19],NLRP3 炎症小体对细胞凋亡和焦亡都有激活作用[20]。化疗药物可通过caspase-3-GSDME 通路诱导肿瘤细胞焦亡的发生[21]。Caspase-3 可剪切DFNA5 为具有成孔活性的DFNA5-N 引起细胞焦亡;高表达DFNA5 的细胞出现细胞焦亡,而低表达DF⁃NA5 的细胞则出现细胞凋亡[22]。在敲除了GSDMD的单核细胞中,LPS与尼日利亚菌素诱导细胞发生凋亡[23]。研究还发现GSDME-N 促进caspase-3激活,放大内部细胞凋亡的信号通路,并启动自放大的正前馈回路;GSDMD-N 也显示促进caspase-3 激活[24]。本实验结果则显示LPS 刺激后巨噬细胞出现焦亡,而PV 则能抑制LPS 刺激后巨噬细胞的焦亡,促进其凋亡,并使炎症因子释放减少。因此可认为细胞焦亡和凋亡是相互调节转化的,GSDMD/E 在相互转化中起着重要作用。当炎症发生时,炎症细胞的焦亡促进和放大炎症反应,而促进炎症细胞凋亡作为抗炎机制也被启动,使焦亡被抑制,从而维持机体内环境稳定。由此推测PV 可通过抑制LPS 刺激后巨噬细胞焦亡,从而使GSDMD 表达减少,促进细胞走向凋亡,使炎症因子产生和释放减少。但PV 通过什么环节产生以上作用、是通过影响焦亡诱导凋亡还是直接诱导凋亡,其主要的作用靶点是什么尚需要进一步的研究。
综上所述,PV 作为不同于传统抗炎药结构的一种金刚烷磺酰胺类药物,可抑制巨噬细胞的炎症增殖及炎症因子的释放,具有抗炎作用。抗炎作用机制可能与抑制细胞焦亡和促进炎症细胞凋亡的发生有关。
(致谢:本研究所涉及的实验在重庆医科大学药学院生物化学与分子药理学重点实验室完成,特此致谢!)
- 中国病理生理杂志的其它文章
- miR-23b通过靶基因Cxcl12调控肾性高血压*
- 基于冷冻电子显微术的阳离子通道结构与功能研究进展*
- 淫羊藿苷通过抑制内质网应激减轻异丙肾上腺素诱导的H9c2细胞肥大损伤*
- 机械敏感性离子通道Piezo1参与慢性避水应激肠易激综合征大鼠内脏高敏感性和5-羟色胺代谢异常*
- 肠道ChREBP缺陷导致小鼠对果糖不耐受*
- Spheroid transplantable and functional retinal pigment epithelium derived from non-colony dissociated human induced pluripotent stem cells*

