NSUN2通过靶基因PRPS2调控核苷酸代谢从而介导肝癌细胞的增殖*
黄奕芝,杨紫青,温炜杰,唐 勤,方乐堃,李孟鸿
(中山大学附属第六医院胃肠病学研究所,广东广州 510655)
肝癌是全球常见的消化系统恶性肿瘤之一,中国是占全球肝癌发病率和死亡率最高的国家,分别为46.6%和47.1%,发病率和死亡率占我国恶性肿瘤前5 位[1]。我国肝癌5 年生存率仅为12.1%[2]。RNA 甲基化修饰是目前的研究热点,大量研究证明RNA m6A 甲基化与肝癌发生发展密切相关,而关于RNA m5C 甲基化与肝癌的关系研究较少[3]。NOP2/Sun RNA 甲基转移酶家族成员2(NOP2/Sun RNA methyltransferase 2,NSUN2)编码的蛋白是一种m5C RNA甲基转移酶,与食管癌、头颈癌、乳腺癌、胃癌和膀胱癌等肿瘤[4]的发生发展密切相关,而其在肝癌中功能及作用机制研究鲜少报道。本研究通过分析TCGA 数据库结果并结合在肝癌细胞系中进行的实验,探讨NSUN2 在肝癌增殖中的作用,并探索其机制。明确NSUN2 在肝癌中的功能及作用机制将丰富肝癌发生发展的机制,为肝癌治疗提供新的治疗靶点。
材料和方法
1 临床样品
肝癌患者肿瘤样本来源于中山大学附属肿瘤医院。所有样本采集均获得患者的知情同意并获得研究中心机构审查委员会的同意。
2 细胞
人来源的肝癌细胞系Huh7 和SNU182 来源于ATCC。Huh7 细胞培养在含10%胎牛血清的DMEM培养基中,SNU182 细胞培养在含10%胎牛血清的RPMI-1640 培养基中,放置于37℃、5%CO2的细胞培养箱中。
3 主要试剂
DMEM 培养基、RPMI-1640 培养基和胰酶(Corn⁃ing);胎牛血清(GIBCO);Trizol(Ambion);逆转录试剂盒(TOYOBO);2×SYBR Green 和蛋白酶抑制剂和磷酸酶抑制剂混合物(Bimake);细胞裂解液(碧云天生物技术有限公司);BCA 蛋白定量试剂盒(贝博);5×SDS 上样缓冲液(鼎国昌盛);抗NSUN2 抗体(Pro⁃teintech);抗PRPS2 抗体(Santa Cruz);抗actin 抗体(Sigma);抗β-vinculin 抗体(Cell Signaling Technolo⁃gy)。
4 主要方法
4.1 TCGA 数据分析 从TCGA 中收集到374 例肝癌患者肝癌组织及50 例癌旁肝组织的基因表达测序数据集,该数据集使用转录组测序技术(Illumina HiSeq)进行RNA 水平测定。从数据集中提取374 例肝癌患者肝癌组织及50 例癌旁组织NSUN2基因的相对表达量FPKM(fragments per kilobase per million)值,用t检验方法比较正常组织与肝癌组织的NSUN2表达水平。
4.2 稳定敲低NSUN2肝癌细胞系的构建及细胞增殖实验 使用HEK293T 细胞包装shNSUN2 的慢病毒及对照组shRNA scramble 慢病毒,并用其感染Huh7 和SNU182 肝癌细胞,感染48 h 后传代,并用嘌呤霉素筛选细胞,产生稳定敲低NSUN2的肝癌细胞系。用Western blot 实验检测敲低效率后,将对照组细胞和稳定敲低NSUN2组细胞计数并铺板,放置在IncuCyte 系统中实时检测细胞生长,96 h 后用Graph⁃Pad Prism 软件统计并作图。集落形成实验中,计数后的细胞以每孔1 000 个铺在6 孔板中,集落形成后用结晶紫染色并统计集落形成数。
4.3 RT-qPCR 实验 用Trizol 法提取细胞总RNA,测量RNA 浓度并调齐浓度后再逆转录,逆转录后的cDNA 用于进行实时荧光定量实验,每个样品设置3个复孔,实验结果用β-actin作为内参照,采用2-ΔΔCT进行结果分析。引物序列见表1。
4.4 Western blot 实验 吸去细胞培养基并用PBS洗一次细胞后,加入含蛋白酶抑制剂和磷酸酶抑制剂混合物的细胞裂解液,并用超声破碎仪裂解细胞,并将细胞置于冰上裂解30 min 后离心10 min,取上清进行蛋白定量,调齐蛋白量后加入上样缓冲液,煮沸5 min 使蛋白变性。用SDS-PAGE 分离蛋白,并将蛋白转移到PVDF 膜上,用含5%脱脂牛奶的封闭液封闭1 h 后用Ⅰ抗4℃孵育过夜,回收Ⅰ抗,TBST 洗3次后用Ⅱ抗常温孵育1 h,TBST 洗3 次后进行ECL显色。

表1 RT-qPCR引物序列Table 1.Sequences of the primers for RT-qPCR
5 统计学处理
采用IBM SPSS Statistics 25.0 进行统计学分析,数据以均数±标准差(mean±SD)表示。采用Graph⁃Pad Prism 软件作图。两独立样本均值比较采用t检验;细胞增殖曲线间的比较采用双因素方差分析;NSUN2 与PRPS2 间的相关性采用Pearson 相关性分析。以P<0.05为差异有统计学意义。
结果
1 NSUN2在肝癌组织中高表达
为了研究NSUN2 在肝癌中的表达情况,我们首先比较了肿瘤基因组图谱(TCGA)数据库肝癌mRNA 测序数据集中NSUN2 的表达,发现NSUN2 在374 例肝癌患者肝癌组织中的mRNA 表达水平显著高于50例正常肝组织(P<0.05),见图1A,除此之外,Western blot 实验结果显示,在9 例肝癌患者肝癌及癌旁组织样品中,有6 例肝癌患者肝癌组织的NSUN2 蛋白表达水平高于癌旁组织,见图1B。从GEPIA(Gene Expression Profiling Interactive Analy⁃sis)官网获得TCGA 肝癌数据集生存分析结果,NSUN2 高表达具有较差的生存预后,差异具有统计学意义(P=0.023),见图1C。

Figure 1.NSUN2 was over-expressed in liver cancer.A:NSUN2 mRNA was over-expressed in liver cancer tumor tissues as com⁃pared with normal tissues from TCGA database;B:NSUN2 was over-expressed in liver cancer tumor tissues compared to adjacent normal tissues at protein level from a liver cancer patient cohort;C:Kaplan-Meier analysis indicated that high mRNA expression of NSUN2 was correlated with poor overall survival in liver cancer patients from TCGA database.The P value was determined by log-rank test.Mean±SD.*P<0.05 vs normal group.图1 NSUN2在肝癌中高表达
2 敲低NSUN2抑制肝癌细胞生长
使用Incucyte 活细胞动态成像与分析系统记录Huh7细胞和SNU182细胞稳定敲低NSUN2肝癌细胞系的生长,结果显示敲低NSUN2显著抑制Huh7细胞和SNU182 细胞的生长(P<0.05),见图2B。集落形成实验结果显示,在Huh7 细胞和SNU182 细胞中敲低NSUN2后,细胞的集落形成能力与对照组相比受到显著抑制(P<0.05),见图2C。

Figure 2.Knock-down of NSUN2 inhibited proliferation in Huh7 cells and SNU182 cells.A:after infection of Huh7 cells and SNU182 cells with shRNA scramble,shNSUN2 #5,shNSUN2 #1,Western blot was used to detect knock-down efficiency of NSUN2;B:the proliferation of Huh7 cells and SNU182 cells were determined by Incucyte System(n=16);C:colony formation assay in Huh7 cells and SNU182 cells(n=3).Mean±SD.*P<0.05 vs shRNA scramble group.图2 敲低NSUN2抑制Huh7和SNU182细胞的增殖
3 GESA分析结果
为了研究NSUN2 通过影响何种信号通路影响肝癌发生发展,我们对TCGA 肝癌数据集进行基因富集分析(GSEA)。在NSUN2 高表达组富集的信号通路中,嘌呤代谢和嘧啶代谢的NES(归一化后的富集分数)排名位于前6,可见NSUN2 可能通过影响嘌呤和嘧啶代谢通路影响肝癌发生发展。见图3。

Figure 3.NSUN2 may coordinate nucleotide metabolism.A:top 10 KEGG pathways enriched in the tissues with high expression of NSUN2;B:GSEA of KEGG pathway showed that the genes up regulated in the tissues with high expression of NSUN2 were enriched in the purine and pyrimidine metabolism pathways.图3 NSUN2可能调节核苷酸代谢
4 NSUN2通过PRPS2调节嘌呤代谢
由于NSUN2已被证实可通过m5C甲基化mRNA的方式稳定mRNA,因此NSUN2 可能通过甲基化嘌呤和嘧啶代谢中某些基因的mRNA,从而参与嘌呤和嘧啶代谢的过程。为了找出NSUN2可能甲基化并且参与核苷酸代谢的基因,我们通过交叉Sun[5]研究中的重亚硫酸盐测序(Bisulfite-Seq)结果和基因富集分析中嘌呤和嘧啶代谢通路的差异表达基因,筛选出PRPS2、ADSL、POLR2D、CANT1、ENTPD4、TXNRD1和CAD这7 个候选基因。TCGA 数据集中NSUN2 与PRPS2 的mRNA 表达呈正相关(r=0.3283,P<0.05)。在SNU182细胞中敲低NSUN2后,RT-qPCR结果显示PRPS2 的mRNA 表达量显著下降,Western blot 结果显示PRPS2 的蛋白表达量下降。同时,RT-qPCR 结果显示shNSUN2 组与对照组相比,嘌呤从头合成的其它关键酶的mRNA表达量也下降了。见图4。
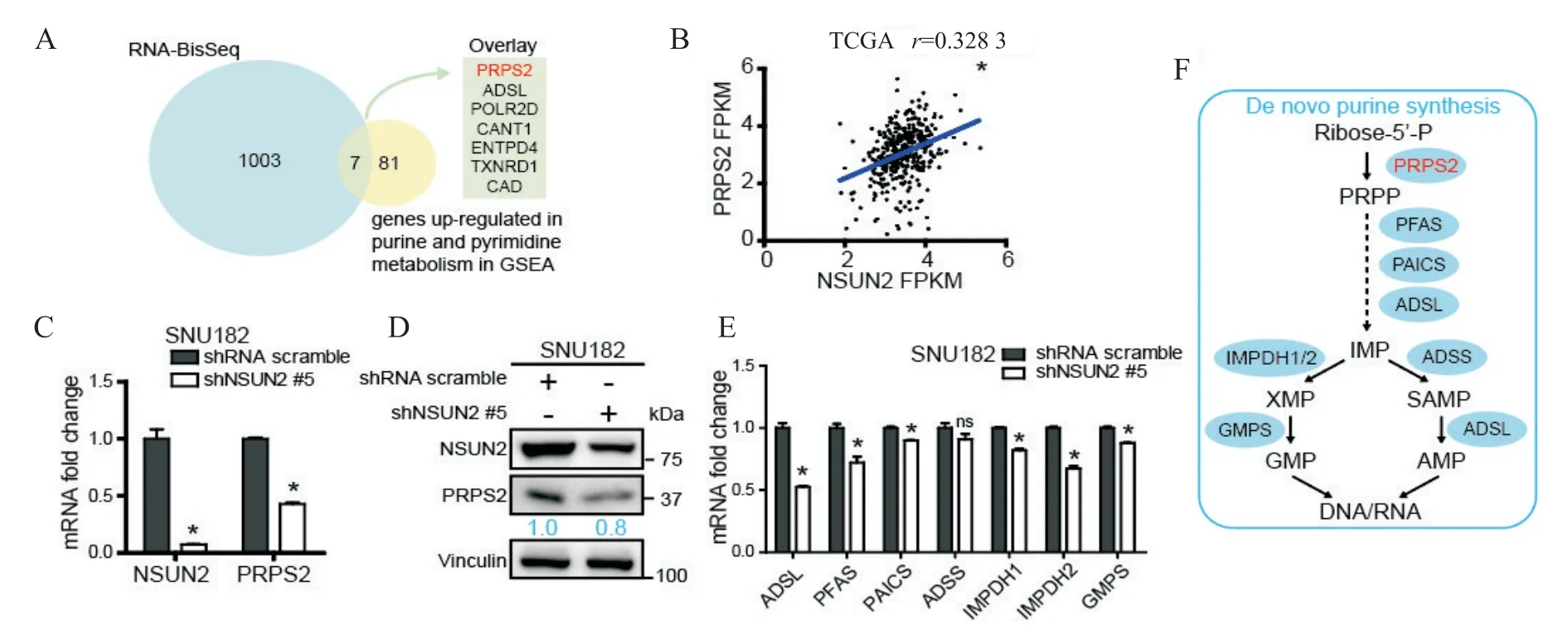
Figure 4.NSUN2 regulated PRPS2 to get involved in de novo purine synthesis process.A:overlay of RNA bisulfite sequencing(RNA-BisSeq)data and GSEA data(RNA-BisSeq data:m5C modified mRNA in WT HEK293 cells but not in NSUN2-/-HEK293 cells;GSEA data:differentially expressed genes in purine and pyrimidine metabolism pathways);B:scatter plot showed the correlation of NSUN2 and PRPS2 mRNA expression in 424 tissue samples from TCGA database(the blue line means the regression line;Spearman correlation coefficient was 0.328 3);C:relative mRNA levels of NSUN2,PRPS2(normalized to actin)determined by RT-qPCR;D:the protein levels of NSUN2 and PRPS2(normalized to vinculin)deter⁃mined by Western blot;E:relative mRNA levels of de novo purine synthesis related genes(normalized to actin)deter⁃mined by RT-qPCR;F:schematic diagram of de novo purine synthesis process.Mean±SD. n=3.*P<0.05 vs shRNA scramble group图4 NSUN2通过调控PRPS2参与嘌呤从头合成过程
讨论
NSUN2 编码的蛋白是一种RNA 甲基转移酶。Xu 等[6]发现,NSUN2 通过甲基化ATX 的mRNA 促进胶质瘤细胞转移。NSUN2 与RPL6 蛋白相结合促进胆囊癌的肿瘤进展[7]。NSUN2 通过稳定mRNA 促进膀胱癌的发病[8]。Sun 等[9]研究表明NSUN2 介导的H19 lncRNA 的m5C 修饰异常与肝细胞癌的不良分化有关。综上,NSUN2参与多种肿瘤的发生发展,在肝癌细胞中也可能扮演重要角色。而本研究根据TCGA 数据分析、临床肝癌患者组织的Western blot实验均表明了NSUN2 在肝癌中高表达,并且生存分析结果证明NSUN2 与肝癌不良预后相关,同时,肝癌细胞实验结果显示敲低NSUN2抑制肝癌细胞的增殖,这些结果均提示NSUN2 在肝癌发生发展中的重要作用。
最早的研究认为NSUN2 是tRNA 甲基转移酶,近年来的研究证实NSUN2还能甲基化rRNA、一些小分子RNA 和长链非编码RNA[4]。而越来越多的研究认为NSUN2 是能在mRNA 上进行m5C 甲基化的非常重要的甲基转移酶,Huang 等[10]开发了新颖的生物信息学计算方法,提供了NSUN2 对mRNA 的m5C修饰令人信服的证据。并且,NSUN2 在mRNA 上的甲基化能调控基因的表达,在癌症发生发展中具有关键作用。Chen 等[8]采用目前最准确可靠的重亚硫酸盐测序(Bisulfite-Seq)技术绘制了膀胱癌组织mRNA 上的m5C 单位点图谱,发现了癌症通路相关基因的mRNA 趋向于高甲基化修饰,同时在膀胱癌中高表达。并且,该团队结合Bisulfite-Seq 和RNASeq,证明了NSUN2 以m5C 依赖的方式促进HDGF mRNA 的稳定性并促进膀胱癌的增殖和转移。本研究通过对肝癌TCGA 数据集的基因富集分析,在高表达NSUN2 的肝癌组织中富集出嘌呤和嘧啶代谢通路,因此我们推测在肝癌中,NSUN2可能通过甲基化嘌呤和嘧啶代谢通路中某些基因的mRNA,促进mRNA 稳定性从而增强蛋白表达,促进核苷酸代谢,进而促进肝癌发生发展。为了找出NSUN2 甲基化嘌呤和嘧啶代谢中的哪些基因,本研究将GSEA结果中嘌呤和嘧啶代谢通路在高表达NSUN2 组织中富集的基因与Sun 等[5]等的研究中的重亚硫酸盐测序结果进行了交叉,得出了PRPS2、ADSL、POLR2D、CANT1、ENTPD4、TXNRD1和CAD这7 个候选基因,其中PRPS2、ADSL、POLR2D、CANT1和ENTPD4参与嘌呤代谢信号通路,POLR2D、CANT1、ENTPD4、TXNRD1和CAD参与嘧啶代谢信号通路。
这7 个候选基因中,磷酸核糖焦磷酸合成酶2(phosphoribosyl pyrophosphate synthetase 2,PRPS2)是核苷酸生物代谢途径中的一种关键限速酶[11],它催化核苷酸合成的第一个限速反应,通过将ATP 上的β,γ-二磷酸基团转移到(磷酸戊糖途径中产生的核糖-5’-磷酸(R5P)的C1-羟基上,把R5P 活化生成磷酸核糖焦磷酸(PRPP),PRPP 再用于合成嘌呤和嘧啶核苷酸[12]。已有文献报道PRPS2 在促进乳腺癌干性与转移[13],前列腺癌细胞周期[14],结直肠癌转移[15]等肿瘤进展过程具有重要作用。本研究在SNU182 细胞中敲低NSUN2 后,发现PRPS2 基因的mRNA 和蛋白表达均降低,说明NSUN2 可能通过甲基化PRPS2 的mRNA,稳定mRNA,从而稳定PRPS2的表达,参与到核苷酸代谢通路中。Lv 等[13]发现敲低PRPS2后,会导致其它嘌呤和嘧啶从头合成途径中的其他关键酶的表达下降,该研究提出PRPS2 可能与这些酶协同调节整个从头合成的过程。为了进一步确认NSUN2 调控PRPS2 进而调控核苷酸代谢通路,我们同时检测了敲低NSUN2 后,SNU182 细胞中其它几个与嘌呤从头合成关键酶[16]的表达,发现ADSL、PFAS、PAICS、IMPDH1/2 和GMPS 的表达均降低,其中腺苷琥珀酸裂合酶(adenylosuccinate lyase,ADSL)也是我们筛选出的7个候选基因中的一个,它催化嘌呤从头合成途径中SAICAR 到AICAR 及SAMP到AMP两个步骤。
综上所述,NSUN2通过甲基化PRPS2和ADSL等基因的mRNA,稳定其表达,参与调控核苷酸代谢通路,促进肝癌增殖的发生发展。然而,本研究中NSUN2对PRPS2 mRNA 的甲基化,是通过Sun等[5]等在HEK293 中进行重亚硫酸盐测序的结果猜测的,要确认肝癌细胞中NSUN2 甲基化PRPS2,还需要对肝癌细胞进行重亚硫酸盐测序或进行m5C IP 实验,给出更直接可靠的证据。除此以外,NSUN2 调控核苷酸代谢通路还可以采用同位素示踪实验更进一步确认。NSUN2对肝癌发生发展的调节还有待深入研究,完善其机制将对临床上肝癌治疗有重要意义。
- 中国病理生理杂志的其它文章
- miR-23b通过靶基因Cxcl12调控肾性高血压*
- 基于冷冻电子显微术的阳离子通道结构与功能研究进展*
- 淫羊藿苷通过抑制内质网应激减轻异丙肾上腺素诱导的H9c2细胞肥大损伤*
- 机械敏感性离子通道Piezo1参与慢性避水应激肠易激综合征大鼠内脏高敏感性和5-羟色胺代谢异常*
- 肠道ChREBP缺陷导致小鼠对果糖不耐受*
- Spheroid transplantable and functional retinal pigment epithelium derived from non-colony dissociated human induced pluripotent stem cells*

