基于脂肪棕色化探究大黄素对老龄小鼠脂质代谢的影响
宁一博,程龙,黄芷棋,贺润铖,孙建宁,董世芬(北京中医药大学中药学院中药药理系,北京 102488)
全球老龄化已成为不可逆转的趋势,预计2050年我国老龄人口数将达到5.25 亿,占总人口数的32%,肥胖症、高血压、动脉粥样硬化、2 型糖尿病等代谢性疾病的发生率随之增加,老龄化及相关疾病的研究成为热点[1]。研究显示,机体代谢能力随年龄增加有降低趋势,有害脂质易产生沉积[2]。
目前发现哺乳动物体内存在3 种脂肪组织,分别为白色脂肪组织(WAT)、棕色脂肪组织(BAT)和米色脂肪组织。WAT 根据分布位置的不同又分为皮下WAT 和内脏WAT 等[3]。WAT 是储能器官,主要由白色脂肪细胞构成,可将体内多余的能量以三酰甘油(TG)的形式储存,而BAT 主要参与体温调节和能量代谢,通过加快脂肪氧化来促进机体能量消耗[4]。米色脂肪组织通常存在于WAT 当中,但具有与棕色脂肪细胞类似的形态和功能[5]。脂肪组织不仅是储能器官同时也是一种活跃的内分泌器官,可分泌瘦素(LEP)、脂联素(ADPN)、抵抗素等脂肪因子,并参与全身能量代谢、脂质代谢[6]。衰老过程中脂肪组织发生重塑,白色脂肪堆积,褐变能力降低,并产生胰岛素抵抗[7]。脂肪组织特异性功能障碍可诱发老年机体能量稳态失衡,并加剧衰老以及相关疾病如动脉粥样硬化、高血压、糖尿病等的进程[8-9]。
大黄素(emodin)是一种蒽醌类衍生物,是中药大黄等的主要活性成分,具有抗炎、抗氧化、降血糖、降血脂和免疫抑制等作用[10],对结肠癌[11]、子宫内膜癌[12]、肝癌[13]等多种恶性肿瘤具有抑制作用。大黄素可降低高脂饮食小鼠体质量,降低血脂、肝脏胆固醇和三酰甘油(TG)水平[14];体外研究显示,大黄素可抑制3T3-L1 前脂肪细胞增殖及分化,减少脂质蓄积[15]。本研究基于脂肪棕色化探究大黄素对老龄小鼠脂质代谢的影响。
1 材料
1.1 实验动物
40 只10月龄SPF 级C57BL/6J 小鼠,雌雄各半,体质量(30±2)g [北京华阜康生物技术有限公司,SCXK(京)2014-0004]。10 只8 周龄SPF级C57BL/6J 小鼠,雌雄各半,体质量(20±2)g[斯贝福(北京)生物技术有限公司,SCXK(京)2016-0002]。所有小鼠饲养于北京中医药大学屏障环境动物实验室[许可证号SYXK(京)2016-0038,且均通过北京中医药大学医学与实验动物伦理委员会审批]。
1.2 试药
大黄素(批号:T02S8F42983)、罗格列酮(批号:Y05F9C54480)(上海源叶生物科技有限公司);总胆固醇(TC)、TG、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)试剂盒(南京建成生物工程研究所);ADPN、LEP 的ELISA 试剂盒(武汉云克隆科技股份有限公司);游离脂肪酸(FFA)ELISA 试剂盒(江苏科特生物技术有限公司,批号:201812);解偶联蛋白-1(UCP1)一 抗(英国Abcam 公司,批号:GR3188478-6);HRP 山羊抗兔(批号:GB23303)、柠檬酸抗原修复液(批号:G1202)、苏木素染液(批号:G1004)、DAB 显色液(批号:G1211)、苏木素分化液(批号:G1039)(武汉塞维尔生物科技有限公司);苏木素-伊红染液(武汉谷歌生物科技,批号:G1005)。
1.3 仪器
JB-L5 冷冻台、JB-P5 包埋机、JJ-12J 脱水机(武汉俊杰电子有限公司);RM2016 病理切片机(上海徕卡仪器有限公司);S/N601-0723 全波长酶标仪(江苏万科科教仪器有限公司);DHG-9140A烤箱(上海慧泰仪器制造有限公司);NIKON ECLIPSE CI 显微镜(日本尼康公司)。
2 方法
2.1 实验动物分组、造模及给药
40 只10月龄SPF 级雌雄各半C57BL/6J 小鼠普通饲料喂养8 周后,将其随机分为老龄组、大黄素40 mg·kg-1组、大黄素80 mg·kg-1组和罗格列酮10 mg·kg-1组,每组10 只。另设10 只雌雄各半8周龄SPF 级C57BL/6J 小鼠为非老龄组。老龄组和非老龄组小鼠每日给予相同溶媒(饮用水)灌胃。大黄素组小鼠分别按照40 mg·kg-1、80 mg·kg-1,罗格列酮组小鼠按照10 mg·kg-1剂量灌胃给药,灌胃容积0.1 mL/10 g,连续灌胃给药6 周。
2.2 取材
末次给药后,动物禁食12 h,麻醉,摘眼球取血,3500 r·min-1离心10 min,分离血清。并分离小鼠皮下腹股沟白色脂肪组织(iWAT)以及肩胛处BAT,固定在10% 中性福尔马林固定液中。
2.3 脂肪组织质量与体质量比值的测定
精确称取小鼠皮下iWAT 以及肩胛处BAT 质量,计算iWAT 与体质量,肩胛处BAT 质量与体质量的比值。
2.4 血脂相关指标检测
按照试剂盒说明书测定血清中TC、TG、LDL-C、HDL-C、LEP、ADPN 和FFA 的含量。
2.5 HE 染色观察脂肪细胞形态变化
将固定在10%中性福尔马林固定液中的iWAT、BAT 取出依次进行常规脱水,石蜡包埋,切片,HE 染色,中性树胶封片,显微镜镜检,图像采集分析。
2.6 免疫组化检测脂肪组织UCP1 表达
石蜡切片进行常规脱蜡,将iWAT、BAT 切片放在抗原修复缓冲液中进行修复,在iWAT、BAT 切片上滴加3%双氧水溶液,避光室温孵育25 min,0.01 mol·L-1PBS 洗3 次,在切片上滴加山羊血清封闭1 h。在切片上滴加稀释好的一抗溶液(1∶500),将切片放入湿盒内4 ℃过夜。滴加稀释好的二抗,37℃孵育20 min,DAB 显色,苏木素复染3 min,常规脱水,中性树胶封片。通过Image-Pro Plus 6.0 软件,选取棕黄色处为阳性着色,对阳性表达处进行AOD 分析,计算脂肪组织UCP1 蛋白原位表达。
2.7 统计学处理
统计学处理采用SAS8.2 软件进行,实验数据以平均值±标准差(±s)表示,对于正态数据,多组间比较采用单因素方差分析法(ANOVA),两组间比较采用SNK-q检验,P<0.05 为差异具有统计学意义。
3 结果
3.1 大黄素对老龄小鼠体质量的影响
与非老龄组比较,老龄组小鼠体质量显著升高(P<0.01);与老龄组比较,大黄素40 mg·kg-1和80 mg·kg-1组给药后体质量无明显变化(P>0.05)(见图1)。
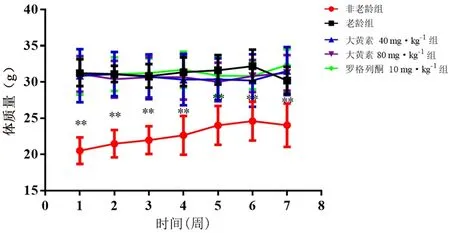
图1 大黄素对老龄小鼠体质量的影响(±s,n =10)Fig 1 Effect of emodin on body mass of aging mice(±s,n =10)
3.2 大黄素对老龄小鼠脂肪比重的影响
与非老龄组比较,老龄组小鼠肩胛处BAT 质量与体质量比值有降低趋势(P>0.05),皮下iWAT 质量与体质量比值升高(P<0.01);大黄素及罗格列酮干预对小鼠皮下脂肪比重未见显著影响(P>0.05)(见图2)。
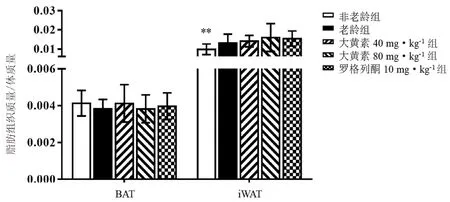
图2 大黄素对老龄小鼠脂肪质量与体质量比值的影响(±s,n=10)Fig 2 Effect of emodin on the ratio of BAT and iWAT to body weight in aging mice(±s,n =10)
3.3 大黄素对老龄小鼠血脂相关指标的影响
与非老龄组比较,老龄组小鼠血清中TC、TG和FFA 含量显著升高(P<0.01);与老龄组小鼠比较,大黄素40 mg·kg-1和80 mg·kg-1组小鼠血清中TC、TG 含量分别降低40%、39%和41%、33%(P<0.01);大黄素40 mg·kg-1组血清中FFA 含量降低18%(P<0.05)(见图3)。

图3 大黄素对老龄小鼠血清中血脂相关指标的影响(±s,n =10)Fig 3 Effect of emodin on blood lipids in aging mice(±s,n =10)
3.4 大黄素对老龄小鼠脂肪因子的影响
与非老龄组比较,老龄组小鼠血清中LEP 含量显著升高(P<0.05),大黄素对老龄动物血清LEP 水平未见显著影响。与非老龄组比较,老龄组小鼠血清ADPN 水平显著降低(P<0.05),大黄素40 mg·kg-1和80 mg·kg-1可显著升高老龄动物血清ADPN 水平,分别升高33%和44%(P<0.05)(见图4)。
3.5 老龄小鼠BAT 及iWAT 的HE 染色结果

图4 大黄素对老龄小鼠血清中LEP 及ADPN 的影响(±s,n =10)Fig 4 Effect of emodin on LEP and ADPN in the serum of aging mice(±s,n =10)
HE 染色结果显示,与非老龄组比较,老龄组小鼠BAT 细胞直径较大,细胞白色化趋势显著;与老龄组小鼠相比,大黄素40、80 mg·kg-1组及罗格列酮10 mg·kg-1组小鼠BAT 较为紧密,细胞变小,细胞核明显,细胞间具有丰富的毛细血管。在iWAT 中,与非老龄组比较,老龄组小鼠脂肪组织较为松散,脂肪细胞直径较大,白色脂肪特征明显;与老龄组相比,大黄素40、80 mg·kg-1组及罗格列酮10 mg·kg-1组小鼠皮下白色脂肪细胞变小,棕色化趋势显著(见图5)。
3.6 大黄素对老龄小鼠BAT、iWAT 部位UCP1蛋白表达的影响
免疫组化结果显示,与非老龄组比较,老龄组小鼠BAT 中UCP1 阳性细胞表达显著减少(P<0.01);与老龄组比较,大黄素40、80 mg·kg-1组及罗格列酮10 mg·kg-1组UCP1 阳性细胞表达明显增多(P<0.01)。在iWAT 中,老龄组UCP1 阳性细胞表达明显减少(P<0.01);与老龄组比较,大黄素40、80 mg·kg-1组及罗格列酮10 mg·kg-1组UCP1 阳性细胞表达明显增多(P<0.05 或P<0.01)(见图6)。
4 讨论
老年机体常伴随脂质代谢的异常,表现为脂质异位沉积、血液黏稠度增加等,高脂血症是肥胖症、动脉粥样硬化、高血压、糖尿病等疾病的重要易感因素[16]。脂肪组织在维持全身脂质稳态中具有重要作用,脂肪组织以TG 的形式存储能量,当机体需要能量时,TG 分解为FFA 和甘油提供能量[17]。WAT 脂解产生的脂肪酸可在肝脏内合成极低密度脂蛋白(VLDL),VLDL 进入循环后转变为LDL,LDL 是诱发动脉粥样硬化的因素之一[18]。过量的血清脂肪酸可能会诱发炎症反应,从而导致胰岛素抵抗[19]。此外,脂肪细胞大小是血脂和胰岛素稳态变化的重要预测因子,其变化可增加患心血管疾病的风险[20]。
本实验中,与非老龄组比较,老龄组小鼠血清TC、TG、FFA 含量显著增加,同时可以观察到皮下白色脂肪细胞更加肥大,棕色脂肪细胞“白色化”更加明显。与老龄组比较,大黄素40 mg·kg-1、80 mg·kg-1组小鼠血清TC、TG 含量显著下降,大黄素40 mg·kg-1组小鼠血清FFA 含量显著降低。此外,大黄素干预组小鼠血清中脂肪因子ADPN 水平明显升高。ADPN 主要由脂肪细胞分泌,具有增加胰岛素敏感性并直接改善脂肪组织脂质代谢的作用[21]。LEP 主要由皮下脂肪细胞分泌,可作用于神经及免疫系统,具有降低体质量、调节能量代谢和促进WAT 褐变的作用[22-23]。LEP 水平与脂肪组织质量具有相关性,老年机体白色脂肪堆积导致LEP 水平升高,持续高水平的LEP 导致其利用率降低进而产生LEP 抵抗[24]。本研究结果显示老龄动物血清LEP 水平升高,大黄素对LEP 未见明显调节作用。
BAT 是高度血管化和神经支配的组织,在啮齿类动物中主要存在于肩胛处、肾周围和主动脉周区,棕色脂肪细胞具有多室脂滴和大量的线粒体以及丰富的交感神经和毛细血管[25]。UCP1 是位于棕色脂肪细胞线粒体内膜上的蛋白,是BAT产热的必需蛋白[26]。UCP1 可破坏线粒体内膜两侧的H+浓度,使氧化与磷酸化解偶联,能量以热能的形式释放[27]。BAT 可加快脂肪的氧化产热,增加机体的能量代谢,从而消除脂肪组织功能障碍[28]。BAT 可吸收血液中富含TG 的脂蛋白释放的脂肪酸,储存在细胞内,作为H+的同向转运体激活UCP1 促进产热,同时降低血清TG水平并增加肝脏VLDL 残留清除率[28]。在β-肾上腺素能受体激动剂或冷暴露下,原本具有白色脂肪细胞特征的脂肪细胞脂滴逐渐增多、线粒体数量增加、UCP1 大量表达、产热增加,表现出棕色脂肪细胞样形态及功能,这个过程称为“白色脂肪棕色化”[29],目前WAT 褐变成为改善相关代谢疾病的潜在靶标。本实验中HE 染色结果显示,与老龄组相比,大黄素40 mg·kg-1、80 mg·kg-1组小鼠白色脂肪细胞出现多室,细胞变小变圆细胞更加致密,具有明显的“褐变”趋势,同时棕色脂肪细胞分布明显增多,细胞间毛细血管更加丰富,大黄素可显著增加iWAT 及BAT 中UCP1 的表达。
综上,老龄小鼠可出现脂质代谢紊乱,WAT比重增加,脂肪呈现白色化趋势;大黄素可改善老龄动物的脂质代谢紊乱,作用可能与抑制白色脂肪,减少周围脂质释放,促进脂肪棕色化,改善能量代谢有关。
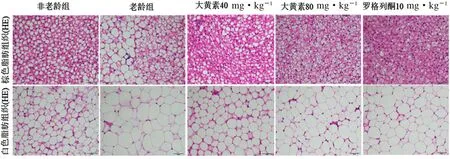
图5 大黄素对老龄小鼠脂肪组织形态的影响(HE 染色,×400)Fig 5 Effect of emodin on the morphology of adipose tissue in aging mice(HE staining,×400)
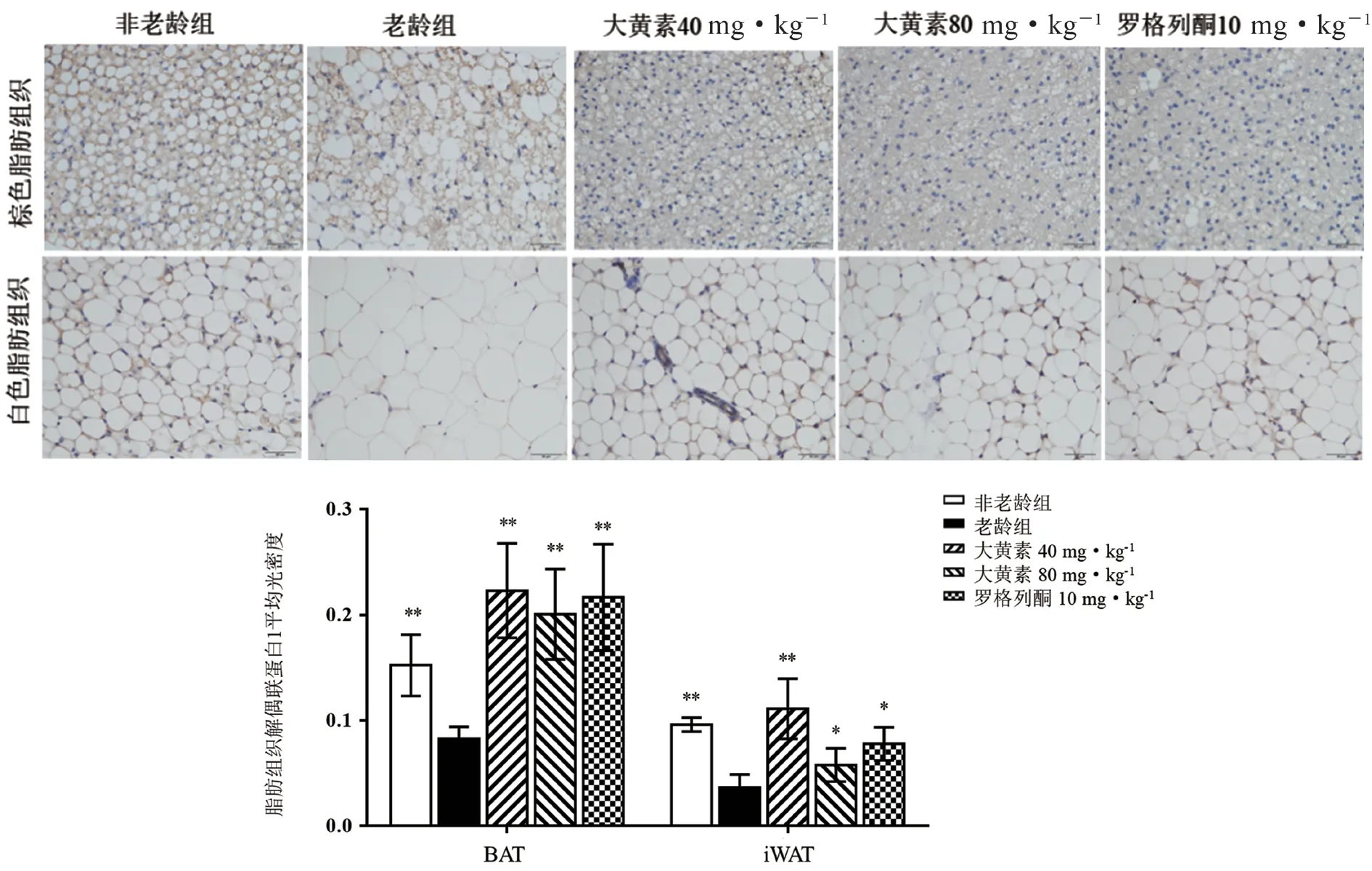
图6 大黄素对老龄小鼠脂肪组织UCP1 蛋白表达的影响(±s,n =10)Fig 6 Effect of emodin on the expression of UCP1 protein in adipose tissue of aging mice(±s,n =10)

