湿润烧伤膏对脂多糖致大鼠皮肤成纤维细胞损伤的改善作用及其机制研究
姜艳 巩奇明 韦骋 陆飞燕 卓臣义 唐乾利


摘 要 目的:研究濕润烧伤膏对脂多糖致大鼠皮肤成纤维细胞损伤的改善作用及其机制。方法:将大鼠皮肤成纤维细胞分为对照组、脂多糖组(5 μg/mL)、康复新液组(阳性对照,5 μg/mL脂多糖+1.25%康复新液)和湿润烧伤膏组(5 μg/mL脂多糖+0.6 mg/mL湿润烧伤膏),每组设置6个复孔。以脂多糖诱导建立炎性损伤细胞模型(对照组除外)。培养一定时间后,检测各组细胞存活率和细胞迁移率,测定细胞上清液中肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)含量,检测细胞内IL-6蛋白定位和荧光强度,检测细胞中同源性磷酸酶张力蛋白(PTEN)、磷酸化p65(p-p65)、TNF-α、IL-6、磷脂酰肌醇3激酶(PI3K)和蛋白激酶B(Akt)蛋白的表达情况。结果:与对照组比较,脂多糖组细胞存活率显著升高、迁移率显著降低,细胞上清液中TNF-α、IL-6含量和PTEN、p-p65、TNF-α、IL-6和PI3K蛋白的相对表达量均显著升高(P<0.01),IL-6蛋白主要在细胞质中表达且荧光强度增强。与脂多糖组比较,康复新液组和湿润烧伤膏组细胞存活率均显著降低、迁移率均显著升高;TNF-α、IL-6含量和PTEN、p-p65、TNF-α、IL-6(除康复新液组外)、PI3K、Akt(除康复新液组外)蛋白的相对表达量均显著降低(P<0.05或P<0.01),IL-6蛋白荧光强度减弱,且湿润烧伤膏组细胞中TNF-α、IL-6、PI3K、Akt蛋白的相对表达量均显著低于康复新液组(P<0.05或P<0.01)。结论:湿润烧伤膏可抑制脂多糖诱导的大鼠皮肤成纤维细胞增殖,降低炎性因子水平和炎症反应强度,其机制可能与下调PTEN/核因子κB、PI3K/Akt信号通路有关。
关键词 湿润烧伤膏;皮肤成纤维细胞;炎症反应;同源性磷酸酶张力蛋白/核因子κB;磷脂酰肌醇3激酶/蛋白激酶B
中图分类号 R285 文献标志码 A 文章编号 1001-0408(2021)06-0702-07
ABSTRACT OBJECTIVE: To study the improvement effect and mechanism of MEBO on lipopolysaccharide (LPS)-induced injury of rat skin fibroblasts. METHODS: Skin fibroblasts of rats were divided into control group, LPS group (5 μg/mL), Kangfuxin solution group (positive control, 5 μg/mL LPS+1.25% Kangfuxin solution) and MEBO group (5 μg/mL LPS+0.6 mg/mL MEBO), with 6 wells in each group. Inflammatory injury cell model was induced by LPS (except for control group). After a certain period of cultivation, the cell survival rate and cell migration rate were detected in each group. The contents of TNF-α and IL-6 in cell supernatant was detected. The localization and fluorescence intensity of IL-6 protein were detected. The protein expression of PTEN, p-p65, TNF-α, IL-6, PI3K and Akt in the fibroblasts were also determined. RESULTS: Compared with control group, survival rate of the fibroblasts was increased significantly in LPS group, while cell migration was decreased significantly; the contents of TNF-α and IL-6 in cell supernatant as well as relative protein expression of PTEN, p-p65, TNF-α, IL-6 and PI3K were increased significantly (P<0.05 or P<0.01); IL-6 protein mainly expressed in the cytoplasm, and the fluorescence intensity was enhanced. Compared with LPS group, survival rate of the fibroblasts was decreased significantly in Kangfuxin solution group and MEBO group, while migration rate was increased significantly; the contents of TNF-α and IL-6, relative protein expression of PTEN, p-p65, TNF-α, IL-6 (except for Kangfuxin solution group), PI3K and Akt (except for Kangfuxin solution group) were decreased significantly (P<0.05 or P<0.01), while fluorescence intensity of IL-6 protein decreased; relative protein expression of TNF-α, IL-6, PI3K and Akt in MEBO group were significantly lower than Kangfuxin solution group (P<0.05 or P<0.01). CONCLUSIONS: MEBO can inhibit the proliferation of LPS-induced skin fibroblasts, reduce the level of inflammatory factors and the intensity of inflammatory reaction, which may be related to the down-regulation of PTEN/NF-κB,PI3K/Akt signaling pathway.
KEYWORDS MEBO; Skin fibroblasts; Inflammation reaction; PTEN/NF-κB; PI3K/Akt
皮肤成纤维细胞是创面愈合修复的重要结构细胞,其增殖、凋亡、迁移、炎症反应均参与创面修复过程,并与毛细血管共同构成肉芽组织结构[1]。因此,调控该类细胞的生物学行为,对创面愈合具有重要意义。
湿润烧伤膏适用于烧伤、慢性难愈合皮肤溃疡等创面的修复,且临床使用疗效明显[2]。已有研究证实,湿润烧伤膏可明显改善表皮生长细胞超微结构、稳定细胞內环境、增强成纤维生长因子(bFGF)和血管生长因子(VEGF)的增殖分化能力,促进创面修复[3-4]。目前,关于湿润烧伤膏的研究主要集中于在体创面愈合,有关其作用机制尚不十分明确。已有研究报道,抑制同源性磷酸酶张力蛋白(PTEN)的表达可增加内皮细胞分裂和迁移,促进角膜内皮伤口愈合[5]。核因子κB(NF-κB)是炎症和氧化应激的生物标志物,参与创面愈合的炎症反应及细胞增殖等活动[6]。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)通路可调控细胞生长、增殖、能量代谢,并可改变细胞结构[7]。本课题组前期研究发现,湿润烧伤膏可促进大鼠成纤维细胞增殖[8]。基于此,本研究通过构建炎性损伤大鼠皮肤成纤维细胞模型,研究湿润烧伤膏对模型细胞存活、迁移、炎性因子分泌情况的影响,并基于PTEN/NF-κB、PI3K/Akt信号通路初步研究其可能的作用机制,旨在为完善湿润烧伤膏促创面愈合的分子机制提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括TriStar LB941型酶标仪(德国Berthold公司)、FV3000型激光扫描共聚焦显微镜(日本Olympus公司)、PoverPac 3000型电泳仪(美国Bio-Rad公司)、Odyssey型双色红外激光成像系统(美国LI-COR公司)等。
1.2 主要药品与试剂
湿润烧伤膏(批号Z20000004,每1 g相当于饮片0.21 g)购自汕头市美宝制药有限公司,康复新液(阳性对照,批号M190550,每瓶100 mL)购自湖南科伦制药有限公司,CCK-8试剂(批号M4839)购自美国AbMole公司,胰蛋白酶、DMEM培养基(批号25200-056、C11995500BT)均购自美国Gibco公司,胎牛血清(批号:ABS972)购自上海爱必信生物科技有限公司,BCA蛋白定量试剂盒、无蛋白快速封闭液(5×)(批号ZJ101、PS108)均购自上海雅酶生物医药科技有限公司,肿瘤坏死因子α(TNF-α)酶联免疫吸附测定(ELISA)试剂盒、IL-6 ELISA试剂盒(批号CSB-E04741m、E-EL-R0015C)均购自武汉伊莱瑞特生物科技股份有限公司,脂多糖(批号L2880,纯度≥99%)购自美国Sigma公司,兔PTEN单克隆抗体、兔Akt多克隆抗体、兔PI3K单克隆抗体(批号ab32199、ab8805、ab180967)均购自美国Abcam公司,兔磷酸化p65(p-p65)多克隆抗体(批号3033s)购自美国CST公司,兔TNF-α多克隆抗体、兔IL-6多克隆抗体、大鼠甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体、大鼠β-微管蛋白(β-tubulin)单克隆抗体、山羊抗兔免疫球蛋白G(IgG)(H+L)Fluor 488结合多克隆二抗、山羊抗大鼠IgG(H+L)Fluor 647结合多克隆二抗(批号AF7014、DF6087、T0004、T0023、S0018、S0014)均购自美国Affinity公司,IRDye 800CW山羊抗兔二抗、IRDye 680RD山羊抗鼠二抗(批号925-32211、925-68070)均购自美国LI-COR公司,4′,6-二脒基-2-苯基吲哚(DAPI)染料、抗荧光衰减封片剂、Triton X-100试剂和4%组织细胞固定液(批号C0065、S2100、T8200、P1110)均购自北京索莱宝科技有限公司,RIPA裂解液(强)(批号P0013B)购自上海碧云天生物技术有限公司,其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 细胞
大鼠皮肤成纤维细胞购自上海中乔新舟生物科技有限公司。
2 方法
2.1 细胞培养
取大鼠皮肤成纤维细胞适量,接种于完全培养基(含10%胎牛血清的DMEM培养基)中,于37 ℃、5%CO2下培养(培养条件下同)。每2天更换1次新的完全培养基,待细胞生长至对数生长期(即融合度达80%~90%)时传代。
2.2 药液的制备
2.2.1 湿润烧伤膏药液 取湿润烧伤膏适量,用无水乙醇-二甲基亚砜溶液(1 ∶ 1,V/V)溶解,制成质量浓度为0.1 g/mL(以膏体质量计)的溶液,于-4 ℃密封保存,使用时用完全培养基稀释至0.6 mg/mL。
2.2.2 阳性对照药液 将康复新液置于-4 ℃密封保存,使用时用完全培养基稀释至1.25%。
2.3 细胞存活率检测
采用CKK-8法进行检测。取对数生长期细胞接种于96孔板中,接种密度为5×103个/孔。培养24 h后,将其随机分为对照组、脂多糖组(5 μg/mL[9])、康复新液组(5 μg/mL脂多糖+1.25%康复新液[10])和湿润烧伤膏组(5 μg/mL脂多糖+0.6 mg/mL湿润烧伤膏[8]),每组设置6个复孔,同时设置不含细胞的空白孔。对照组加入完全培养基,脂多糖组加入含5 μg/mL脂多糖的完全培养基,给药组加入含5 μg/mL脂多糖和相应浓度药液的完全培养基。培养48 h后,每孔加入CCK-8试剂10 μL,37 ℃孵育1 h,使用酶标仪于450 nm波长处测定各孔的光密度(OD)值并计算细胞存活率:细胞存活率(%)=(检测组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)×100%。试验重复3次。
2.4 细胞迁移率检测
采用细胞划痕试验进行检测。取对数生长期细胞接种于6孔板中,接种密度为1×105个/孔。培养48 h后,使用10 μL枪头垂直于孔板划痕,弃细胞上清液,用磷酸盐缓冲液(PBS,pH=7.2~7.4)清洗细胞1次后,按“2.3”项下方法分组(无需设置空白孔,下同)、给药(仅此试验使用含0.1%胎牛血清的DMEM培养基进行培养)。分别于培养0、24、48 h时拍照记录细胞迁移情况并计算细胞迁移率:细胞迁移率(%)=(0 h划痕宽度-某时间点划痕宽度)/0 h划痕宽度×100%。试验重复3次。
2.5 细胞上清液中TNF-α和IL-6含量檢测
采用ELSIA法进行检测。取对数生长期细胞接种于6孔板中,接种密度为2×104个/孔,按“2.3”项下方法分组、给药。培养48 h后,取细胞上清液,以3 000 r/min离心10 min,取上清液,按照ELISA试剂盒说明书进行操作,使用酶标仪测定细胞上清液中TNF-α和IL-6含量。试验重复3次。
2.6 细胞内IL-6蛋白定位和荧光强度检测
采用免疫荧光法进行检测。取对数生长期细胞接种于共聚焦培养皿中,接种密度为5×103个/皿,按“2.3”项下方法分组、给药。培养48 h后,弃上清液,细胞用PBS清洗5 min×3次,用0.4%多聚甲醛溶液固定30 min;细胞用PBS清洗5 min×3次,用0.1%Triton X-100试剂透化20 min;细胞用PBS清洗5 min×3次,用封闭液室温封闭10 min,加入IL-6、β-tubulin一抗(稀释度均为1 ∶ 200),于4 ℃下孵育过夜;细胞用PBS清洗5 min×3次,加入相应的IgG(H+L)标记二抗(稀释度均为1 ∶ 200),室温避光孵育40 min;细胞用PBS清洗5 min×3次(此步骤及后续步骤均需避光操作),用5 μg/mL的DAPI染料染色10 min,用PBS溶液清洗,滴加抗荧光衰减封片剂后封片,使用激光扫描共聚焦显微镜成像,观察IL-6蛋白定位并记录荧光强度。
2.7 细胞中PTEN、p-p65、TNF-α、IL-6、PI3K、Akt蛋白表达检测
采用Western blot法进行检测。取对数生长期细胞接种于培养皿中,接种密度为8×105个/皿,按“2.3”项下方法分组、给药。培养48 h后,弃上清液,细胞用4 ℃预冷PBS清洗2次,以RIPA裂解,于4 ℃下12 000 r/min离心10 min,取上清液,即得细胞总蛋白。取上述总蛋白40 μg,煮沸5 min进行变性;取变性蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,转膜,室温封闭10 min,分别加入PTEN、p-p65、TNF-α、IL-6、PI3K、Akt、GAPDH一抗(稀释度均为1 ∶ 2 000),于4 ℃孵育过夜;PBST溶液洗膜5 min×3次,加入相应IRDye二抗(稀释度均为1 ∶ 10 000),室温孵育40 min(此步骤及后续步骤均需避光操作),PBST溶液洗膜5 min×3次,于双色红外激光成像系统上成像。采用Image J 1.8.0软件处理并分析,计算目标蛋白与内参(GAPDH)的灰度值比值,再以对照组为标准计算相对表达量。试验重复3次。
2.8 统计学方法
利用SPSS 22.0软件对数据进行统计分析。数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用t检验。P<0.05表示差异有统计学意义。
3 结果
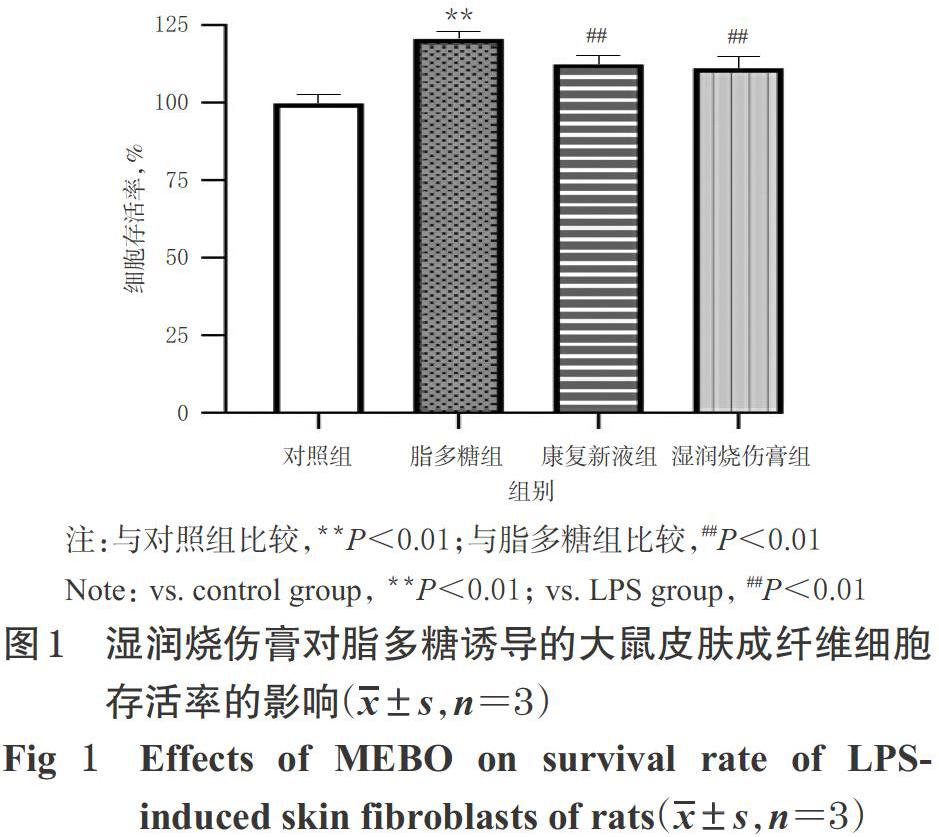
3.1 湿润烧伤膏对脂多糖诱导的大鼠皮肤成纤维细胞存活率的影响
与对照组比较,脂多糖组细胞存活率显著升高(P<0.01)。与脂多糖组比较,康复新液组和湿润烧伤膏组细胞存活率均显著降低(P<0.01);而康复新液组与湿润烧伤膏组比较差异无统计学意义(P>0.05),详见图1。
3.2 湿润烧伤膏对脂多糖诱导的大鼠皮肤成纤维细胞迁移的影响
与对照组比较,脂多糖组细胞在作用24、48 h时的细胞迁移率均降低,其中48 h时细胞迁移率组间比较差异有统计学意义(P<0.01)。与脂多糖组比较,康复新液组和湿润烧伤膏组作用24、48 h的细胞迁移率均增加,其中48 h时细胞迁移率组间比较差异有统计学意义(P<0.01);而康复新液组与湿润烧伤膏组比较差异无统计学意义(P>0.05),详见图2、图3(湿润烧伤膏作用24 h对脂多糖诱导的大鼠皮肤成纤维细胞迁移的影响图略)。
3.3 湿润烧伤膏对脂多糖诱导的大鼠皮肤成纤维细胞上清液中TNF-α、IL-6含量的影响
与对照组比较,脂多糖组细胞上清液中TNF-α、IL-6含量均显著升高(P<0.01)。与脂多糖组比较,康复新液组和湿润烧伤膏组细胞上清液中TNF-α、IL-6含量均显著降低(P<0.05或P<0.01);而康复新液组与湿润烧伤膏组比较差异均无统计学意义(P>0.05),详见表1。
3.4 湿润烧伤膏对脂多糖诱导的大鼠皮肤成纤维细胞内IL-6蛋白定位和荧光强度的影响
IL-6主要在细胞质内表达。脂多糖组细胞内IL-6蛋白表达荧光强度高于对照组。康复新液组和湿润烧伤膏组细胞内IL-6蛋白表达荧光强度低于脂多糖组,且康复新液组和湿润烧伤膏组的荧光强度接近,详见图4[图中,“IL-6”标记IL-6阳性表达细胞(绿色),“β-tubulin”标记细胞微管(红色),“DAPI”标记细胞核(蓝色),“Merge”为三者叠加]。
3.5 湿润烧伤膏对脂多糖诱导的大鼠皮肤成纤维细胞中PTEN、p-p65、TNF-α、IL-6、PI3K、Akt蛋白表达的影响
与对照组比较,脂多糖组细胞中PTEN、p-p65、TNF-α、IL-6、PI3K蛋白的相对表达量均显著升高(P<0.05或P<0.01)。与脂多糖组比较,康复新液组和湿润烧伤膏组细胞中PTEN、p-p65、TNF-α、IL-6(除康复新液组外)、PI3K、Akt(除康复新液组外)蛋白的相对表达量均显著降低(P<0.05或P<0.01),其中湿润烧伤膏组细胞中TNF-α、IL-6、PI3K、Akt蛋白的相对表达量均显著低于康复新液组(P<0.05或P<0.01),详见图5、表2。
4 讨论
创面愈合过程经历3个阶段,包括炎症期、增殖期和修复期。炎症反应是创面进展中的主导因素,可以直接影响创面细胞增殖和创面重塑[1,11]。已研究证实,创面炎症反应会影响成纤维细胞增殖、扰乱细胞活动、诱导促炎因子产生,进而延缓创面愈合[12-14]。现多采用脂多糖刺激成纤维细胞,以建立体外增生性瘢痕成纤维细胞表型类似的细胞模型[15-16]。石珊等[17]研究证实,脂多糖可通过改变正常皮肤成纤维细胞内结构、影响细胞外基质蛋白表达,从而导致成纤维细胞生物学功能改变,最终转化成增生性疤痕。由此看来,调控脂多糖诱导的皮肤成纤维细胞生物学功能,对研究创面的进程具有重要意义。
湿润烧伤膏和康复新液均为临床创面康复的常用药。康复新液主要成分是美洲大蠊乙醇提取物,可在炎症期减轻患者局部炎症反应,调节细胞增殖和分泌,减少渗出,促进创面愈合[18]。湿润烧伤膏也是中药制剂,包含黄连、黄柏、黄芩、地龙等药材,被应用于各种慢性创面修复[19-20]。基于此,本研究以康复新液作为阳性对照药物,研究湿润烧伤膏对炎症环境下成纤维细胞的影响,通过探讨相关分子机制进一步完善湿润烧伤膏愈合创面的可能机制,为其临床使用提供理论依据。
PTEN是一种抑癌因子,具有双特异性磷酸酶活性,可调控细胞转录、增殖和迁移等行为,参与了肿瘤、糖尿病等疾病的发生发展[21-24]。已有研究表明,PTEN受抑制可促进创面细胞迁移、加速创面的愈合[25]。脂多糖可诱导PTEN蛋白活化,激活NF-κB通路,进而引发“瀑布效应”样炎症反应,刺激细胞分泌TNF-α、IL-6等多种炎性因子[26]。另有研究表明,NF-κB参与了成纤维细胞的增殖[27]。TNF-α和IL-6都是NF-κB通路下游的重要调控因子,具有介导炎症反应发生发展的生物学特性[7,28]。同时,IL-6亦能调控丝裂原活化蛋白激酶信号通路以增加炎性因子的表达,在糖尿病足溃疡模型大鼠创面组织中处于高表达水平[11,29]。本研究结果显示,IL-6主要在细胞质内表达。湿润烧伤膏和康复新液均可通过抑制脂多糖过度激活的PTEN表达,抑制大鼠皮肤成纤维细胞增殖,降低TNF-α、IL-6、p-p65表达,从而改善炎症反应,且湿润烧伤膏组TNF-α和IL-6表达下降趋势强于康复新液组。已有体内实验表明,创面愈合需要PI3K/Akt通路蛋白经历先升高后降低的动态变化过程[3]。由此可见,PI3K/Akt的长期过度激活并不利于创面愈合。笔者结合文献[17]分析本研究结果发现,脂多糖可促进大鼠皮肤成纤维细胞增殖,但这种增殖作用可被湿润烧伤膏和康复新液所抑制,其分子机制可能抑制PI3K、Akt蛋白的表达有关,且湿润烧伤膏组PI3K和Akt表达下降趋势强于康复新液组。
综上所述,湿润烧伤膏可抑制脂多糖诱导的大鼠皮肤成纤维细胞增殖,降低炎性因子水平和炎症反应强度,其机制可能与下调PTEN/NF-κB、PI3K/Akt信号通路有关。但创面愈合过程涉及多因素、多靶点相互作用,本文仅初步研究了湿润烧伤膏促进创面愈合的一部分机制,且药物剂量依赖性与作用时间依赖性等问题均有待深入研究。
参考文献
[ 1 ] 向鹏君,季晖,顾铭,等.糖尿病创面的炎症机制研究进展[J].药学研究,2017,36(11):667-670.
[ 2 ] 符黄德,舒清峰,唐乾利,等. MEBT/MEBO对Wagner Ⅱ级糖尿病足溃疡病人28 d创面愈合率及周围神经病变的影响研究[J].右江民族医学院学报,2018,40(3):209- 212.
[ 3 ] 陈端凯,冯时,唐乾利,等.湿润暴露疗法/湿润烧伤膏对慢性创面组织中MMP-2和MMP-9表达的影响[J].中国药理学通报,2020,36(2):288-294.
[ 4 ] 李利青,林也,葛斌,等.湿润暴露疗法/湿润烧伤膏干预PI3K/Akt/mTOR信号通路促进体表慢性难愈合创面修复的实验研究[J].中国中西医结合杂志,2019,39(5):583-590.
[ 5 ] ZHANG W,YU F,YAN C,et al. PTEN inhibition accelerates corneal endothelial wound healing through increased endothelial cell division and migration[J]. Invest Ophth Vis Sci,2020,61(8):19.
[ 6 ] MA Q,WU Y,SHEN J,et al. Walnut oil promotes healing of wounds and skin defects in rats via regulating the NF-κB pathway[J]. Pharmazie,2018,73(12):721-724.
[ 7 ] YANG L,HU Y,ZHOU G,et al. Erianin suppresses hepatocellular carcinoma cells through down-regulation of PI3K/Akt,p38 and ERK MAPK signaling pathways[J/OL]. Biosci Rep,2020[2021-02-03]. https://doi.org/10.1042/ BSR20193137.
[ 8 ] 李政,麻華胆,郑爱甜,等. MEBO对糖尿病大鼠慢性创面纤维细胞生长的影响[J].右江医学,2021,49(1):12-15.
[ 9 ] 熊华翠,陈柯,李美美.自噬在脂多糖诱导成牙本质细胞凋亡中的作用[J].南方医科大学学报,2020,40(12):1816-1820.
[10] 姚欢.康复新液抗博来霉素诱导大鼠肺纤维化作用及对小鼠成纤维细胞增殖和迁移的影响[D].成都:成都中医药大学,2019.
[11] 韩强,柳国斌,黄仁燕,等. Nocth信号通路对糖尿病足溃疡炎症因子及生长因子表达的影响[J/OL].海南医学院学报,2020[2021-02-03]. https://doi.org/10.13210/j.cnki.jhmu.20200529.001.
[12] CHANIAD P,TEWTRAKUL S,SUDSAI T,et al. Anti-inflammatory,wound healing and antioxidant potential of compounds from Dioscorea bulbifera L. bulbils[J]. PLoS One,2020,5(12):e0243632.
[13] 王一名,魏文鑫,韩岩.脂肪脱细胞基质联合封闭式负压引流对猪创面炎症反应的影响研究[J].中国修复重建外科杂志,2020,34(3):373-381.
[14] 韩强,柳国斌,严仕梦,等.紫朱软膏通过抑制炎症反应促进糖尿病足溃疡愈合的研究[J].海南医学院学报,2020,26(21):1617-1624、1629.
[15] 王伟东.丝裂原活化蛋白激酶信号通路在皮肤成纤维细胞的内毒素刺激模型中介导细胞表型该表的机制研究[D].北京:中国人民解放军医学院,2018.
[16] 李凤玉,杨红明,贾国宏,等.内毒素对人正常皮肤成纤维细胞表型变化的影响及意义[J].感染、炎症、修复,2010,11(2):76-79、129.
[17] 石珊,李梦凡,王玲,等.脂多糖对真皮成纤维细胞纤维化相关因子表达及瘢痕形成的影响[J].解放军医学杂志,2020,45(6):604-610.
[18] 赵吉英,杨正宏.美宝创疡贴联合康复新液治疗慢性皮肤溃疡的效果观察[J].中外医学研究,2020,18(8):147- 149.
[19] 卢栋,郭璐,唐乾利,等. MEBT/MEBO治疗慢性难愈合创面60例临床疗效观察[J].中国烧伤创疡杂志,2010,22(5):346-350.
[20] 韦积华,唐乾利,罗群强,等. Ilizarov微循环重建技术对糖尿病足溃疡的临床疗效观察[J].右江民族医学院学报,2019,41(3):239-245.
[21] 唐乾利,曾鸿孟,王澍,等.皮肤再生医疗技术对大鼠慢性难愈合创面不同时段 PTEN 表达的影响[J].中华中医药学刊,2017,35(9):2218-2221.
[22] 彭晓清,陈飞虎,葛金芳,等. 4-氨基-2-三氟甲基苯基维甲酸酯通过PTEN/PI3K/Akt抑制 YAC-1细胞增殖和诱导其分化[J].中国药理学通报,2014,30(1):60-65.
[23] MA J,SUN X,WANG Y,et al. Fibroblast-derived CXCL12 regulates PTEN expression and is associated with the proliferation and invasion of colon cancer cells via PI3K/Akt signaling[J]. Cell Commun Signal,2019,17(3):481-493.
[24] SONG Y,LIU W,TANG K,et al. Mangiferin alleviates renal interstitial fibrosis in streptozotocin induced diabetic mice through regulating the PTEN/PI3K/Akt signaling pathway[J/OL]. J Diabetes Res,2020[2021-02-03].http://doi.org/10.1155/2020/9481720.
[25] 陈端凯,岑小宁,包崇婵,等. MEBT/MEBO通过PTEN/Akt通路对慢性难愈合创面中基质金属蛋白酶表達的影响[J].中国中西医结合杂志,2020,40(4):459-464.
[26] 杨世勇,何毅,宋大强,等.基于TLR4/NF-κB途径的白藜芦醇减轻LPS致小鼠急性肺损伤的机制研究[J].中国药房,2020,31(9):1034-1039.
[27] 孙小青.抑制TRAF6及其诱导的NF-κB信号通路与瘢痕疙瘩成纤维细胞增殖的相关性研究[D].大连:大连医科大学,2018.
[28] HUANG J,FU J,LIU B,et al. A synthetic curcuminoid analog,(2E,6E)-2,6-bis(2-(trifluoromethyl)benzylidene)cyclohexanone,ameliorates impaired wound healing in streptozotocin-induced diabetic mice by increasing miR- 146a[J]. Molecules,2020,25(920):1-13.
[29] 洪如伟,洪艺秦,戴学程. MEBO联合VSD对骨科难愈性创面临床疗效及血清炎症因子水平的影响[J].中国烧伤疮疡杂志,2020,32(3):162-165.
(收稿日期:2020-09-03 修回日期:2021-02-05)
(编辑:邹丽娟)

