基于电喷雾质谱法及化学计量法筛选鹿茸促睾丸间质细胞分泌睾酮的活性成分
王亚苹,李晶峰,张凯月,张楠茜,高颖,张辉,孙佳明
(1.长春中医药大学药学院,吉林长春 130117)(2.东北亚生物科技有限公司,吉林长春 130117)(3.长春中医药大学人参科学研究院,吉林长春 130117)
鹿茸(Cervi CornuPantotrichum)是我国传统名药之一,为鹿科动物梅花鹿(Cervus nipponTemminck)或马鹿(Cervus elaphusLinnaeus)的雄鹿未骨化而带茸毛的幼角。在我国有几千年的应用历史,味甘、咸,性温,归肾、肝经[1,2]。在《神农本草经》中被列为中品,具有壮肾阳,益精血,强筋骨等功效[3]。鹿茸中含有氨基酸、蛋白质、磷脂、胆固醇等丰富的营养成分[4]。用于肾阳不足、精血虚亏、阳痿早泄、宫寒不孕、头晕耳鸣、腰膝酸软、四肢冷、溃疡久不愈合等[5]。睾丸间质细胞为睾丸间质内部的内分泌细胞,其功能主要是分泌睾酮,分泌的睾酮含量占睾酮总量的95%[6]。通过睾丸间质细胞分泌睾酮的能力和增殖能力可以表现出其改善雄激素的分泌量和调节生理机能的能力[7],故鹿茸的壮肾阳、益精血功效与睾酮分泌的水平是有着密切的关联。
电喷雾电离串联质谱技术是一种软电离技术[8],为天然产物结构研究的重要手段[9]。直接进样电喷雾串联质谱法只需要很少的样品量,并且不需要对被分析物进行分离处理,节省了分析步骤,提高了检测效率。如能将其与化学计量学方法结合应用,就可将被分析中药等复杂体系中化学成分组成及结构与其对应活性相关联,从而达到快速筛选活性成分的目的[10]。本研究利用电喷雾质谱法对鹿茸鲜品和传统加工品的化学成分进行分析,结合化学计量法对所获得的电喷雾质谱指纹图谱及其促睾丸间质细胞分泌睾酮的活性数据进行分析[11],快速筛选分析出鹿茸中具有促睾丸间质细胞分泌睾酮的可能活性成分及其结构,为进一步探寻鹿茸促睾丸间质细胞分泌睾酮研究提供依据。
1 材料与方法
1.1 原料
1.1.1 样品与试剂
鹿茸样品采购于吉林省东丰鹿场;乙腈、甲醇和甲酸(色谱纯),美国Fisher公司;超纯水,美国Milli-Q纯水仪;四甲基偶氮唑盐(MTT),美国Amresco公司;DMEM培养基,美国Gibco公司,其它试剂为分析纯,北京化工厂。
1.1.2 仪器与设备
6320 ion-trap电喷雾离子阱质谱,美国Agilent公司;KQ3200BE超声波清洗器,中国昆山市超声仪有限公司;Model680型酶标仪,日本TAKARA公司;TGL-16B台式离心机,中国上海安亭科学仪器有限公司;BP211D型十万分之一电子天平,北京赛多利斯天平有限公司;GZLY-0.4型药用真空冷冻干燥机,北京速原中天科技有限公司;MiliQ超纯水器,美国密理博公司;Millipore微滤仪,美国Millipore公司;HH-6型数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司。
1.2 方法
1.2.1 样品制备
将新鲜二杠鹿茸用酒精灯火燎去毛,纵向切成 2份,其中1份用保鲜膜将其断面包裹,用于传统加工,1份作为鲜品。
传统加工:先将包裹好的鹿茸放入沸水中进行煮炸,每次1 min;煮炸5次,每次煮炸后将连有氮气的16号针头插入到包裹好的茸尖端进行排血,最后一次煮炸排血后放入70 ℃的烘箱中烘烤8 h,取出切成小块,水洗5次,将加工后的样品装袋并保存于4 ℃的恒温冰箱中贮藏备用[12]。
取制备好的鹿茸鲜品以及加工品各 20 g,以 10倍量的水进行组织粉碎,在4 ℃下浸提24 h。取出离心(3600 r/min,10 min),上清液进行微滤,将微滤液冻干,备用。
称取上述样品冻干粉各1 mg,以70%甲醇溶解并定容至1 mL,12000 r/min离心10 min,取上清液,用0.45 μm的醇膜过滤,滤液用于电喷雾质谱分析。
1.2.2 测定条件
质量范围m/z:200~500,实验前质量数经过校正;目标分子量:400;采用正离子模式。样品由流动注射泵进样,流速:5 μL/min;干燥气温度:350 ℃;干燥气流量:9 mL/min;雾化气压强:0.24 MPA(35.0 psi);毛细管电压:3.5 kV。
1.2.3 睾丸间质细胞的分离培养
取SD雄性成年大鼠体重250~300 g,随机分组。大鼠断颈处死,剖开腹腔剥离取出睾丸,放入Type I胶原酶中,37 ℃恒温振荡器中振荡消化30 min,用3倍体积 DMEM 稀释终止消化。过滤、离心后制成悬浮液,吸出后接种于培养瓶中,放于37 ℃ CO2孵箱中培养[13]。
1.2.4 ELISA法测定睾丸间质细胞分泌的睾酮含量[14]
在96孔板中接种密度为105个/mL细胞悬液,100 μL/孔,培养2 d,吸去培养液。样品组每组分别加入供试品溶液 50 μg/mL、100 μg/mL、200 (μg/mL)/孔;阳性组加入含人绒毛膜促性腺激素(HCG)的DMEM/F12培养液(含HCG终浓度为1 U/mL)100 μL;空白对照组加入DMEM/F12培养液100 μL;每组分别设3个复孔。处于37 ℃、5% CO2条件下培养24 h后,向预先包被有大鼠睾酮单克隆抗体的酶标板中加入不同浓度的标准品及样品。然后加入生物素标记二抗和酶标试剂,在37 ℃条件下反应60 min形成免疫复合物。用洗涤液洗板5次后除去未结合的酶,再加入底物A、B,37 ℃条件下显色10 min。加入终止液,在10 min内测定450 nm下的吸光值[15]。
1.2.5 数据分析
采用SIMCA-P 14.1软件进行主成分分析(PCA)、偏最小二乘法判别分析(PLS-DA)、正交偏最小二乘法判别分析(OPLS-DA)和偏最小二乘分析(PLS);采用Excel进行灰色关联度分析(GRA)。
2 结果与分析
2.1 鹿茸鲜品和加工品中化学成分的电喷雾质谱分析
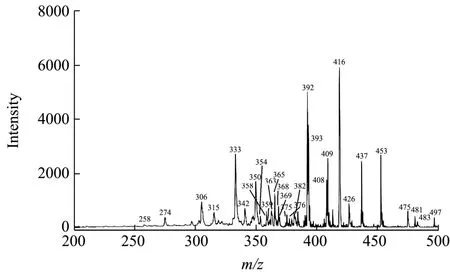
图1 鹿茸鲜品电喷雾质谱指纹图谱Fig.1 Electrospray mass spectrometry fingerprint of antler fresh products
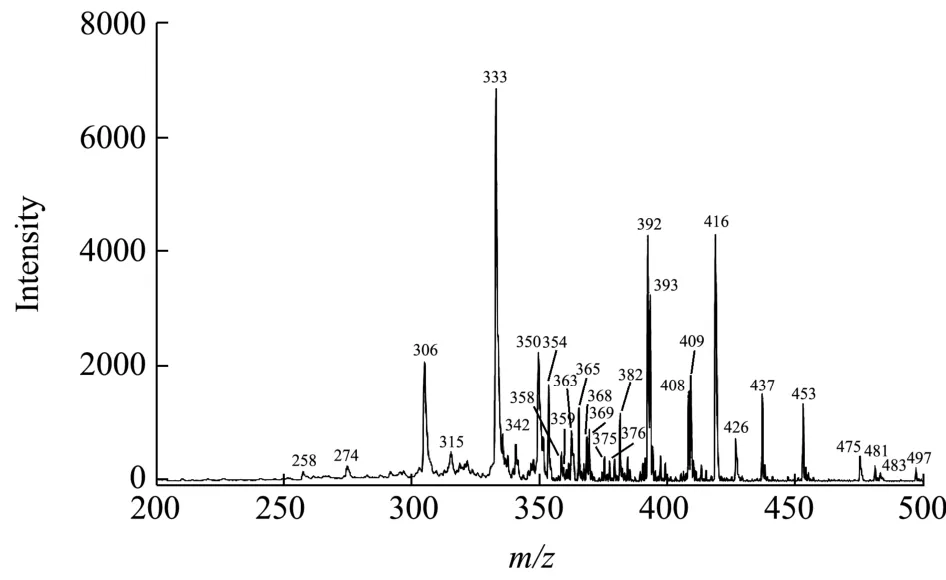
图2 鹿茸加工品电喷雾质谱指纹图谱Fig.2 Electrospray mass spectrometry of pilose antler processed products
采用正离子扫描模式,在优化的 ESI-MS/MS条件下对鹿茸鲜品和加工品进行质谱分析,得到其一级质谱指纹谱图。
2.2 睾丸间质细胞分泌的睾酮含量
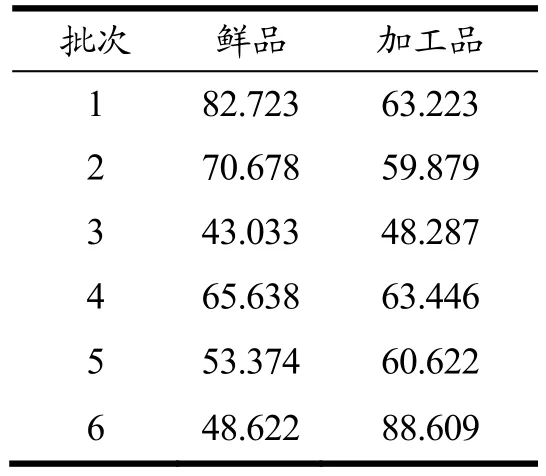
表1 睾丸间质细胞分泌睾酮含量(%)Table 1 Contents of testosterone secreted by testicular stromal cells (%)
实验室前期研究不同批次鹿茸鲜品和加工品中的氨基酸组成、含量以及睾酮分泌活性进行测定,基于此发现了鹿茸加工前后特征性的差异氨基酸成分。但鹿茸的药效物质基础主要为多肽类成分,仅仅以氨基酸作为指标性成分,无法有效的筛选鹿茸中促睾酮分泌的活性成分。因此在前期活性数据基础上结合基于ESI-MS/MS技术的鹿茸全成分的分析结果,更准确有效的筛选活性成分[16]。
2.3 鹿茸鲜品和加工品电喷雾质谱指纹图谱的多元统计分析
将每个样品质谱数据m/z200~500范围内的质谱峰丰度作为变量,应用SIMCA14.1软件对每个导出的一级质谱数据进行PCA分析,所得结果见图3。图中每个点代表1个样本,鹿茸鲜品与加工品之间在一定程度上具有差异性。但PCA分析不能忽略组内误差,不能消除与研究目的无关的随机误差。因此采用有监督的OPLS-DA可降低组内差异,突出组间变异规律[17,18]。而OPLS-DA的使用必须以PLS-DA模型通过验证为基础。
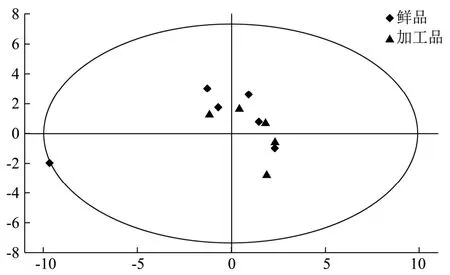
图3 鹿茸鲜品与加工品的PCA得分散点图Fig.3 PCA distribution of antler fresh and processed products

图4 鹿茸鲜品与加工品的PLS-DA 模型验证图Fig.4 PlS-DA model verification diagram of antler fresh products and processed products

图5 鹿茸鲜品与加工品的OPLS-DA得分散点图Fig.5 OPLS-DA scatter plot of fresh antler and processed products
图4显示PLS-DA模型的拟合程度良好,左端任何一次随机排列产生的R2(0.621)和Q2(-0.115)值均小于右端的原始值,表明原始模型的预测能力较任何一次随机排列y变量的预测能力都大,即模型有效。
OPLS-DA分析能够将组间差异最大化,由图5可以看出鹿茸鲜品与加工品明显分为两类,得到良好区分,表明加工前后的鹿茸存在差异。同时采用VIP值的大小来筛选差异较大的成分,VIP值>1的变量能够对样品的分类起关键性作用。由表2分析可知m/z258、409、416、408、426、375、315、392、483、393、354、453和437可以作为鹿茸鲜品与加工品主要差异性成分。
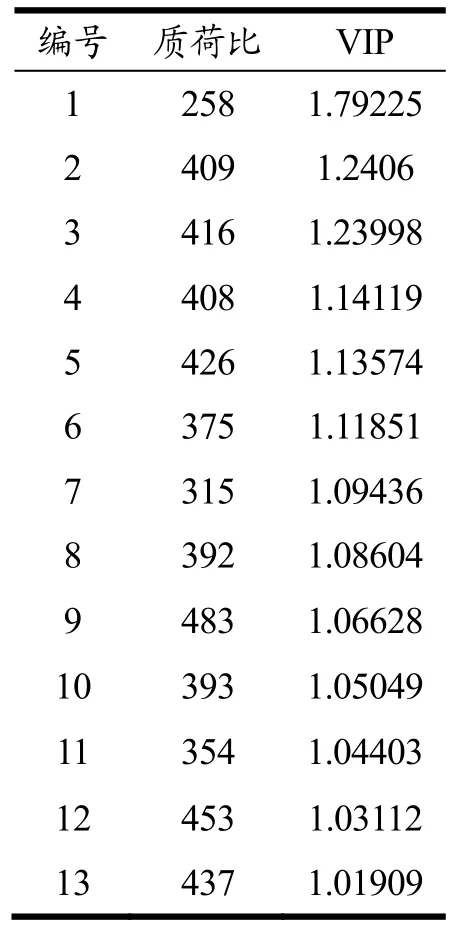
表2 鹿茸鲜品与加工品的OPLS-DA VIP贡献值(VIP>1)Table 2 Opls-da VIP contribution value of velvet antler fresh products and processed products (VIP>1)
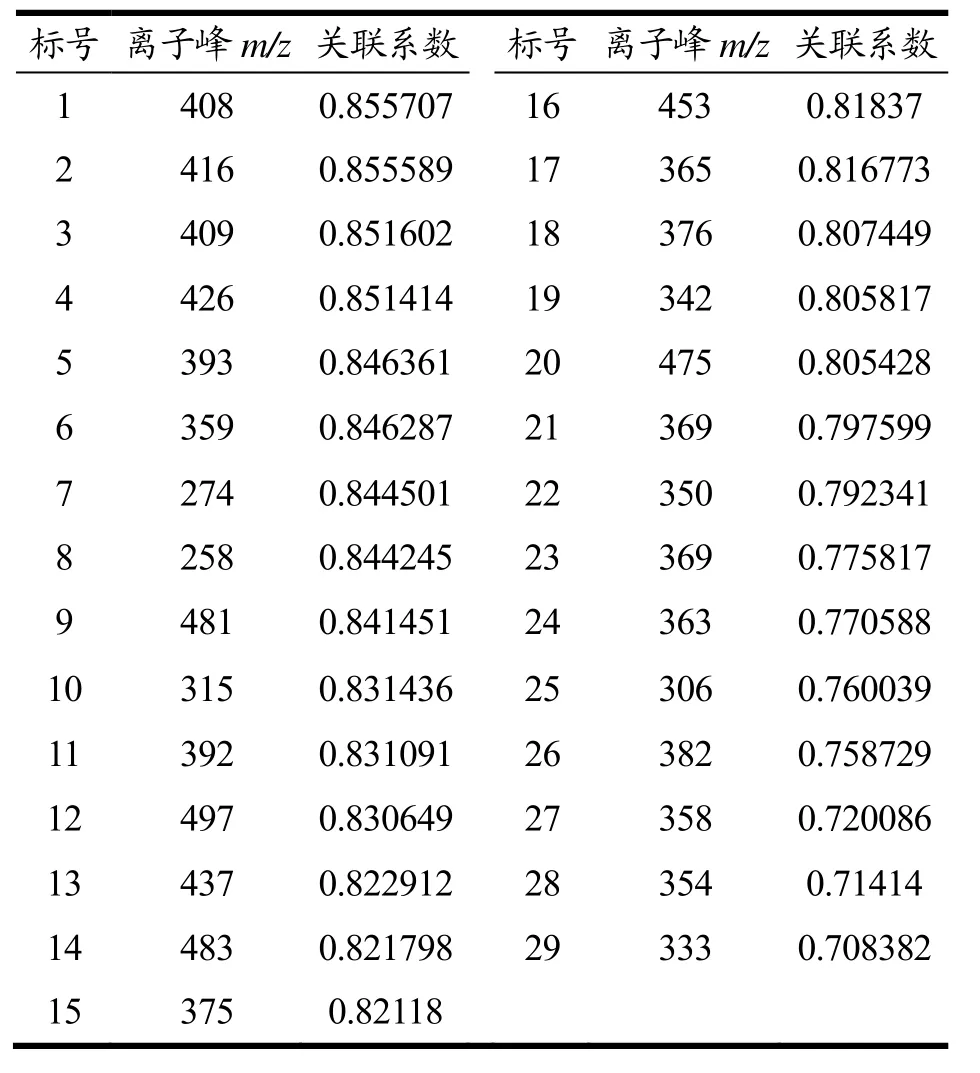
表3 各离子峰对促促睾酮分泌活性贡献关联度Table 3 Correlation degree of contribution of each ion peak to the activity of promoting testosterone secretion
2.4 鹿茸鲜品和加工品电喷雾质谱指纹图谱与促睾酮分泌活性的灰色关联度分析
灰色关联分析的目的是确定参考序列和若干个比较序列之间的关联系数和关联度,寻求系统中各个因素间的主要关系[19]。通过对原始数据标准化转化后,计算灰色关联度。所得关联度见表3,依据关联性的大小,确定各成分对促睾酮分泌作用贡献的大小顺序为:m/z408>416>409>426>393>359>274>258>481>315>392>497>437>483>375>453>365>376>342>475>368>350>369>363>306>382>358>354>333。其中4个离子峰所代表的化学成分与促睾酮分泌活性的关联度>0.85,但与其它离子峰的关联度差别不明显,因此,鹿茸的促 Leydig细胞睾酮分泌作用是由多组分共同发挥作用的结果。
2.5 鹿茸鲜品和加工品电喷雾质谱指纹图谱与促睾酮分泌活性的偏最小二乘法分析
偏最小二乘法(PLS)是一种高效的统计回归技术,适用于基因组和蛋白质组学数据的分析[20]。利用SIMCA14.1软件,经过多次提取主成分,多次迭代,拟合出鹿茸鲜品和加工品的电喷雾质谱一级质谱中共有离子峰丰度数据与促睾酮分泌活性数据之间的数理方程:Y=0.0600106X258+0.0781771X274-0.086587X306+0.113733X315-0.0797819X333+0.0968694X342-0.0432387X350+0.0388062X354-0.0576641X358+0.00138796X359-0.0175176X363-0.062117X365+0.041837 X368+0.052248X369-0.0666202X375+0.0339687X376+0.0597742X382-0.0131358X392+0.00365154X393+0.0131067X408+0.0275998X409+0.0854705X416+0.0868593X426+0.0721696X437+0.0808682X453+0.0650291X475+0.0585195X481+0.0607728X483+0.061128X497,各离子峰所代表的化学成分对对促睾酮分泌活性贡献大小顺序为:m/z315>342>426>306>416>453>333>274>437>375>475>365>497>483>258>382>481>358>369>350>369>354>376>409>363>392>408>393>359,其中m/z258、274、315、342、354、359、368、369、376、382、393、408、409、416、426、437、453、475、481、483和497与活性呈正相关,而m/z306、333、350、358、363、365、375和 392与活性呈负相关。
2.6 促睾酮分泌活性成分结构分析
综合灰色关联度分析和偏最小二乘法分析结果,可以发现对促睾酮分泌活性贡献最大的前5位离子峰有2个是重合的,分别是m/z416和426,同时与活性呈正相关,因此重点对这两个离子峰所代表的化学成分的结构进行分析。
2.6.1m/z416二级质谱分析
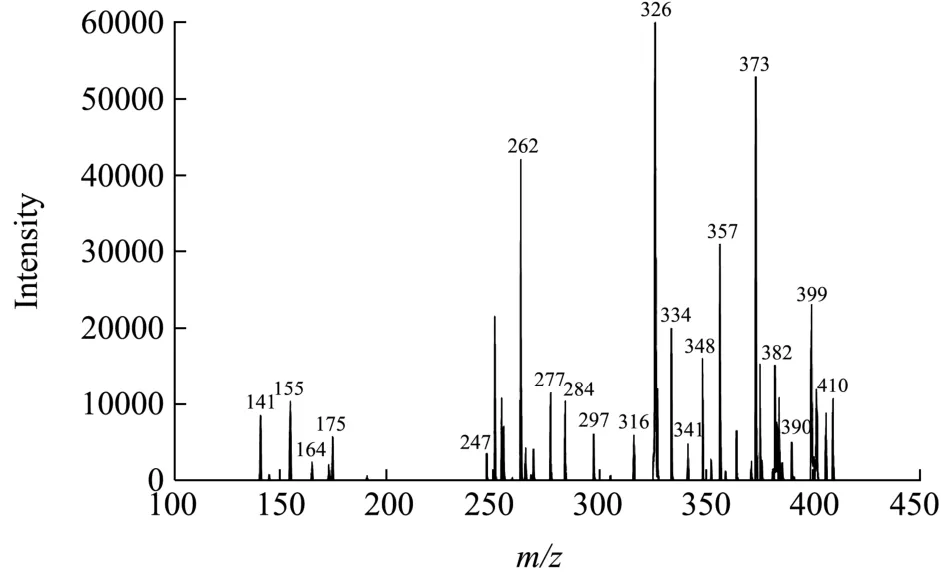
图6 m/z 416二级质谱图Fig.6 Secondary mass spectrometry of m/z 416
二级质谱图中m/z416为[M+H]+离子峰,说明其分子量为415。在电子碰撞解离过程中,[M+H]+脱去一分子H2O产生m/z398,[M+H]+,酰胺键断裂后电荷保留于N-端形成的b碎片离子,m/z值(b1:164,b2:251),在二级质谱中从肽链C端被以此轰击下来片段的m/z值为87(b2-b1),其对应的氨基酸残基为Ser(105-H2O),b1碎片(m/z:164)对应的氨基酸离子为 Tyr(181-NH3),[M+H]+(m/z:416)离子失去一分子Phe(165)生成b2离子(m/z:251);所以,m/z为416的肽离子氨基酸序列应为Tyr-Ser-Phe。
2.6.2m/z426二级质谱分析
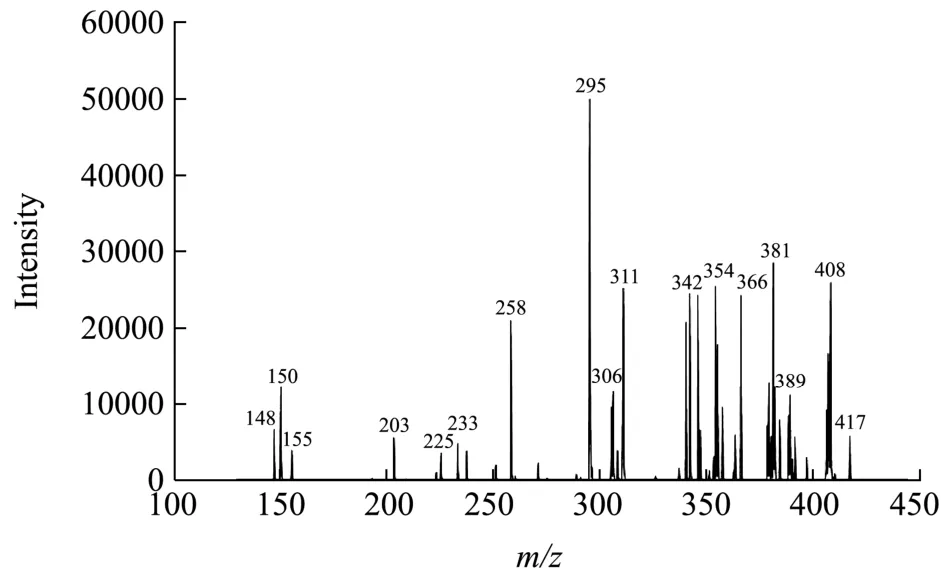
图7 m/z 426二级质谱图Fig.7 Secondary mass spectrometry of m/z 426
二级质谱图中m/z426为[M+H]+离子峰,说明其分子量为425。在电子碰撞解离过程中,[M+H]+脱去一分子H2O产生m/z408,酰胺键断裂后电荷保留于N-端形成的 b 碎片离子m/z值(b1:148,b2:295),在二级质谱中从肽链C端被以此轰击下来片段的m/z值为 147(b2-b1),其对应的氨基酸残基为 Phe(165-H2O),b1碎片(m/z:148)对应的氨基酸离子为 Asn(165-NH3),[M+H]+(m/z:426)离子失去一分子Leu(131)生成b2离子(m/z:295),由于质谱无法区分Leu和Ile,因此Leu也可能为Ile,故m/z为 426的肽离子氨基酸序列应为 Phe-Phe-Ile或Phe-Phe-Leu。
3 讨论
鹿茸作为我国传统中药保健食品,具有壮肾阳,益精血,增强免疫力,抗衰老等功效[21]。在鹿茸的众多成分中,主要的活性成分为鹿茸多肽,鹿茸多肽具有促进生殖功能、保护神经、增强免疫力、保护心肌损伤、保护肝损伤、对组织创伤修复等功效[22]。杨若明等[23]通过观察麋鹿茸对大鼠生殖系统的影响,结果发现麋鹿茸提取液具有明显促进雌鼠生殖系统发育的作用。傅雷等[24]研究发现随着鹿茸多肽含量的增加,鹿茸多肽可以促进小鼠子宫的生长发育,且与剂量呈正相关。程津津等[25]通过不同分组小鼠灌胃发现不同剂量的鹿茸可使子宫和阴道器官的脏器指数以及雌二醇水平有所提高,说明鹿茸具有雌激素的作用。孙慧等[16]对鹿茸中的氨基酸组成进行分析,确定谷氨酸可作为鹿茸加工品质量控制的指标性成分之一。多肽类成分作为鹿茸的主要药效物质基础,本文针对此类物质探索鹿茸对睾丸间质细胞的影响。
对鹿茸的研究分析方法多采用紫外分光光度法、红外光谱法、薄层色谱法、高效液相色谱法等[26],而ESI-MS/MS作为一种软电离技术,进样量少,且无需分离处理样品,简单快速。本研究利用 ESI-MS/MS对鹿茸加工前后的样品进行质谱分析,结合多元统计分析对所获得的指纹图谱数据进行处理,能够很好的区分开鹿茸鲜品和传统加工品,并筛选出m/z258、409、416、408、426、375、315、392、483、393、354、453和437的肽类成分可以作为鹿茸鲜品与加工品主要差异性物质,为鹿茸传统加工品的鉴定提供了新的思路和方法。
4 结论
应用偏最小二乘法(PLS)和灰色关联度分析(GRA)对所获得的一级质谱数据进行处理,快速筛选出具有促大鼠睾丸间质细胞分泌睾酮的可能成分。值得注意的是,通过与鹿茸加工前后一级谱数据多元统计分析结果筛选出的差异性成分相对照可以发现m/z416和m/z426均为排名靠前的差异性成分,根据二级质谱数据对2个可能活性成分进行解析,其结构分别为Tyr-Ser-Phe(m/z416)和Phe-Phe-Leu/Ile(m/z426)。本研究推测出的活性成分为具有对活性正向影响的化合物,且排序靠前,关于排序靠后以及负向影响的化合物的结构及其活性还需进一步深入的研究。

