猪十二指肠组织灌流培养与静态培养比较
王绿阳 康翠翠 冯江银 丁立人 杭苏琴
(1. 南京农业大学国家动物消化道营养国际联合研究中心 江苏省消化道营养与动物健康重点实验室 消化道微生物研究室,南京 210095;2. 南京农业大学动物科学类国家级实验教学示范中心,南京 210095)
胃肠道受到营养物质刺激后能够分泌一系列胃肠激素调节机体的食欲、消化吸收和代谢等[1],因此近年来被广泛研究。目前研究胃肠激素分泌的模型包括内分泌细胞系、体外肠道灌流、肠道组织培养、转基因动物和超高显微镜的使用等[2]。其中,肠道组织培养因样本易获取、操作方便快捷而被广泛应用。相比于内分泌细胞系培养,肠道组织培养能够保证细胞所处的环境基本保持完整,并能保留细胞极性[3]。同时,它可以用来研究营养物质对胃肠激素分泌的影响及机制,因此被认为是研究胃肠激素分泌的一种有效的方法。
目前,组织灌流培养和组织静态培养是肠道组织培养中最常见的两种方法。其中,灌流能使培养物处于不断更新的环境中,从而消除了细胞代谢产物及激素的反馈作用,并能使培养物接受不同频率、强度和时间的刺激处理,故适于研究激素释放动力学及分泌和调节机制的研究[4]。但相比于静态培养系统,组织灌流培养可能会抑制组织和培养液之间大分子物质的相互交换[5]。这两种组织培养方法各有利弊,但目前对于它们在胃肠激素分泌中的比较研究还未见报道。同时,目前哺乳动物肠道组织培养的形式主要是组织块培养和机械破碎培养[6-7],不同组织形态对胃肠激素分泌影响的研究也有待探讨。
因此,本研究以猪十二指肠组织为研究材料,选用L- 精氨酸(L-arginine,L-Arg)作为刺激物[8-9]首先比较不同组织形态对胆囊收缩素(Cholecystokinin,CCK)的影响,确定适用于研究激素分泌的组织形态。在此基础上通过检测培养液CCK 和乳酸脱氢酶(Lactate dehydrogenase,LDH)的水平,比较体外组织灌流培养与静态培养对组织激素分泌和活性的影响。最后,通过在体十二指肠灌注实验比较体内外CCK 分泌的差异,进一步确定更适合用于体外胃肠激素分泌研究的方法。该研究将为选取合适的方法进行体外胃肠激素的研究提供参考依据。
1 材料与方法
1.1 材料
L-精氨酸(A0013,纯度≥99.0%)购自索莱宝科技(中国,北京),KHB 溶液(4.02 mmol/L KCl,136.87 mmol/L NaCl,1.5 mmol/L CaCl2,2.10 mmol/L MgCl2,25.18 mmol/L HEPES,pH = 7.2-7.4),0.01 mol/L PBS(135 mmol/L NaCl,8 mmol/L K2HPO4,2.7 mmol/L KCl,1.5 mmol/L KH2PO4,pH = 7.2),生理盐水,细胞培养板(12 孔),5 mL 真空采血管EDTA-K2(YA1291)购自索莱宝科技(北京)。
1.2 方法
1.2.1 样品的采集及处理 猪十二指肠组织均采集于江苏省南京市某屠宰场,均为体重100-130 kg 的杜×长×大商品猪。屠宰后,立即采集长约6 cm的近端十二指肠,放置于充满95% O2和5% CO2的预冷的KHB 缓冲液中,于1 h 内送至实验室。到达实验室后,立即将组织置于无菌操作台中,按照Wang 等[9]的描述,剪取长4 cm 左右的肠段,除去肠系脂肪并剥离组织层后,立即剖开并用预冷的0.01 mol/L PBS 溶液漂洗组织,无菌条件下利用打孔器剪取直径8 mm 大小的组织用于组织完整培养。在此基础上进一步剪碎使其直径小于1 mm 用于组织剪碎培养。每3 块组织块(直径8 mm 或1 mm,来自3 头猪)分别装进组织灌流系统的若干尼龙袋内或者每孔细胞培养板内。每次试验中所用到的样品至少来自于3 头猪的十二指肠组织,试验之间的十二指肠组织切割部位及长度基本保持一致。
1.2.2 十二指肠组织灌流培养 利用本实验室已建立并运行的表面灌流系统进行组织灌流实验,详见Zhao 等[8]的描述。在此基础上,根据需要将灌流小室由5 mL 注射器改换为2 mL。试验开始前,通过蠕动泵将含有95% O2和5% CO2气体的KHB 溶液引入到灌流小室,水浴锅预热使灌流小室液体温度达到37℃。猪十二指肠组织制备好后,放入灌流小室,调节蠕动泵速率为6 mL/h,用KHB 溶液预灌流30 min 使所有组织处于同一状态。之后,将KHB 溶液更换为含有0、10、20 及50 mmol/L L-Arg 的KHB溶液进行正式组织灌流培养试验。试验结束收集的培养液4℃,10 000 r/min 离心5 min,并收集上清液放入-20℃以下进行后续CCK 和LDH 的测定。
1.2.3 十二指肠组织静态培养 将组织放入每孔含有2 mL KHB 溶液的12 孔细胞培养板,放入细胞培养箱(95% O2,5% CO2)进行30 min 预培养。之后,将KHB 溶液含有0、10、20 及50 mmo/L L-Arg 的KHB 溶液(每孔2 mL)。试验结束收集的培养液4℃,10 000 r/min 离心5 min,并收集上清液-20℃保存,用于后续CCK 和LDH 的测定。
1.2.4 体内十二指肠灌注实验 选取体重相近(25±0.2)kg、安装十二指肠T 型瘘管的42 日龄杜×长×大三元杂交保育猪6 头,隔夜禁食。实验前将其麻醉。按照Steinert 等[10-11]的描述,将6.75 g L-Arg 溶进240 mL 生理盐水(0.45 kcal/min,1 g 氨基酸提供4 kcal 热量),利用本实验室的蠕动泵,以4 mL/min 的速度向十二指肠灌注L-Arg 溶液。其中,-15 min 至0 min 灌注生理盐水,自0 min 开始灌注L-Arg 溶液,每10 min 于耳缘静脉采血(图1)。血液4℃,3 000 r/min 离心15 min,收集上清液-80℃保存,用于后续CCK 浓度的测定。

图1 体内十二指肠灌注实验程序图
1.2.5 指标测定
1.2.5.1 激素测定 利用猪胆囊收缩素酶联免疫吸附试验试剂盒(ANG-31022P,南京奥青)检测培养液上清CCK 的浓度。CCK 试剂盒检测浓度范围为10-200 ng/L,批间变异系数< 15%,批内变异系数< 9%。
1.2.5.2 组织活力检测 利用乳酸脱氢酶试剂盒(A020-2,南京建成)检测培养液上清LDH 的浓度。
1.2.6 数据统计分析 数据经Excel 2016 处理后,采用SPSS 23.0 软件单因素方差分析模型(One-way ANOVA)中的Turkey test 进行多重比较,P< 0.05代表差异显著。试验结果均以平均数±标准误表示。
2 结果
2.1 组织灌流培养对CCK分泌的影响
由图2 可知,与0 mmol/L L-Arg 组相比,20 和50 mmol/L L-Arg 均显著刺激猪十二指肠组织分泌CCK(P<0.05),而10 mmol/L L-Arg 对CCK 的分泌无显著影响(P>0.05)。此外,不同浓度L-Arg 刺激下,组织机械破碎培养CCK 的分泌均显著低于组织块培养。结果表明,组织形态影响组织灌流培养时CCK的分泌。

图2 组织灌流培养对CCK 分泌的影响
2.2 静态组织培养对CCK分泌的影响
由图3 可知,与0 mmol/L L-Arg 组相比,10、20 和50 mmol/L L-Arg 均刺激猪十二指肠组织分泌CCK(P<0.05)。此外,不同浓度L-Arg 刺激下,组织机械破碎培养CCK 的分泌均显著低于组织块培养(P<0.05),说明组织形态影响组织静态培养时CCK的分泌。
2.3 不同培养方式下组织CCK分泌的动态过程
根据图2 和图3 可知,组织灌流培养与静态培养中显著刺激CCK 分泌所需L-Arg 的浓度不同。故进一步观测1 h 内CCK 分泌的动态变化。由图4 可知,与0 min 相比,组织灌流培养下CCK 浓度在10 min 达到显著水平(P<0.05),之后随时间增长呈平稳波动;而静态培养条件下CCK 浓度在20 min 时达到显著水平(P<0.05),并随时间增长呈累积效应。结果表明,这两种不同组织培养方法影响CCK 的变化水平。
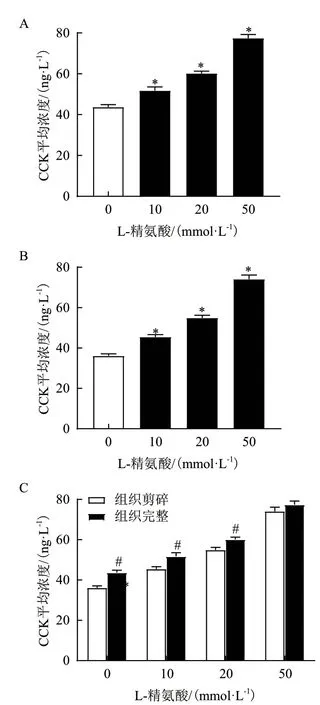
图3 组织静态培养对CCK 分泌的影响

图4 不同培养方式下CCK 的分泌过程
2.4 不同培养方式下LDH分泌的动态过程
由图5 可知,在1 h 的培养过程中,组织灌流培养的LDH 浓度随时间增长而逐渐降低,而组织静态培养的LDH 浓度则逐渐升高。结果表明,这两种不同组织培养方法影响培养液LDH 的水平。

图5 不同培养方式下LDH 分泌的动态过程
2.5 体内灌流实验中血浆CCK分泌的动态过程
由图6 可知,与0 min 相比,血液CCK 浓度在20 min 时显著升高(P<0.05),之后随时间增长呈平稳波动。
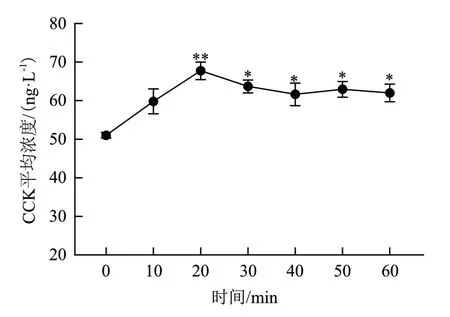
图6 体内灌流实验中血浆CCK 分泌的动态过程
3 讨论
体外组织灌流培养作为离体组织动态培养的一种方法,近年来在内分泌研究中得到广泛应用。例如,Callwaere 等[12]利用体外灌流系统研究趋化因子SDF-1(Stromal cell-derived factor 1)对下丘脑抗利尿激素释放的影响。本实验室利用建立的体外组织灌流培养系统,研究了不同氨基酸包括L-Phe、L-Trp 和L-Arg 等对胃肠激素如CCK、生长抑素(Somatostatin,SS) 和抑胃肽(Gastric inhibitory peptide,GIP)等分泌的影响及潜在机制[9,13-14]。近来,Le Thuc 等[15]又建立了一种体外组织灌流系统用于研究下丘脑神经肽的释放。研究表明,体外组织灌流培养已被广泛用于激素分泌的研究。相比于组织灌流培养,组织静态培养也是一种研究激素分泌的有效方法。例如,Voortman[16]和Tian 等[17]分别利用该方法研究了脂肪酸和支链氨基酸对胃肠激素分泌的影响。
体外培养组织时对组织的处理方法并不一致,因此本研究首先比较了不同组织形态对CCK 分泌的影响。结果表明,无论是组织灌流培养还是组织静态培养,机械破碎法处理的组织分泌CCK 的能力均显著降低,这可能是因为机械破碎法对细胞结构的损伤大[18],使得一些内分泌细胞被破坏而削弱了组织分泌激素的能力。因此,机械破碎法不适合用于胃肠激素分泌的研究。但是,机械破碎法是分离和培养奶牛乳腺上皮细胞的有效方法[19-20]。与组织块培养法相比,机械破碎法显著缩短了乳腺上皮细胞培养时间,且细胞增殖旺盛、杂质细胞少、迁出速度快。因此,不同实验具有不同的特点,需要根据实验需要选择合适的组织处理方法。
此外,本研究发现组织灌流培养和静态培养中CCK 分泌达到显著水平所需的L-Arg 浓度不同(分别为20 mmol/L 和10 mmol/L)。研究表明,L-Arg 刺激CCK 的分泌主要是由胃肠道内分泌细胞膜上的G 蛋白偶联型受体及胞内的一系列信号分子所介导[21]。其中,Wang 等[9]发现钙敏感受体(Calcium sensing receptor,CaSR)以及下游的磷脂酶C(Phospholipase C,PLC)和腺苷酸环化酶(Adenylate cyclase,AC)共同参与L-Arg 刺激猪十二指肠CCK分泌的过程。同时,10 mmol/L L-Arg 可以显著刺激小鼠结肠L 细胞分泌胃肠激素胰高血糖素样肽-1(Glucagon-like peptide 1,GLP-1)和酪酪肽(Peptide YY,PYY)[22],因此推测L-Arg 刺激胃肠激素分泌的最低浓度可能是10 mmol/L。为解释不同培养方法中CCK 显著分泌所需L-Arg 浓度的差异,本研究进一步检测1 h 内CCK 分泌的动态变化。发现组织灌流培养中CCK 浓度在10 min 达到显著水平,之后随时间增长呈波动变化;而静态培养条件中CCK 浓度在20 min 时达到显著水平,并随时间增长呈累积效应。这可能与培养系统中培养液流动与否有关。本实验中组织灌流速度为6 mL/h,该速度与前人研究一致[14-15],说明该速度适用于组织灌流培养。但有研究表明,8 mL/h 的速度灌流培养奶牛乳腺上皮细胞,细胞活力显著低于4 mL/h 和2 mL/h[23],这可能与试验所用组织部位不同有关。此外,由于灌流培养能够及时更新细胞培养液并排出有毒代谢产物,近年来该方法也被用于细胞培养的研究[24]。
LDH 是代表组织损伤程度的一个重要指标。作为胞内的酶,正常情况下由于细胞膜的屏障作用不易逸出;但当细胞受损时,细胞膜通透性会增加导致胞内LDH 释放到培养液中[25]。本研究发现,组织灌流培养的LDH 浓度随时间增长而逐渐降低,而组织静态培养的LDH 浓度则逐渐升高,这表明组织灌流培养更能保存组织的活性。但是,两种培养方式下所用的L-Arg 浓度不同(分别为20 mmol/L 和10 mmol/L)因此L-Arg 浓度可能也是影响组织LDH分泌的因素之一。研究表明,这两种培养方式均能够在短时间培养中保存肠道组织的活性,但相比于静态培养,组织灌流培养更能保存组织的活性与完整性[26]。
体外实验模型都是为了尽可能地接近和模拟体内的环境。因此,进一步利用猪在体十二指肠灌注L-Arg,检测血液CCK 分泌的动态变化,比较十二指肠组织体外与体内CCK 分泌的异同。由于无法确定猪十二指肠L-Arg 的浓度范围,同时考虑到体内环境的复杂性,故无法直接根据体外试验的L-Arg浓度进行在体十二指肠灌注。但有研究显示,摄食后每小时大约有200 kcal 的热量到达十二指肠[27],因此根据营养素的热量开展实验更合适。考虑到猪和人胃肠道的生理具有很高的相似性[28],因此本研究根据Steinert 等[10-11]对人体十二指肠氨基酸灌注的描述开展体内实验。在1 h 的灌注过程中,血液CCK 浓度在20 min 时显著升高,之后随时间增长呈波动变化。这与人体十二指肠氨基酸灌注引起的CCK 的分泌过程相似[10],同时也与本研究的组织灌流培养中CCK 的变化非常相似。这表明组织灌流培养在一定程度上可以反映体内CCK 的分泌过程。同时组织静态培养中CCK 浓度所呈累积式增长能反映一定时间内组织分泌激素的总水平。因此根据实验目的可以选择不同的实验方法。
4 结论
本研究首先通过比较组织块和剪碎两种培养形态对CCK 分泌的影响,证明组织块更适用于研究CCK 的分泌。在此基础上通过体内外试验比较组织灌流培养和静态培养对十二指肠CCK 分泌和组织活性的影响。结果表明,组织灌流培养在一定程度上更符合体内CCK 的分泌过程,而且更能保存组织的活性;但组织静态培养更能一定程度上反映组织激素分泌的总水平。因此,需要根据实验目的选择合适的组织体外培养方法。