截断逆挽方对慢加急性肝衰竭大鼠cyclin D-E2F1信号通路及转录因子活化的机制研究
方娴 姜雪娇 侯伟欣 房鹏 张秋云
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是在引起急性肝损伤诱因的作用下,肝功能相对稳定的慢性肝病患者急速恶化并发生肝衰竭的综合征[1]。该病目前没有特异性治疗手段,临床上多以抗病毒、人工肝支持治疗,疗效不理想,短期病死率为50%~90%[2]。肝移植是目前唯一能提高患者长期生存率的手段,但由于肝源严重不足,故使用受限。ACLF的发病机制被认为可能与肝细胞大量凋亡和肝细胞再生障碍不足有关[3]。相关研究结果显示,ACLF患者肝脏中缺乏有效的肝细胞复制是其死亡率较高的原因之一[4],ACLF中肝祖细胞(hepatic progenitor cell,HPC)的激活能诱导肝脏进行再生二级反应,从而诱导肝细胞增殖,改善肝脏损伤,避免ACLF进一步恶化[5]。因此恢复肝脏的正常再生能力在急性发作期肝衰竭的治疗中具有广阔的前景。截断逆挽方是由全国名中医钱英教授创制的临床治疗ACLF的有效方剂,本课题组前期研究结果提示:本方能减轻ACLF模型大鼠肝组织炎性损伤、抑制肝细胞过度凋亡,并能预防给药后促进肝细胞代偿性增殖[6-7]。本研究在此基础上观察截断逆挽方对ACLF大鼠肝功能、凝血酶原活动度及肝脏病理的改善情况,考察肝细胞再生过程中的关键基因cyclin D1、cyclin D2、cyclin D3、细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4,CDK4)、CDK6及关键蛋白DP1表达量的影响,进一步探讨证核该方通过调节cyclinD-E2F1肝细胞增殖通路相关转录因子治疗ACLF大鼠肝损伤及修复机制。
1 材料与方法
1.1 实验动物
选用SPF级Wistar雄性大鼠105只,体重(180±20)g,由北京维通利华实验动物技术有限公司提供,动物许可证编号SCXK(京)2016-0006。饲养置首都医科大学动物房,相对恒温(25℃),恒湿(55%),每隔12小时光照明暗交替,每笼3只,自由摄食饮水。
1.2 干预治疗药物与主要试剂
截断逆挽方(组成:苦味叶下珠30 g、瓜蒌30 g、金钱草30 g、黄芪30 g、槲寄生30 g、三七6 g、生地黄20 g、莪术6 g、丹参20 g、炮附子先煎15 g)购于北京同仁堂中医医院中药房,根据课题组前期研究,水煎及浓缩至4.34 g/mL,保存于灭菌玻璃瓶内,4℃冰箱保存,使用前水浴加热。
人血清白蛋白(货号:A9731-5G,美国,Sigma);D-氨基半乳糖(货号:G0500-25G,美国,Sigma);脂多糖(货号:109K4075,美国,Sigma);Anti-DP1(美国,abcam);β-actin(美国,abcam);RNA Prep Pure动物组织总RNA提取试剂盒、TIAN Script cDNA、Real Master Mix(SYBR Green)均购于天根生化科技有限公司;引物序列cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6(TaKaRa)。
1.3 主要实验仪器
低温离心机(Hettich,Universal 320R);全自动多功能酶标仪(MULTISKAN MK3,美国Thermo);梯度RT PCR仪(Bio-Rad,美国);垂直电泳仪(Bio-Rad,美国);Fujifilm成像系统(LAS3000,日本);超细匀浆器(Fluko,F6/10);高速离心机(Sigma,1-14,美国);全自动生化分析仪(Hitachi,7600);凝血分析仪(Beckman Coulter,ACL-TOP700)。
1.4 实验方法
1.4.1 分组、ACLF大鼠模型的建立及给药 随机选择5只大鼠作为正常组,其余100只Wistar大鼠根据文献[8]方法建立ACLF大鼠模型,予皮下注射人血清白蛋白(human serum albumin,HSA)0.5 mL,4次后眼眶采血检测是否致敏,取人血白蛋白抗体阳性大鼠予尾静脉注射HSA,每只0.5 mL,一周两次,连续注射6周,正常组每次予等量生理盐水注射。随后对100只造模组大鼠行肝活检,取肝纤维化Ⅲ级以上大鼠继续尾静脉注射,2周后肝硬化模型成功60只。将60只同时予以D-氨基半乳糖(D-galactosamine,D-GalN)(400 mg/kg)联合脂多糖(lipopolysaccharide,LPS)(100 μg/kg)腹腔注射,死亡30只,最终ACLF大鼠成模30只。将30只成模大鼠分为截断逆挽方5、10、15天组及模型5、10、15天组,每组5只。截断逆挽方组在成模24小时后予截断逆挽方浓煎剂连续灌胃5、10、15天,1次/天,依照课题组前期研究将给药体积定为5 mL/kg,模型组与正常组予等量生理盐水,各组灌胃后于5、10、15天分别平行摘取右叶统一部份置10%福尔马林,其余肝组织剪碎于液氮中冻存,放入-80℃冰箱保存。
1.4.2 各组大鼠血浆凝血酶原活动度(prothrombinase activity ,PTA)、血清肝功能检测 大鼠腹主动脉取血12 mL,3 mL置于肝素钠抗凝管内,4℃,3000 r/min,离心20分钟分离血浆,静置1小时后于凝血分析仪检测血浆PTA,上层血清置于10 mL真空采血管全自动生化分析仪测定谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、总胆红素(total Bilirubin,TBIL)含量。
1.4.3 观察肝组织病理改变 每组选择5只大鼠取肝右叶相同部位组织,磷酸缓冲盐溶液涮洗后放置10%福尔马林溶液中固定12~24小时,进行石蜡包埋、切片、HE染色。Pannoramic scan全自动切片扫描仪进行明场下全幅图像扫描,利用CaseViewer2.3导出图片,观察各组大鼠肝组织的结构和病理改变。
1.4.4 Real-Time PCR法检测cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6 mRNA的表达 根据动物组织总RNA提取试剂盒的说明书骤将肝组织称量、裂解、研磨提取总RNA。取2 μL样品在酶标仪上检测其纯度及浓度,保留A260/A280在1.8~2.2的样品继续逆转录,方法依照cDNA第一链合成试剂盒说明书进行。将逆转录所得cDNA作为扩增模板,在反应体系中加入所得目的基因cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6和内参对照基因β-actin的引物,在反应条件为95℃(15分钟)、95℃(10秒)、60℃(20秒)、72℃(30秒)下循环40次进行目的基因的扩增。将该模板和内参的CT值拷贝并存为线性关系,数据采用2-△△CT法进行分析。各基因引物序列,详见表1。

表1 各基因引物序列
1.4.5 蛋白免疫印迹法检测各组组织DP1蛋白表达 -80℃冰箱取出肝组织,按比例加入配制好的蛋白裂解液(由蛋白提取液、蛋白酶抑制剂、PMSF按比例混合),充分匀浆。30分钟后,4℃,12000 r/min离心15分钟取上清液,按照BCA蛋白提取试剂盒说明书进行蛋白定量,并测定蛋白浓度,水浴至蛋白变性。每支取30 μg上样,进行SDS-PAGE电泳,将蛋白转膜至PVDF膜上,5%脱脂奶粉封闭1小时,一抗(1∶100)4℃过夜,TBST洗膜后,二抗(1∶10000)室温孵育1小时,洗膜后显影成像,Image J计算灰度值比值。
1.5 统计学处理
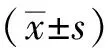
2 结果
2.1 截断逆挽方对各组大鼠血浆PTA检测结果比较
结果显示,与正常组相比,模型组大鼠血浆PTA随时间演进明显降低,且有显著差异(P<0.01),在15天时达到最低点。与同一时间模型组相较,截断逆挽方组大鼠血浆PTA均有上调趋势,且截断逆挽方10天、15天组差异明显(P<0.05)。结果见表2。
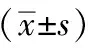
表2 截断逆挽方对各组大鼠血浆PTA结果比较
2.2 截断逆挽方对各组大鼠血清肝功能检测结果比较
结果显示,与正常组相较,模型组大鼠血清肝功能ALT、AST、TBIL随时间进展显著升高(P<0.01),符合ACLF大鼠模型表现。与同一时间模型组相较,截断逆挽方组血清ALT、AST、TBIL均有不同程度下调,且差异有统计学意义(P<0.05)。结果见表3。

表3 截断逆挽方对各组大鼠血清肝功能结果比较
2.3 截断逆挽方对各组大鼠肝组织HE染色病理的影响
正常组大鼠肝脏组织 HE 染色显示肝小叶结构清晰,汇管区形态完整,肝细胞排列整齐,细胞核居中,未见炎细胞浸润和间质反应性增生。模型5天组大鼠肝组织可见汇管区纤维组织增生,肝细胞胞浆疏松化气球样变,肝窦受压变窄,门管区和肝小叶内有不同程度的炎细胞浸润和嗜酸性小体形成,且肝细胞坏死灶随时间延长范围逐渐扩大。模型10天组可见点状、碎屑状坏死,库普弗细胞增生。模型15天组可见弥漫性大块坏死,纤维组织将肝小叶分割包绕成假小叶,纤维间隔变宽且薄厚不均,网状纤维支架塌陷。与同一时间点模型组相比,截断逆推方组肝组织损伤程度较轻,截断逆挽方10天组可见坏死细胞邻近有再生的肝细胞,核大且染色较深,假小叶内细胞排列较规则。截断逆挽方15天组可见大面积的肝细胞溶解但网状纤维支架尚存。见图1。
2.4 截断逆挽方对各组大鼠肝组织中cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6 mRNA表达的影响
PCR检测结果显示:与正常组相比,模型组5天组cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6 mRNA表达量升高,随着时间的进展,表达量逐渐降低,差异无统计学意义(P<0.05)。与同一时间模型组相比,截断逆挽方组cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6 mRNA表达量均有不同程度的上调,其中截断逆挽方10天组差异最为显著(P<0.01),且截断逆挽方15天组各基因表达量与正常组相比差异有统计学意义(P<0.05)。结果见表4。
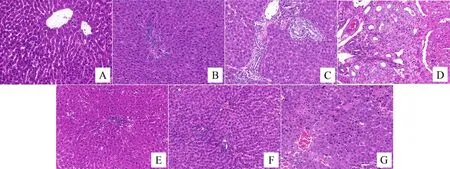
注:A:正常组;B:模型5天组;C:模型10天组;D模型15天组;E:截断逆挽方5天组;F:截断逆挽方10天组;G:截断逆挽方15天组。
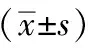
表4 截断逆挽方对各组大鼠cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6 mRNA的相对表达量
2.5 截断逆挽方对各组大鼠肝组织中DP1蛋白表达的影响
蛋白免疫印迹法检测结果显示,与正常组相较,模型5天组DP1蛋白表达升高,差异具有统计学意义(P<0.05),随时间进展模型组表达量呈逐渐降低趋势。与同一时间点模型组相较,截断逆挽方10天组DP1的表达量明显上调 (P<0.05),截断逆挽方15天组DP1的表达量较10天组有所降低,但与同一时间点的模型组比较差异仍然具有统计学意义(P<0.05)。结果见表5、图2。
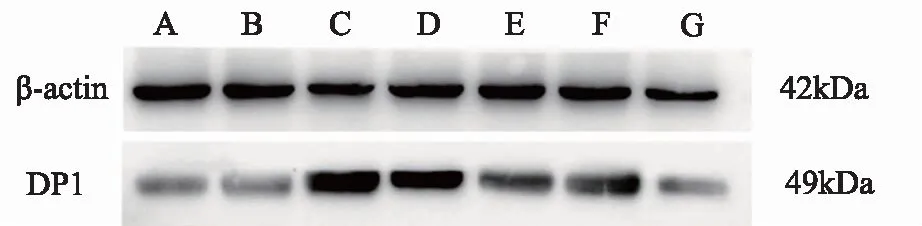
注:A:正常组;B: 截断逆挽方5天组;C: 截断逆挽方10天组;D:截断逆挽方15天组;E:模型5天组;F:模型10天组;G:模型15天组。

表5 截断逆挽方对各组大鼠DP1蛋白相对表达量灰度值比较
3 讨论
ACLF发病机制十分复杂,目前被认为其与机体内的特殊的免疫、炎症反应,免疫系统失衡等相关,受到损伤的肝细胞释放损伤相关模式分子,进一步释放促炎症因子等因素,造成肝脏过度的炎症反应导致肝细胞的过度凋亡[9]。但慢加急性肝衰竭具有潜在可逆性,有研究表明肝祖细胞与星状细胞存在显著相关性,具有干细胞功能所需的信号传导途径,可诱导肝细胞再生,逆转ACLF恶化[10]。
全国名中医钱英教授认为:ACLF的中医病机多为“湿热疫毒”损伤机体,充斥三焦,气机不畅,久则生瘀,肝络瘀阻,正虚邪陷,具有“毒瘀与正虚交织”的特点,并创立了截断逆挽方[11],意在清热祛湿、解毒散瘀以治标,调补肝脾肾以治本,扶正与祛邪并用,同调肝体与肝用。方中生黄芪、槲寄生补气益卫,滋补肝肾,顾护正气,提高机体免疫力,从而激发肝细胞再生复制;苦味叶下珠、瓜蒌、金钱草具有抗病毒、抗炎等作用,可有效降低ALT、AST水平,保护肝细胞膜正常流动性与完整性[12-13],从而起到保肝功效;丹参、莪术可化瘀通络,改善外周循环,具有调节组织恢复与再生能力[14];三七、生地、黑附片可以调节细胞免疫和体液免疫,调补阴阳,补肾以调肝,帮助恢复肝组织形态及功能。
既往研究表明,肝脏细胞在处于非病理状态下为静止期(G0)。细胞周期中的第一个间隔期(G1)为确定细胞是否要启动DNA复制的关键期。cyclin D作为G1期调节因子可成为生长因子的靶标,它依赖于细胞外信号进行表达,可将细胞外的信号整合到核心细胞周期调节剂中,并激活CDK4/6,形成cyclin D-CDK复合物,诱导细胞过渡至S期。且cyclin D为不稳定蛋白(半衰期约10~20分钟),当细胞受到生长因子刺激时,cyclin D的表达才能得以维持[15-16]。cyclin D由三个不同但密切相关的亚家族(D1,D2和D3)组成,每种D型细胞周期蛋白都可以激活CDK4和CDK6,D2和D3也可以与CDK2功能性相互作用,且D1和D2基因的启动子包含典型的E2F家族识别位点[17]。当细胞被提示进入增殖期时,cyclin D-CDK4与cyclin D -CDK6复合物的最重要功能是在G1中期至晚期磷酸化视网膜母细胞瘤蛋白(pRb),并中和pRb的抗增殖活性[18],同时隔离p27(CDK抑制剂)。在静止期时DP1-E2F DNA异二聚体与pRb结合处于转录失活状态,cyclin D-CDK4/6复合物在磷酸化pRB的同时,DP1-E2F异二聚体的转录活性得以释放,成功诱导细胞进入S期[19]。可以说,E2F1增殖通路介导的cyclin D-CDK4/6复合物释放DP1转录因子引发了肝细胞从G1期过渡到S期特异性转录模式的分子开关,启动了肝细胞再生复制。
本研究结果显示:在疗效评价指标方面,与同一时间模型组大鼠相较,各治疗组大鼠ALT、AST、TBIL显著下降,PTA明显升高;肝组织HE染色病理观察,可见炎细胞浸润、肝细胞坏死情况均较轻,虽然有间质反应性增生和假小叶形成,但网状纤维结构尚存,有利于肝细胞复制及恢复组织形态及功能。在机制研究指标方面,模型组5天时cyclin D1、cyclin D2、cyclin D3 、DP1表达量较正常组明显升高,但随时间进展,表达量逐渐降低,15天组表达量基本趋于正常组。截断逆挽方10天、15天组cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6、DP1表达量较同一时间模型组均有不同程度上调(P<0.05)。推测其原因是因为由于急性攻击后肝细胞大量损伤,刺激肝细胞开始短暂的代偿性增殖,但D型细胞周期蛋白为不稳定蛋白,在缺乏生长因子的长期刺激下,cyclin D逐渐降低表达,减缓释放E2F家族蛋白DP1,细胞周期停滞。此时肝细胞代偿增殖的能力不足于抵抗肝细胞过度凋亡则会导致肝衰竭。有研究表明cyclin D-CDK4/6复合物的活性首先在G1中期被检测到,在G1/S转变附近达到最大值,并在增殖细胞中保持高值[20]。因此截断逆挽方10天、15天组各转录因子的高表达表明截断逆挽方连续给药能加快ACLF大鼠肝细胞从G1期向S期的过渡,帮助肝细胞进入持续增殖状态从而扭转肝衰竭的进程。截断逆挽方组方较为复杂,有效药理成分尚不完全清楚,推测其作用可能与该方刺激D型周期蛋白上游生长因子有关,有待进一步研究。
综上,截断逆挽方可通过上调cyclin D-E2F1信号通路上cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6基因的表达及转录因子DP1表达量,加速肝细胞再生复制,保持持续稳定的增殖,从而改善肝功能,减轻凝血障碍,扭转肝衰竭进程,为临床推广运用该方提供了新的理论依据。

