再障膏方对再生障碍性贫血小鼠FOXP3、GATA-3、T-bet、Notch1蛋白表达及Treg/Th17的影响
王德好 丁晓庆 刘军霞 郭明 廖俊尧 李玲 谌海燕
再生障碍性贫血(aplastic anemia,AA)是一种骨髓造血功能衰竭综合征,可发生于各年龄组,临床以血三系减少为主要表现,其实质是T淋巴细胞异常活化、功能亢进造成骨髓损伤[1]。其中,调节性T细胞(regulatory T cell,Treg)/辅助性T细胞17(helper T type 17,Th17)细胞的免疫失衡是AA发病的重要机制之一[2-3]。课题组前期使用科室经验方再障膏方联合环孢素治疗AA显示出良好的临床效果,而进一步的动物实验也证实了再障膏方联合环孢素能明显改善AA模型小鼠外周血及Treg/Th17细胞失衡状态[4]。我们将前期实验小鼠的脾脏进行分析,使用蛋白免疫印迹法(western blot,WB)检测各组叉头状转录因子3(forkhead box protein 3,FOXP3)、GATA结合蛋白3(GATA binding protein 3,GATA-3)、T细胞特异性转录因子(transcription factor T-bet,T-bet)及Notch1蛋白表达水平,分析其变化及与Treg/Th17细胞变化的关系,以期为AA的临床治疗及进一步研究提供方向。
1 材料与方法
1.1 实验动物
近交系SPF级BABL/c小鼠,雌性56只,8~12周龄,18~22 g。购买于北京维通利华实验动物技术有限公司,动物合格证号SCXK(京)2016-0010。
1.2 主要药品及试剂
白消安(粉末)为上海迈瑞尔化学技术有限公司产品。环孢素软胶囊为杭州中美华东制药有限公司产品;再障膏方由北京中医药大学东方医院制剂室统一浓煎呈膏状,药剂室进行药材质量控制(主要成分为炙黄芪30 g、党参15 g、白术15 g、陈皮15 g、茯苓15 g、川芎15 g、当归15 g、白芍15 g、生地黄15 g、丹参30 g、杜仲15 g、续断15 g、桑寄生15 g、龟板胶10 g、鹿角胶10 g、女贞子15 g、墨旱莲15 g)。PE-Cy5标记的CD3单克隆抗体、FITC标记的CD4单克隆抗体、PE标记的CD25单克隆抗体、BV421标记的RORyt抗体、FcR阻断剂(CD16/32)均为美国BD Pharmigen公司产品。APC标记的FOXP3抗体、FOXP3染色缓冲组为美国eBioscience公司产品。Ant-T-bet、Ant-GATA-3、Ant-FOXP3、Ant-Notch1为美国Abcam公司产品。Ant-GAPDH为北京天德悦生物科技责任有限公司产品。
1.3 仪器
高端分析流式细胞仪(美国BD公司);SDS-PAGE电泳系统(美国BIO-Rad公司);凝胶成像系统(美国UVP公司);ChemiDoc MP化学发光成像系统(美国BIO-Rad公司);低温离心机(德国Sigma公司)。
1.4 药物给药剂量及配备
正常患者使用剂量:再障膏方:一天两次口服,一次1袋(16 g);CsA:200 mg/天;参照徐叔云等[5]主编的《药理实验方法学》以及陈奇[6]《中药药理研究方法学》,按人与动物间体表面积折算的等效剂量比值表计算,小鼠给药剂量=成人给药剂量/388。给药剂量为:再障膏方:82 mg/天;CsA:0.5 mg/天。
白消安溶液:用无菌注射用水配置为4 mg/mL的均匀混悬液,分装在-20℃保存(下同);再障膏方溶液:820 mg/mL;环孢素溶液:5 mg/mL。
1.5 模型建立
选取56只BALB/c小鼠,随机分为空白组8只,实验组48只。将实验组按照36 mg/kg剂量白消安灌胃,连续给药5天(课题组前期研究表明该给药剂量、时间能形成较稳定的AA模型),同时给空白组予以等量的无菌注射用水。
待模型组动物造模成功后,再次按随机数字表法分为:模型组18只,中药组、西药组、中+西药组,每组10只,治疗周期为10天。其中空白组、模型组使用无菌注射用水0.1 mL、2次/天灌胃,中药组及西药组分别使用再障膏方溶液0.1 mL(早)、CsA溶液0.1 mL(晚)灌胃,无菌注射用水0.1 mL分别于晚、早灌胃,中+西药组使用再障膏方溶液0.1 mL(早)、CsA溶液0.1 mL(晚)灌胃。
1.6 流式细胞术检测小鼠外周血Treg、Th17细胞
在200 μL抗凝全血中加入FCR阻断剂,避光孵育15分钟,加入PE-Cy5标记的CD3单抗、FITC标记的CD4单抗、PE标记的CD25单抗各1 μg,避光孵育30分钟,裂解红细胞,离心、弃上清(共2次),加入新鲜制备的Fixation/Permeabilization Buffer应用液,避光孵育12分钟,最后加入APC标记的FOXP3抗体和BV421标记的RORyt抗体各1 μg,4℃避光孵育30分钟,1小时内上机即可。结果分析应用Cell Quest软件。
1.7 WB法检测小鼠脾脏FOXP3、GATA-3、T-bet、Notch1蛋白表达
取小鼠脾脏组织研碎,裂解液提取蛋白,BCA法蛋白定量,后加入缓冲液,沸水浴5分钟使蛋白变性。每孔取20 μg蛋白上样进行电泳。转膜、封闭、一抗、二抗孵育,最后放入化学发光成像系统成像。
1.8 统计学处理

2 结果
2.1 各组小鼠外周血Treg/Th17细胞比例变化
模型组Treg/Th17比例与空白组相比明显下降(P<0.01);西药组、中+西药组与模型组相比,Treg/Th17比例明显上升,差异均有统计学意义(P<0.05);而中药组和模型组比较无统计学差异(P>0.05)。见表1、图1。
2.2 各组小鼠脾脏FOXP3蛋白表达水平
模型组FOXP3蛋白表达低于空白组(P<0.05)。西药组、中+西药组与模型组相比,FOXP3蛋白表达明显上升,差异有统计学意义(P<0.05),但西药组与中+西药组之间无统计学差异(P>0.05);单纯中药组与模型组相比亦无统计学差异(P>0.05)。见表1、图1。
2.3 各组小鼠脾脏GATA-3蛋白表达水平
模型组GATA-3蛋白表达低于空白组(P<0.05)。中药组、西药组、中+西药组与模型组相比,GATA-3蛋白表达水平均明显升高,差异有统计学意义(P<0.05);其中,中+西药组的GATA-3蛋白表达水平最高(P<0.01),明显高于单纯中药组、西药组。进一步说明中西药联合运用有明显的协同作用。见表1、图1。
2.4 各组小鼠脾脏T-bet蛋白表达水平
模型组T-bet蛋白表达高于空白组(P<0.05)。与模型组相比,中药组、西药组、中+西药组T-bet蛋白表达均显著下降,其中西药组最明显(P<0.01),中+西药组次之,差异均有统计学意义(P<0.05)。见表1、图1。
2.5 各组小鼠脾脏Notch1蛋白表达水平
模型组Notch1蛋白表达明显低于空白组(P<0.01)。中药组、中+西药组与模型组相比,Notch1蛋白表达明显升高,差异有统计学意义(P<0.05);而中药组与中+西药组之间无统计学差异(P>0.05)。西药组与模型组相比较亦无统计学差异(P>0.05)。见表1、图1。

图1 各组小鼠脾脏FOXP3、GATA-3、T-bet、Notch1蛋白电泳条带图比较
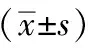
表1 各组小鼠目标蛋白表达水平
3 讨论
再生障碍性贫血在传统医学中属于“虚劳”“髓枯”等范畴。中医多认为虚劳主要与脾肾亏虚相关,脾为后天之本,主运化水谷精微,为气血生化之源,脾虚则血生化无源。肾为先天之本,主骨生髓,肾虚则髓无以生。我们临床应用再障膏方治疗再生障碍性贫血显示出良好的效果,该方主要以八珍汤为底方,方中炙黄芪、党参、白术、陈皮、茯苓健脾益气,何首乌、熟地黄、菟丝子、龟板胶、鹿角胶、女贞子、续断、杜仲、肉苁蓉、桑寄生、墨旱莲、当归补肾养血,兼以川芎、丹参活血化瘀,以防过于滋补阻碍气血运行。全方共奏培补脾肾、补气养血之功。目前西医治疗AA存在传统药物毒副作用大、疗效限制,新兴生物制剂远期疗效不确定、价格昂贵等缺点,而中药由于具有多作用靶点、增效减毒的特点,在AA的治疗上具有一定的优势,联合西药治疗可在一定程度上减轻或解除免疫损伤因素,促进、恢复骨髓造血功能[7]。本研究结果显示AA模型小鼠外周血Treg/Th17比例降低,脾脏FOXP3、GATA-3、Notch1蛋白下降、T-bet蛋白上升,与文献报道结果一致,证实AA发生与免疫系统紊乱密切相关。
FOXP3仅存在于Treg细胞表面,Treg细胞为具有免疫抑制功能,为调节性T细胞的一种,对于调节免疫细胞功能及免疫稳定具有重要作用[8]。研究表明,自身免疫性疾病的发生与FOXP3基因的缺失或表达水平的失调有关,而自身免疫性疾病患者多有FOXP3蛋白水平的变化[9]。同时,FOXP3蛋白的主要作用途径在于介导Treg/Th17的失衡,从而参与多种疾病的进展。目前的研究表明,FOXP3的表达及功能的发挥涉及多种环节及通路的调控,关于如何通过调控FOXP3的表达与修饰也成为治疗免疫相关疾病的新靶点[10]。本研究结果表明,相对于模型组,单纯中药对AA小鼠脾脏FOXP3表达无影响,单纯西药及中西药联合都可以明显增加FOXP3表达,差异有统计学意义(P<0.05)。
T-bet和GATA-3是人体重要的转录调节因子,能够调节Th1和Th2类细胞因子表达水平。GATA-3是1993年发现的一种细胞因子,广泛表达于造血组织、肾脏、神经系统、乳腺等组织[11],参与Th2细胞分化调节,可以通过调节甲基化的方式,间接影响相关因子的组蛋白修饰功能,进而促使相关因子的表达[12]。同时,还能直接与多种基因的启动子结合参与相关因子的表达调控,如HSVa、CGRE、HSII、及白介素-13等基因,该基因主要调控Th2相关因子的表达,促进细胞向Th2方向转化[13]。也能抑制Th1相关基因(如T-bet)的转录,阻止相关因子及蛋白的表达,进而抑制细胞向Th1方向的转化。有研究显示,AA患者的GATA-3的水平显著降低,并且降低程度与疾病活动程度及免疫异常水平有关[14]。T-bet是转录因子T-box家族成员之一,在骨髓、脐血祖细胞及干细胞在内的血细胞中都有表达[15],主要为CD4+T细胞,是Th1重要的转录因子,可诱导初始型CD4+T细胞产生大量干扰素-γ,进而促进Th1细胞极化(GATA-3抑制干扰素-γ产生),也可促进白介素-12R的产生,进而诱导Th1细胞的分化[16]。
T-bet与GATA-3相互协调,通过对自身及其他细胞亚群的转录因子的调节,组成完整的调节网络,通过对Th1、Th2及其他亚群的调节分化,进而达到调整免疫功能稳定的作用[11]。研究表明,T-bet与GATA-3表达异常导致的Th1/Th2比例失衡,可以导致多种疾病的发生,如肿瘤[17]、免疫相关性疾病等。本研究结果表明,相对于模型组,单纯中药、西药、中+西药组GATA-3表达均上升、T-bet表达均下降,差异有统计学意义(P<0.05)。其中结合用药组在使GATA-3表达水平升高上具有显著的协同作用(P<0.01)。而T-bet表达在西药组中下降最明显(P<0.01),中+西药组次之(P<0.05)。Notch受体有4种,广泛分布于干细胞、原始细胞及免疫细胞表面。Notch信号通路可以同时调节T、B细胞的分化,主要是促进T细胞、抑制B细胞的分化[18]。而Jagged1-Notch1信号可诱导CD4+T向Th2及Treg细胞的分化。也有研究表明Notch1通过直接作用于T-bet启动子的形式促进Th1的分化。多种血液疾病均与Notch信号通路的异常有关,AA的发生也被证明与该通路的关系密切,有可能是通过T-bet下调Notch1方式影响,而GATA-3是Notch信号通路的下游必要的因子之一。另外也有报道表明AA小鼠的Treg/Th17平衡与Notch信号通路的变化存在明显相关性,认为该信号通路可能是导致AA发生的主要因素[19]。本研究结果表明,相对于模型组,单纯中药、中西药联合治疗均能明显增加Notch1蛋白表达(P<0.05),而单纯西药组治疗无差异。
综上所述,再障膏方联合环孢素能显著改善AA模型小鼠脾脏FOXP3、GATA-3、T-bet、Notch1蛋白的表达,促进外周血Treg/Th17细胞比例恢复平衡,二者变化趋势有一定的相似性。由此说明健脾补肾中药能促进环孢素的免疫调节作用,推测其作用机理可能与激活Notch1信号通路有关,但仍需后期进一步实验来证实。

