覆盖模式对旱作农田土壤微生物多样性及群落结构的影响
刘子涵,黄方园,黎景来,张 鹏,杨宝平,丁瑞霞,聂俊峰,贾志宽,*
1 西北农林科技大学农学院, 咸阳 712100
2 中国旱区节水农业研究院, 咸阳 712100
3 农业部西北黄土高原作物生理生态与耕作重点实验室, 咸阳 712100
作为土壤中最活跃的部分,微生物表现出多样的代谢功能,直接或间接参与了大量的生物化学反应,在陆地生态系统中起着不可或缺的作用[1-3]。研究表明,微生物群落在调节养分循环、影响植物生产力和生态系统稳定性方面发挥着至关重要的作用[4-6],并且微生物对植被和土壤性质的改变均能迅速做出反应[7-8]。因此,土壤微生物多样性和群落结构的变化可被作为重要和敏感的指标来表征土壤健康的短期和长期变化[3,9]。
中国北方旱地面积约占全国土地总面积的56%和农业生产的46%[10],是中国农业生产的重要地区之一。然而,水资源短缺、土壤肥力差是限制西北旱作区农业生产的主要因素[11]。因此,如何降低土壤水分蒸发,充分利用有限的自然降水,提高作物对有限水分的利用效率是解决该地区作物产量的关键所在。农田覆盖通过抑制土壤蒸发,极大地提高了作物的水分利用效率,已被广泛用于提高旱地农业生态系统的生产力[12-17]。但前人研究多集中于农田覆盖对土壤水分、土壤养分和作物产量的影响,而对农田覆盖条件下土壤微生物群落的变化了解较少。目前已有部分研究发现农田覆盖措施通过影响土壤结构、土壤微气候(土壤水分、土壤温度等)和土壤养分,可显著影响土壤微生物群落结构和多样性。陈月星等[18]、董立国等[19]和Huang等[20]研究表明,地表覆盖生草或秸秆均显著影响了土壤细菌群落结构及其多样性和丰富度。Liu等[8]发现地膜覆盖处理可显著改变温带半干旱地区土壤真菌群落组成,而侯晓杰等[21]研究表明地膜覆盖显著降低了东北黑土地的土壤微生物功能多样性。然而,现有研究多集中于单一覆盖材料或模式对土壤细菌或真菌群落结构一方面的影响,不同覆盖材料或模式间的比较鲜有报道。此外,土壤细菌和真菌群落对农田覆盖的响应并不一致,因此要了解农田覆盖对土壤微生物群落结构的影响,需同时研究不同农田覆盖模式下土壤细菌和真菌群落多样性和组成的变化。
本研究基于3年连续田间试验,在西北旱作区的设置了3种不同覆盖方式:平作地膜覆盖(P)、平作秸秆覆盖(S)和垄膜沟播覆盖(R),以平作不覆盖为对照(CK)。应用Illumina HiSeq测序技术分析土壤细菌和真菌群落组成和多样性,比较不同覆盖模式下的土壤微生物群落的变化,目的是探明连年农田不同地表覆盖对土壤微生物多样性和群落组成的影响差异,并结合相关的土壤理化性质(即pH:土壤酸碱度,SM:土壤水分,ST:土壤温度,SOM:土壤有机质,NO3-N:土壤硝态氮和TN:土壤全氮)变化,明确土壤微生物群落变化与土壤理化性状之间的关系,从而为西北旱作区农田覆盖栽培技术的合理应用提供理论依据。
1 材料与方法
1.1 试验区概况
本试验在陕西杨凌西北农林科技大学中国旱区节水农业研究院试验田(34°20′ N, 108°04′ E)进行。该试验区海拔466.7 m,多年平均降水量585.0 mm,7月至9月期间多年平均降雨量为380 mm,年蒸发量993.2 mm。年均气温13.5℃,年均日照时数为2196 h,无霜期 220天。属暖温带半湿润易旱区,土壤类型为塿土。0—20 cm土层土壤全氮含量1.21 g/kg,有机质含量11.97 g/kg,全氮含量1.31 g/kg,速效氮含量53.35 mg/kg,速效磷含量21.35 mg/kg,速效钾含量142.97 mg/kg。容重为1.28 g/cm3。耕作方式为春玉米连作。
1.2 试验设计
试验采用完全随机区组设计,设3个覆盖处理:(1)平作地膜覆盖(P):覆盖方式为平膜全覆盖,膜宽120 cm;(2)平作秸秆覆盖(S):秸秆为玉米秸秆,整秆均匀覆盖,覆盖量为9000 kg/hm2;(3)垄膜沟播覆盖(R): 沟、垄宽均为60 cm,垄高15 cm,其中垄上覆盖地膜,膜宽70 cm,沟内种植区不进行覆膜;以传统平作不覆盖为对照(CK),共4个处理,每个处理3次重复,每个小区面积58.8 m2(14 m×4.2 m)。地膜为聚乙烯塑料地膜(天水天宝塑业有限责任公司生产),厚度0.01 mm。上季作物收获后,将各覆膜(P、R)处理的旧地膜全部移除,秋季整地后重新覆盖地膜。覆盖后沿地膜带垂直方向每隔200 cm压一土带,防大风揭膜。在S处理中,上季作物收获后,移除不能分解腐烂的秸秆,秋天整地后重新覆盖秸秆。所有处理覆盖时间均为秋季作物收获后(8月中旬)覆盖。
试验始于2013年,作物为春玉米,品种为大丰30,于每年4月中下旬进行播种,8月中旬收获。各处理播种密度均为67,000 株/hm2(行距60 cm,株距25 cm),用鹰嘴播种(施肥)器人工播种,播种深度为4—5 cm。播种时各处理用人工鹰嘴播种(施肥)器施用基肥(N 140 kg/hm2和 P2O5150 kg/hm2),玉米播种后65天后在玉米棵间进行追肥(N 140 kg/hm2),施肥深度为4—5 cm,全生育期不灌水。试验期间所有处理没有发生病虫害,并根据情况进行人工除草。
1.3 土壤取样
在大田试验第3年的2016 年7月1日(播后74天,玉米吐丝期)进行取样,直径5 cm 的土钻远离植物根部以“S”形取样收集9个重复样品(0—20 cm土层的土壤),然后混合均化作为每个重复小区的复合样品。将样品过2 mm 筛,移除根系和其他其他肉眼可见的杂物。每个样品分成三部分:一部分鲜土用于硝态氮(NO3-N)的测定;一部分分装到50 mL 离心管中,立即放入-80℃冰箱中保存,用于土壤微生物 DNA 的提取;剩余土样风干后用于土壤 pH、土壤有机质(SOM)、土壤全氮(TN)等指标的测定。
1.4 土壤理化性质测定
土壤水分与温度:取土样的同时用烘干法测定0—20 cm 土壤水分(SM),每个小区3次重复。同时用地温计在取样前后连续3天测定5、10、15、20 cm的土壤温度(ST),以5—20厘米的土壤温度的平均值作为每个小区的土壤温度。
土壤pH:取风干土10 g,按土∶水=1∶2.5 的倍数加入25 mL水后剧烈震荡摇匀后,静置 30 min,用 pH 计测定[22]。
土壤养分测定:土壤有机质采用重铬酸钾氧化法测定[22];土壤全氮含量采用凯氏定氮法测定[22];土壤硝态氮含量采用流动分析仪进行测定:取新鲜土样5 g,加入50 mL 1.0 mol/L KCl振荡30 min,然后过滤提取物,使用流动分析仪(Autoanalyzer 3,Bran Luebbe,德国)测定硝态氮浓度。
1.5 DNA提取和Illumina HiSeq测序
土壤微生物DNA使用FastDNA试剂盒(MP Biomedicals, USA)提取。应用带有barcode的特异引物序列(细菌:341F 5′-CCTACGGGRSGCAGCAG-3′和806R 5′-GGACTACVVGGGTATCTAATC-3′;真菌:F2045 5′-GCATCGATGAAGAACGCAGC-3′和R2390 5′-TCCTCCGCTTAT TGATATGC-3′)扩增相应土壤细菌16S rRNA V3-V4区域和真菌ITS基因。扩增体系包括:2×KAPA HiFi Hotstart ReadyMix15 μL,正反向引物各1 μL,10 ng DNA模板,最后用dd H2O补足至30 μL。PCR扩增条件为:95℃预变性3 min;然后94℃变性20 s,58℃退火30s,72℃延伸30 s持续24个循环;最后72℃延伸150 s结束。
扩增子使用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences,Union City,CA,USA)从2%琼脂糖凝胶中提取并使用Qubit dsDNA HS Assay Kit(Promega,USA)纯化DNA。将纯化的扩增子以等摩尔浓度合并,然后根据标准方案在Illumina HiSeq PE250平台上进行配对末端测序(2×250 bp)。Illumina HiSeq 测序在上海锐翌生物科技有限公司完成。PANDAseq软件用于合并来自原始DNA片段的配对序列读数[23]。使用USEARCH v5.2.32对序列进行进一步分析,通过聚类相似序列的差异小于3%来过滤和去噪数据。对微生物生态学管道软件的定量分析被用来通过将聚类OTUs的读数组合为97%相似性来选择操作分类单元(Operational Taxonomic Units,OTU)[24]。
1.6 数据分析
采用单因素方差分析法分析土壤理化性状,以确定处理之间的差异(显著差异在95%的置信水平下确定)。当检测到显著性时(P<0.05水平),使用邓肯法进行多重比较。使用QIIME软件计算阿尔法多样性。用Chao1估计法和Shannon多样性指数计算细菌群落估计的丰富度和多样性。使用Canoco 5.0软件进行冗余分析(Redundancy analysis, RDA),以辨别微生物群落组成与环境参数之间的相关性。在RDA中选择manual forward selection程序以使用具有999个排列的蒙特卡罗测试来确定环境变量参数的显著性。Spearman的等级相关性用于测试微生物群落组成与土壤理化性质之间的关联。使用SPSS18.0(SPSS Inc., Chicago,IL,USA)进行所有统计分析和Spearman等级相关性分析。
2 结果与分析
2.1 土壤理化性质
连续覆盖3年后,各处理的土壤理化性质发生了显著变化(表1)。覆盖处理(P、S和R)显著降低了土壤pH(P=0.01);与CK相比,R和S处理TN和NO3-N含量(P<0.01)分别显著提高12.84%、7.96%和14.95%、25.13%,而P处理下玉米营养生长旺盛,过度消耗地力,土壤TN含量较CK显著降低5.08%;覆盖模式对SOM影响不显著,各处理下土壤SOM含量在15.00—15.58 mg/kg;P和R处理均显著提高了SM和ST,春玉米产量较CK分别显著提高 17.4%和16.69%(图1)。秸秆覆盖对SM、ST和产量影响不显著。
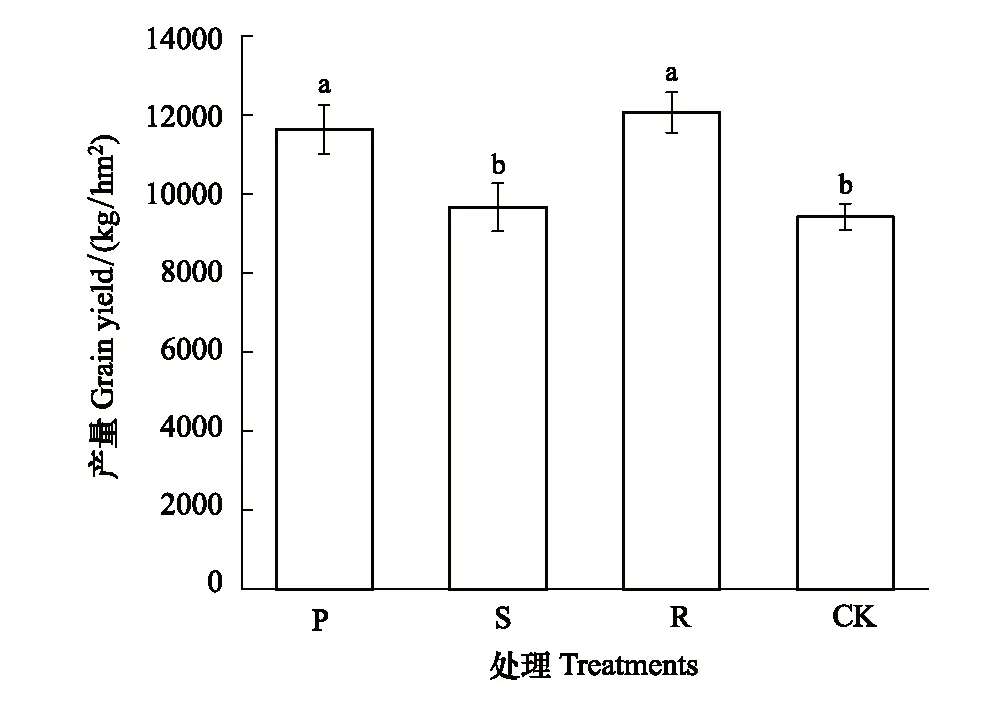
图1 不同覆盖处理的玉米产量
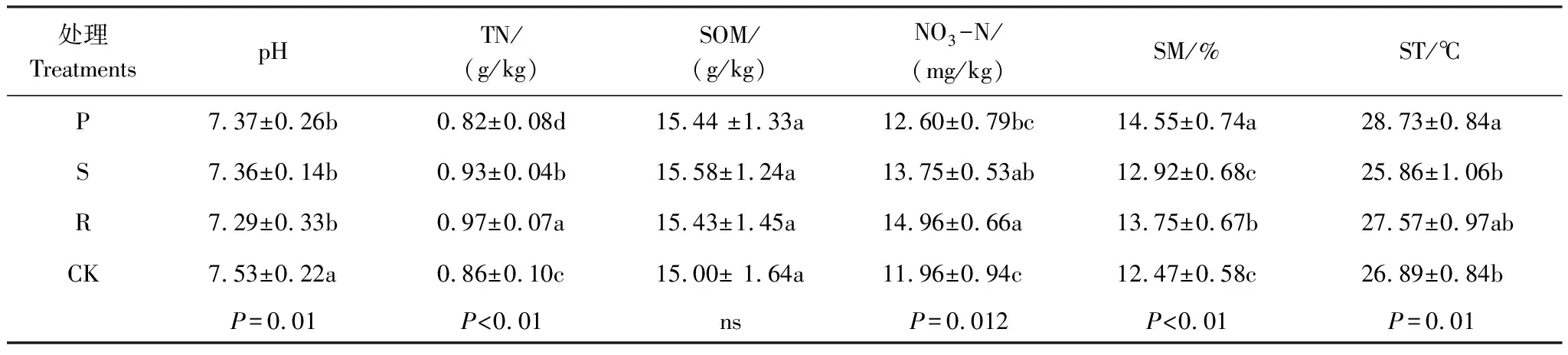
表1 0—20 cm土层土壤理化性质
2.2 土壤微生物群落多样性及与土壤理化特性的关系
采用操作分类单元(OTU)水平方法计算不同覆盖条件下微生物群落丰富度和多样性(表2)可知, 各覆盖处理(P,S和R)下土壤细菌的OTU、Chao1指数和Shannon多样性指数较CK 处理均有提高。而真菌丰富度和多样性对覆盖模式的响应不同,除P处理外,其他覆盖处理(S和R)的Chao1指数、OTU和Shannon多样性指数均显著高于CK,而P处理下土壤真菌多样性和丰富度与CK处理相比差异不显著。Spearman相关系数分析表明,细菌群落的OTU和Shannon多样性指数与SM均呈显著正相关,OTU和Chao1指数与NO3-N含量呈极显著正相关;真菌群落的OTU、Chao1指数和Shannon指数均与ST呈显著负相关,和TN、NO3-N含量均呈显著正相关(图2)。
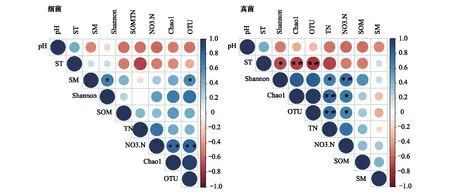
图2 土壤微生物多样性与环境因子的斯皮尔曼相关系数
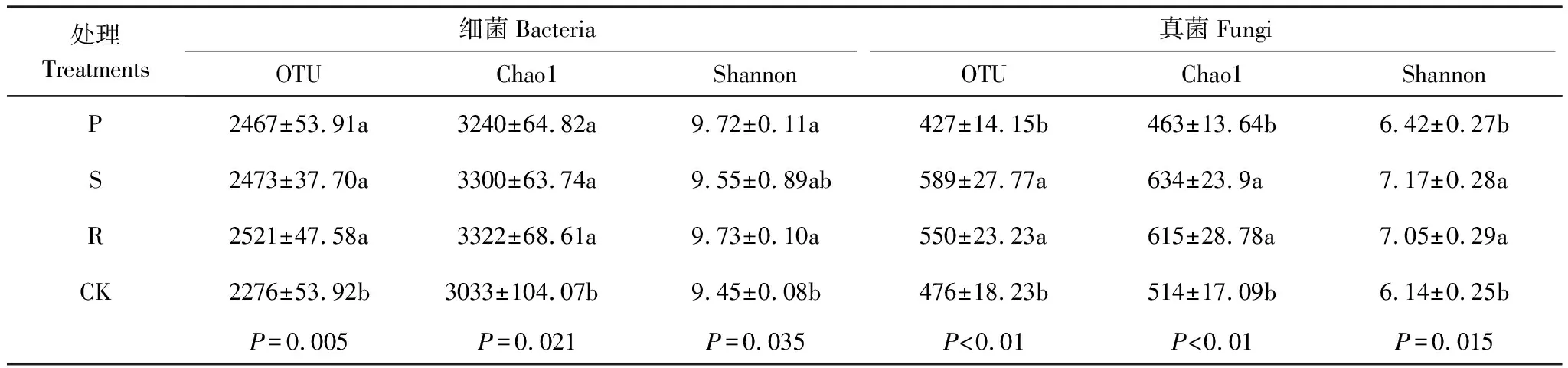
表2 不同覆盖处理土壤微生物的丰富度和多样性指数
2.3 土壤微生物群落结构及与土壤理化特性的关系
通过对所有土壤样品进行质量测序,细菌群落和真菌群落分别获得143025和139826个序列。每个样本的细菌序列数量为33155—38411(平均值= 35756),而真菌序列的数量为33438—36800(平均值= 34957)。由图3可知,细菌的优势门是变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria),它们的相对丰度范围分别为28.92%—30.55%、25.66%—30.48%和17.85%—27.3%。真菌群落的优势门是子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)和接合菌门(Zygomycota),它们的相对丰度范围分别为49.78%—64.36%,13.52%—33.44%,5.55%—7.75%和3.93%—10.27%。另外,在所有样品中均发现了低丰度的壶菌门(Chytridiomycota)。

图3 不同处理土壤微生物群落在门分类水平下的组成和相对丰度
此外,Spearman等级相关分析(表3)表明土壤理化特性显著影响了微生物群落组成。在细菌群落组成中,酸杆菌门的相对丰度与TN、NO3-N和SOM呈显著正相关,与pH呈显著负相关。芽单胞菌门(Gemmatimonadetes)和拟杆菌(Bacteroidetes)的相对丰度均与TN呈显著正相关。此外,NO3-N也和拟杆菌呈显著正相关。对于真菌群落而言,ST显著影响担子菌门和接合菌门,并与前者呈显著正相关,后者与之相反。球囊菌门与TN和NO3-N呈显著正相关,与pH则呈显著负相关。壶菌门的相对丰度与SM呈显著正相关。由此可知土壤温度和氮含量是改变微生物群落组成的主要因素。
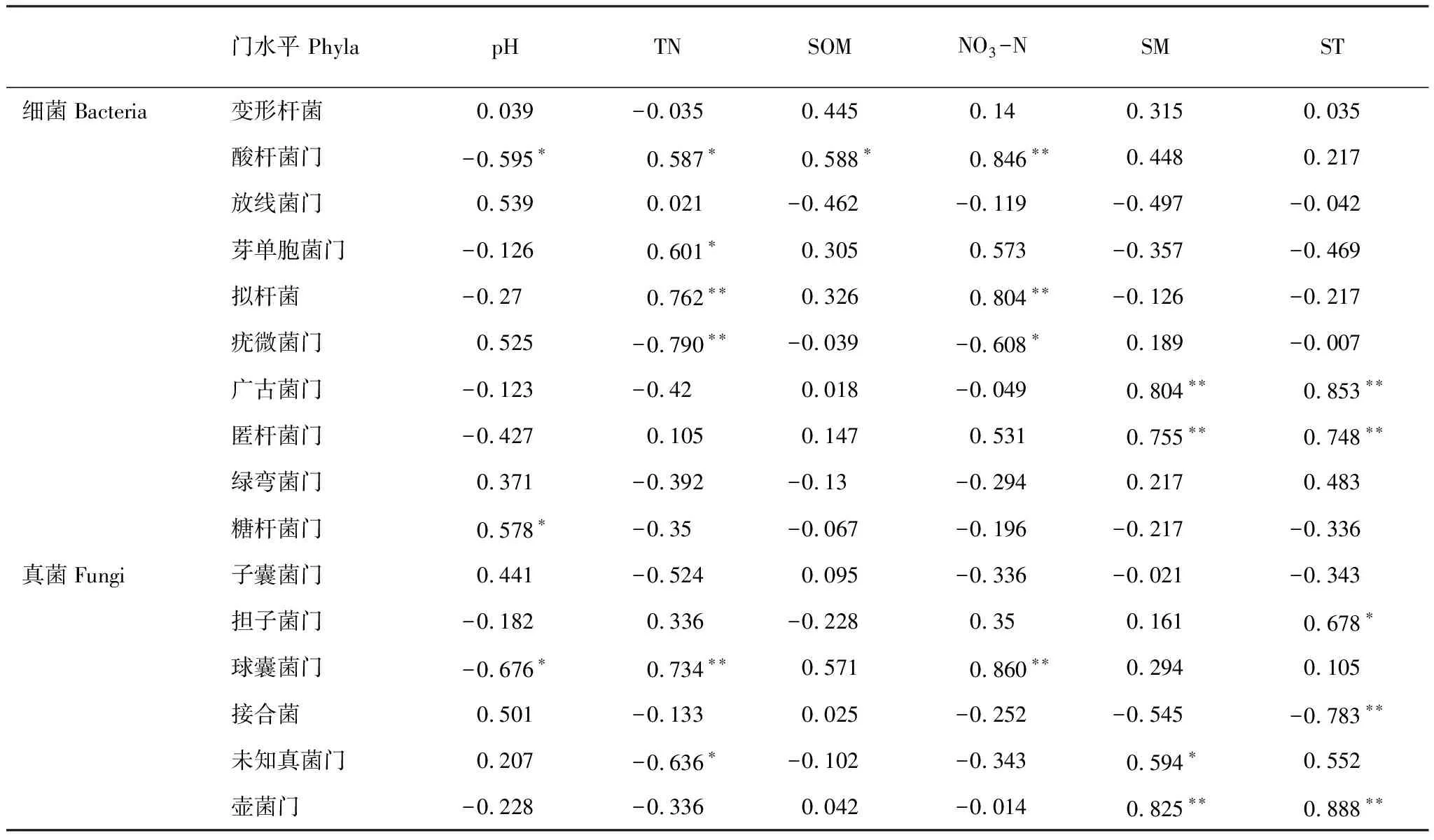
表3 土壤微生物(门分类水平)的群落组成与土壤理化性质的Spearman等级相关系数
采用冗余分析(RDA)进一步分析各土壤环境因子与微生物群落结构之间的关系。图4为细菌群落结构与土壤理化性质之间的关系,蒙特卡洛置换检验表明(表4),土壤SM(F=10.1,P=0.001)、ST(F=4.5,P=0.012)和TN(F=3.7,P=0.025)是细菌群落变异的三个最重要的贡献者。所有的环境变量共同解释了样本间细菌群落变异的86.7%,影响大小顺序为SM>ST>TN>NO3-N>pH>SOM。RDA的前两个排序轴分别解释了总方差的59.96%和16.63%。在第一个排序轴上,来自P处理样品点的聚集度与其余处理的样品点的聚集度相距较远。图4为真菌群落结构与土壤理化性质之间的关系,影响真菌群落组成最大的土壤理化性质为SM(F=6.2,P=0.004)(表4)。所有的环境变量共同解释了样本间真菌群落变异的83.4%,影响的顺序为 SM>TN>ST>NO3-N>pH>SOM。RDA的前两个排序轴分别解释了总方差的51.9%和26.6%,在第一个排序轴上,CK和S处理的样品点距离较近,来自P和R处理样品点的聚集度与它们相距较远。
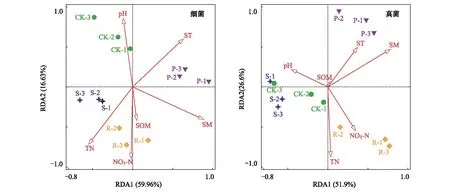
图4 土壤微生物群落结构与土壤理化特性的冗余分析(RDA)
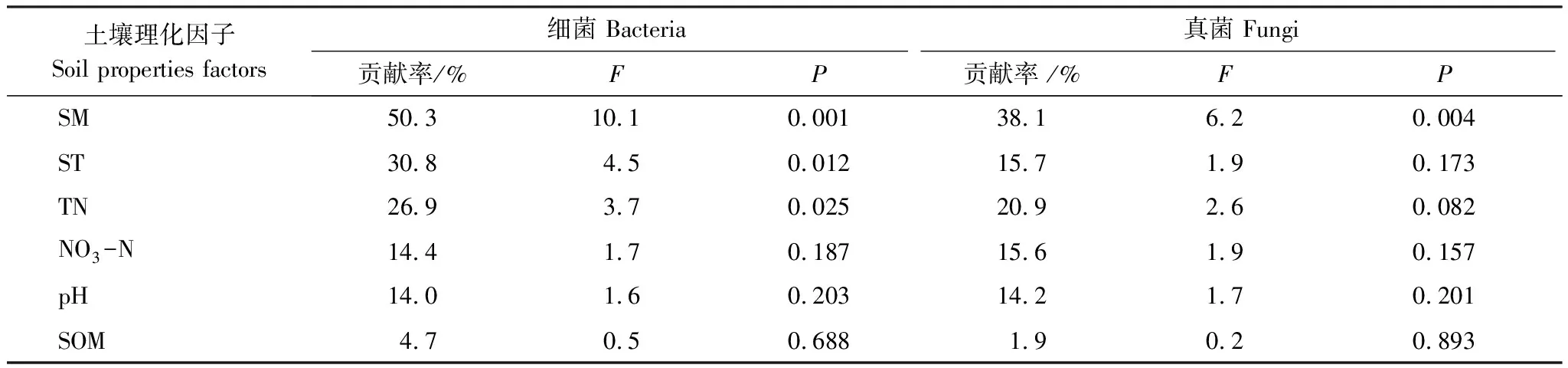
表4 环境变量对土壤微生物群落分布的贡献及其显著性
3 讨论
3.1 覆盖对土壤微生物多样性的影响
土壤微生物可以敏感地指示气候和土壤环境条件的变化[3,9],同时土壤微生物多样性受土壤养分、结构、pH、温度和水分等条件的影响[2]。前人研究发现,秸秆覆盖、麦草覆盖以及集雨地膜覆盖均有利于维持土壤微生物多样性,提高土壤微生物群落的丰富度和群落物种的均匀度[18,25-26]。本研究发现各覆盖处理(秸秆覆盖:S、垄膜沟播覆盖:R、地膜覆盖:P)均显著提高了土壤细菌多样性和丰富度,而不同覆盖措施对土壤真菌多样性影响不同(表2),这主要与土壤理化性质的变化有关。我们发现土壤细菌多样性主要受土壤水分的影响(图2),水分通过改变微生物的细胞渗透状态、土壤基质有效性、pH值、气体扩散和温度等直接或间接影响土壤微生物的多样性,微生物尤其是细菌在相对较高的水势环境下活性更高[27-28]。而本试验中的各覆盖处理(P、S和R)均能有效改善半干旱区的土壤水分条件(表1),为土壤细菌的生长提供了一个稳定而潮湿的环境促进其生长和繁殖。覆盖措施对微生物丰富度的积极影响可能还要得益于某些优势菌门的丰度增加,如酸杆菌门(Acidobacteria)和球囊菌(Glomeromycota)(图3),这表明覆盖措施促进了微生物在选择性方向上发育。此外本试验还发现,与细菌相比,秸秆覆盖和垄膜沟播种植方式会导致微生物群落α多样性中更高的真菌优势(表2)。这是因为土壤真菌比细菌具有更广的适应性和多功能性[29],由于真菌擅长分解有机物,垄沟结构促进了作物根系的生长从而分泌更多的有机物[26],秸秆覆盖植物残渣持续的碳氮输入,这些都优先刺激了真菌的生长和增殖,真菌丰富度的增加又使其分解有机物能力更强,由此形成良性循环,这有利于农业系统中土壤SOM稳定和土壤健康[30]。对于土壤真菌群落多样性和丰富度而言土壤温度是主要影响因素,且二者之间呈显著负相关(图2,图4),这表明当土壤温度推到微生物活动的最适值以上时会限制其生长繁殖[31-33],因此地膜覆盖(P)处理下较高的土壤温度在一定程度上限制了土壤真菌的生长[34]。相比之下,仅用塑料薄膜覆盖垄部的R处理下的土壤部分热量会从沟中裸露部分逸散出来,为土壤真菌群落的生长提供了更适宜土壤温度。而秸秆覆盖(S)对土壤真菌群落多样性和丰富度的积极作用还要归因于玉米秸秆腐解后有机物可以归还土壤并以此补充土壤有机碳氮养分,为土壤真菌提供了丰富的碳源和氮源[35-36]。此外,土壤养分也是影响土壤微生物(细菌和真菌)多样性的另一主要因素,由于本试验所处地区降水时空分布不均,土壤缺水时植物会受到胁迫而改变其对地下的碳分配,影响作物与微生物之间的竞争策略,进而改变土壤微生物多样性[37-38]。相关性分析表明土壤微生物多样性与土壤养分(TN和NO3-N)呈显著正相关,垄膜沟播(R)处理的垄沟结构促进了作物根系的生长从而分泌更多的有机物[13,26],以及秸秆覆盖下凋落物持续的碳氮输入均为土壤微生物群落生长创造了良好的土壤养分环境。P覆盖处理下较高的土壤水分和土壤温度促使作物旺长,消耗了大量的土壤养分,使土壤微生物和作物竞争有限的矿化养分[39],不利于土壤微生物群落的发展。因此,S和R处理土壤均同时提高了土壤细菌和真菌群落多样性和丰富度,而P处理下土壤真菌群落多样性和丰富度与对照处理无显著性差异。这些都是农田覆盖引起的土壤微环境的改变,最终导致的土壤微生物多样性的差异[40]。
3.2 覆盖对土壤微生物群落结构的影响
本研究发现农田覆盖措施显著影响了土壤微生物群落的组成,所有样品中土壤细菌群落中的优势种群为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)。同样,金志薇等[41]、Lipson等[42]和陈月星等[17]研究发现放线菌门和变形菌门也是高寒草地、高山和果园土壤环境中最常见的类群。此外我们发现各覆盖处理(P、S和R)下变形菌门和酸杆菌门的相对丰度均高于对照(图3),这是由于变形菌作为一种嗜营养菌,富碳环境可刺激其快速增长[43],因此农田覆盖条件下土壤中丰富的SOM和NO3-N为变形菌提供了充足的代谢底物促进了其生长和繁殖;酸杆菌被认为可分解难降解的碳源,对于分解植物残渣来分泌β-葡萄糖苷酶和木聚糖酶起着重要作用[44],各覆盖处理下较低的pH和丰富的碳氮养分刺激了酸杆菌的生长,进而会加速土壤中现有碳源的分解[44-46]。放线菌已被发现广泛分布在陆地生态系统中,特别是在干旱土壤中。各覆盖处理(P、S和R)的放线菌相对丰度均低于CK,这可能是由于地表覆盖抑制了土壤水分蒸发,增强了储水能力,因此放线菌门的相对丰度在土壤含水量较低的CK中最高。
本研究中真菌群落以子囊菌门(Ascomycota)和担子菌门(Basidiomycota)为主,二者作为腐生菌是复杂化合物的重要分解者,对分解植物残体和降解秸秆残留物具有重要作用[47-48]。其中R处理下子囊菌门相对丰度较低,与NO3-N含量呈负相关,这与李瑞霞等[49]研究结果一致。此类别中的大多数物种在土壤生态系统中反硝化作用中起重要作用,影响土壤碳的分解, R处理中较低的子囊菌门相对丰度反而会反硝化过程中产生较少的温室气体N2O,可能有利于生态圈平衡[45]。与之相反,担子菌门(Basidiomycota)相对丰度在R处理土壤中比较丰富,远高于其他处理,表明垄膜沟播覆盖为担子菌的生存提供了良好的栖息环境。有研究表明担子菌可以与植物形成外生菌根,加速了作物根系对水分和养分的吸收[46],有益于作物产量的形成。我们的试验结果也显示R处理产量为所有处理最高(图1)。球囊菌(Glomeromycota)可构成陆生植物的丛枝菌根,形成菌根的球囊菌广泛的分布在全世界的土壤中,它和植物的根形成共生关系,促进根部养分吸收和生长,对提高植物抗旱性、耐涝性、耐盐性以及植物对害虫和病原体的抵抗力发挥着重要作用[50-52]。本研究发现各覆盖处理(P、S、R)下土壤中球囊菌门的相对丰度均大于CK,这是由于土壤中较低的pH和丰富氮含量有利于球囊菌的生长[53]。因此,本研究认为,覆盖模式通过改善土壤水温和氮含量,改变了微生物的群落结构,微生物群落反过来调节作物对土壤水分和养分的吸收利用,促进了作物的生长发育,最终各覆盖处理玉米产量较CK均有不同程度提高。P处理虽然显著提高了玉米产量,但是由于该处理作物对土壤养分的过度消耗,导致土壤氮含量较低(表1),不利于土壤的可持续利用。R和S 处理均提高了微生物多样性,有利于维持长期的土壤健康。而S处理虽然改善了作物根区的土壤水分条件,但是秸秆覆盖下较低的土壤温度抑制了微生物对养分的转化和供给,限制了种子的萌发、根茎叶的形成乃至生殖生长的进程,导致土壤营养状况虽然良好而作物产量和CK差异并不显著。R处理下适宜的土壤水分和温度为微生物提供了良好的生存环境,有利于土壤养分的释放,作物产量显著提高。
4 结论
农田覆盖显著改变了土壤理化性质(pH,TN,NO3-N,SM和ST),且与土壤微生物群落密切相关,分别解释了细菌群落86.7%和真菌群落83.4%的变化。土壤水分是对微生物多样性影响贡献率最大的理化因子,地表覆盖通过提高土壤水分含量增加了土壤微生物多样性。微生物群落组成变化主要受SM、ST、NO3-N及TN含量的影响,地表覆盖下较高的NO3-N含量提高了土壤中酸杆菌门(Acidobacteria)和球囊菌(Glomeromycota)的相对丰度;秸秆覆盖降低了ST,抑制了担子菌门(Basidiomycota)的生长繁殖。与其他覆盖处理相比,垄膜沟播处理(R)提高了土壤细菌和真菌的丰富度与多样性,增加了部分有利于作物生产菌门(酸杆菌门、球囊菌、担子菌门)的相对丰度,春玉米产量为所有处理中最高。因此,建议采用垄膜沟播(R)作为该地区的种植方式。

