PDZ结合激酶/T-LAK 细胞来源的蛋白激酶在恶性肿瘤中的作用机制研究进展△
宋开蓉,刘媛,陈思璐,杨永秀
1兰州大学第一临床医学院,兰州 730000
2甘肃省妇科肿瘤重点实验室,兰州 730000
3兰州大学第一医院妇产科,兰州 730000
1 PBK/TOPK的发现
Gaudet等首次通过酵母双杂交技术筛选鉴定出一种可与果蝇肿瘤抑制蛋白DLG的人类同源物(the human homologue of the Drosophila Discslarge tumor suppressor protein,hDlg)分子PDZ结构域相结合的新型蛋白激酶,命名为PDZ结合激酶(PDZ binding kinase,PBK)。经测序发现,其与Abe等克隆并命名的淋巴细胞激活的杀伤T细胞源性蛋白激酶(T-LAK cell-originated protein kinase,TOPK)属于同一分子,故统称为PBK/TOPK。PBK/TOPK和促分裂原活化的蛋白激酶(mitogen-activated protein kinase kinase,MAPKK)的同源性很高,分子量约为40 kD,编码322个氨基酸,含有所有蛋白激酶的特征性亚结构域和锌指结构域,是MAPKK家族新成员。因PBK/TOPK缺失了一些对催化活性至关重要的氨基酸序列,故其本身无活性,需要某些氨基酸残基[如苏氨酸(threonine,Thr)-9、Thr-198)]被磷酸化后才能具备催化活性。
2 PBK/TOPK 在正常组织中的表达
在人类正常组织中,PBK/TOPK的表达及分布随着生长发育时间的变化而发生变化。在胎儿的肺、脾、肾、睾丸及脑组织中均可检测到PBK/TOPK,而在成人正常组织中,PBK/TOPK主要在心肌、胰腺、睾丸、胎盘等部位被检测到,尤其是胎盘。Fujibuchi等进一步研究发现,在精子产生的过程中,PBK/TOPK仅在增殖旺盛的精母细胞中呈高表达,而在精原细胞和精子中呈阴性表达。然而,Dougherty等的研究显示,PBK/TOPK不能在无增殖活动的成熟神经细胞中和处于静止期的神经干细胞中被检测到,主要定位于存在神经多能祖细胞等具有快速增殖能力的细胞的区域,如出生后早期的小脑颗粒层和成人的室管膜下区。上述研究表明,PBK/TOPK高表达于有增殖空间的组织中,提示与细胞增殖密切相关。
3 PBK/TOPK 与细胞有丝分裂
一项利用沉默RNA(silencing RNA,siRNA)技术敲除PBK/TOPK的实验结果显示,当PBK/TOPK的表达受到抑制时,纺锤体中央区出现变形和模糊,细胞质移动受阻,导致细胞周期推迟或停滞,说明PBK/TOPK参与了纺锤体中间带形成和细胞有丝分裂。PBK/TOPK在细胞有丝分裂期被磷酸化激活,于G期和M期的表达上调,此种变化与细胞周期蛋白B1(cyclin B1)一致,并通过促进细胞周期蛋白依赖性激酶1(cylcin-dependent kinase 1,CDK1)/cyclin B1复合体的表达,磷酸化多梳抑制复合物 1(polycomb repressive complexes 1,PRC1),加快细胞的有丝分裂。当PBK/TOPK与抑癌因子p53的DNA结合结构域(DNA-binding domain,DBD)相结合时,p53的表达量降低,下游细胞周期调控蛋白的功能受到抑制,导致异常有丝分裂的发生,进一步导致肿瘤形成。
4 PBK/TOPK与恶性肿瘤
PBK/TOPK主要通过激活多条细胞内信号通路促进多种细胞因子的分泌,引起机体内一系列肿瘤基因或转录因子的表达量发生变化,参与调控细胞周期,提高肿瘤细胞的存活、增殖、侵袭、迁移及抗凋亡能力等,从而促进肿瘤的发生、发展(图1)。
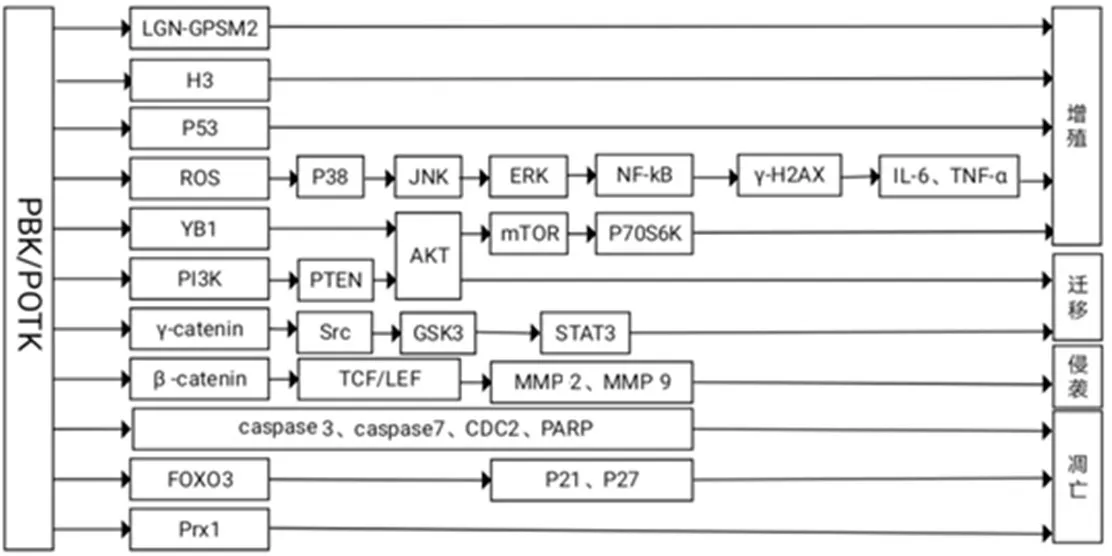
图1 PBK/TOPK 影响肿瘤细胞增殖、迁移、侵袭及凋亡的作用机制
4.1 PBK/TOPK与呼吸系统肿瘤
Wang等发现,鼻咽癌组织中高表达的PBK/TOPK与病情的严重程度呈正相关,下调PBK/TOPK的表达可诱导大量的活性氧(reactive oxygen species,ROS)产生,并激活p38丝裂原激活的蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)/c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)信号通路,介导鼻咽癌细胞凋亡,抑制鼻咽癌细胞增殖和集落形成。PBK/TOPK可通过促进磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)的表达,抑制人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homolog,PTEN)的表达,促进下游蛋白激酶B(protein kinase B,PKB,又称AKT)磷酸化,加快肺癌细胞迁移。肺腺癌细胞系中表达下调的肿瘤抑制因子微小RNA(microRNA,miRNA)-216b-3p可通过直接负调控PBK/TOPK的表达从而抑制肺腺癌细胞的生长,发挥抑制肿瘤生长的作用。
4.2 PBK/TOPK与消化系统肿瘤
PBK/TOPK在口腔鳞状细胞癌中过表达,而在人正常口腔黏膜中不能被检测到,PBK/TOPK的高表达可能提示口腔癌患者的预后良好。有研究发现,PBK/TOPK可通过磷酸化Y盒结合蛋白1(Y box binding protein 1,YB1)激活 AKT/雷帕霉素靶蛋 白(mechanistictargetofrapamycin kinase,MTOR)/p70核糖体蛋白 S6激酶(p70 ribosomal protein S6 kinase,p70S6K)信号通路,促进食管鳞状细胞癌细胞增殖;还可通过γ-catenin激活Src/糖原合酶激酶 3(glycogen synthase kinase 3,GSK3)/信号转导及转录激活因子3(signal transduction and activator of transcription 3,STAT3)和细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)信号通路从而参与食管鳞状细胞癌细胞的转移过程。Ohashi等发现,PBK/TOPK 在胃癌细胞系及原发性胃癌标本中均呈高表达,是胃癌患者预后不良的独立危险因素(P<0.05)。下调PBK/TOPK的表达可激活p53通路,从而抑制胃癌细胞的增殖;通过上调PTEN的表达可抑制胃癌细胞的侵袭和迁移。He等利用免疫组化及组织芯片等技术发现,在大部分胆管癌细胞中高表达的PBK/TOPK在所有肝细胞肝癌中完全不表达,这一特性运用于临床将有助于胆管癌和肝细胞肝癌之间的鉴别;进一步研究发现,PBK/TOPK与胆管癌患者的预后呈负相关,表皮生长因子(epidermal growth factor,EGF)的刺激可上调PBK/TOPK的表达,影响细胞周期进程,提示PBK/TOPK可能参与了EGF-表皮生长因子受体(epidermal growth factor receptor,EGFR)通路的活化。与之相悖的是,有研究发现,PBK/TOPK在肝细胞癌中的表达明显上调,通过沉默肝细胞癌细胞SMMC-7721中PBK/TOPK基因后发现,cyclin B1蛋白的降解速度明显加快,肿瘤细胞的增殖能力明显下降,AKT的磷酸化水平明显降低,并由此推测PBK/TOPK可能通过激活PI3K/AKT信号通路促进SMMC-7721细胞生长。PBK/TOPK在肝细胞肝癌中表达的差异可能与标本来源各异、实验方法及技术不同、样本量较小等有关,有待进一步探究。在结肠癌HCT116细胞内,ERK2与PBK/TOPK可相互磷酸化形成一个正反馈循环,从而促进肿瘤细胞生长。PBK/TOPK还可通过与抑癌因子p53的DBD结合,降低后者的表达量,起到促进直肠癌细胞增殖、克隆并抑制凋亡的作用。另有研究表明,白细胞介素-8(interleukin-8,IL8)可诱导PBK/TOPK的表达上调,促进肠癌细胞系抵抗失巢凋亡,且PBK/TOPK高表达是结直肠癌患者预后不良的标志。一项基于组织芯片的回顾性分析进一步发现,肠癌患者的预后还与PBK/TOPK的定位有关,其中,PBK/TOPK于细胞质中低表达且于细胞核中不表达的肠癌患者,预后最差。
4.3 PBK/TOPK与泌尿生殖系统肿瘤
在乳腺癌细胞MCF7(抗雌激素药物敏感株)中,PBK/TOPK可激活P38,进而磷酸化组蛋白H2AX,参与DNA损伤修复,提升细胞的运动性能,加快非贴壁依赖型乳腺癌细胞的生长速度;在乳腺癌细胞T47D(抗雌激素药物耐药株)中,PBK/TOPK可通过调控PI3K/AKT/ERK1/ERK2信号通路提高肿瘤细胞的增殖、侵袭能力,并参与血管的生成,促进乳腺癌的发生、发展。PBK/TOPK还可通过磷酸化组蛋白H3的Ser10、Leu-Gly-Asn重复富集蛋白/G蛋白信号调制器2(Leu-Gly-Asn repeat-enriched protein/G-protein signaling modulator 2,LGN/GPSM2)的 Thr450,影响细胞有丝分裂,进而调节乳腺癌细胞的增殖能力。Sun等研究发现,PBK/TOPK在前列腺癌中的表达量与肿瘤分级、肿瘤分期密切相关,即PBK/TOPK的表达水平越高,肿瘤级别越高,且PBK/TOPK在前列腺癌循环肿瘤细胞中的表达量比在前列腺癌原代癌细胞中更高,通过调节PBK/PTEN和ERK通路可促进前列腺癌的转移。另有报道称,PBK/TOPK能激活β-catenin-TCF/LEF信号通路,上调基质金属蛋白酶(matrix metalloproteinase,MMP)2、MMP9的表达,故PBK/TOPK在发生侵袭、转移的前列腺癌细胞中的表达水平较高。膀胱癌组织中PBK/TOPK mRNA的表达水平明显高于癌旁组织,有利于膀胱癌细胞BIU-87的增殖和迁移。Luo等发现,宫颈癌组织中PBK/TOPK的相对表达量明显高于高级别宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)组织,且与肿瘤直径、分化程度、侵袭情况、转移情况、组织学类型和临床分期等有关,可能有助于高级别CIN与宫颈癌的鉴别诊断。
4.4 PBK/TOPK与血液系统肿瘤
恶性淋巴瘤组织中PBK/TOPK的阳性表达率高于健康人淋巴结反应性增生组织,而其表达情况在霍奇金淋巴瘤(Hodgkin lymphoma,HL)与非霍奇金淋巴瘤(Non-Hodgkin lymphoma,NHL)之间无明显差异,但在NHL中,高侵袭性淋巴瘤(如淋巴母细胞淋巴瘤)中PBK/TOPK的阳性表达率高于惰性淋巴瘤(如成熟B细胞淋巴瘤),提示TOPK的表达水平可能与NHL的恶性程度呈正相关,根据PBK/TOPK的表达量可大致推测出NHL的病理类型。在恶性淋巴瘤中,原癌基因c-myc可调控E2F转录因子 1(E2F transcription factor 1,E2F1)的活性,上调TOPK的表达,说明PBK/TOPK与恶性肿瘤细胞的增殖密切相关。
4.5 PBK/TOPK与其他恶性肿瘤
在恶性黑色素瘤细胞中,Zykova等研究发现,高表达的PBK/TOPK能够促进Ser-32处过氧化物还原酶1(peroxiredoxin 1,Prx1)的磷酸化,抑制恶性肿瘤细胞凋亡。Oh等发现在紫外线的刺激下,PBK可与JNK1相结合,导致PBK-JNK1-c-Jun信号通路被激活,进而激活核转录因子激活蛋白1(activator protein-1,AP-1),诱导皮肤癌发生。TOPK与p53结合后可使抑癌基因p53失活,促进纤维肉瘤细胞生长。尤文肉瘤中,当抑制尤文肉瘤-友人白血病病毒整合1(Ewing sarcoma-friend leukemia integration 1,EWS-FLI1)异位融合后,PBK/TOPK的表达下调,可抑制细胞的增殖及聚集性生长能力。另有研究表明,PBK/TOPK的mRNA和蛋白的表达水平在胶质母细胞瘤中均升高,且与患者的生存期呈负相关。
5 PBK/TOPK与肿瘤耐药
肿瘤耐药是造成肿瘤化学治疗失败的主要原因,也是目前临床上治疗恶性肿瘤的最大障碍。PBK/TOPK参与肿瘤耐药的形成,与肿瘤治疗的有效性降低有关。
既往研究表明,在对EGFR治疗耐药和存在BRAF或KRAS突变的结肠癌患者中,高表达的PBK/TOPK参与EGFR治疗的耐药过程,而应用TOPK抑制剂可使30%~40%的结肠癌患者获益;在存在FMS样酪氨酸激酶3(FMS-like tyrosine kinase 3,FLT3)突变且FLT3抑制剂治疗抵抗的急性髓细胞样白血病患者中,抑制PBK/TOPK功能的靶向治疗也可达到缓解病情的作用。PBK/TOPK可通过激活c-Jun S63和S73,提高AP-1的转录活性,提高AP-1靶基因CCND1和CDC2的表达水平,从而诱导肺癌细胞对EGFR抑制剂吉非替尼产生耐药性。过表达的PBK/TOPK可明显降低奥沙利铂的抗肿瘤作用,提示PBK/TOPK可能介导了结肠癌细胞对奥沙利铂的耐药性,而miRNA-216b-TOPK轴可能是治疗大肠癌的重要分子药物靶点。PBK/TOPK缺失可抑制G/M期检查点的激活,促进染色体畸变、多核和凋亡,可使肺癌、前列腺癌、宫颈癌、膀胱癌和喉癌等肿瘤细胞系特异性放射增敏。因此,PBK/TOPK的检测可用于指导肿瘤患者术后辅助放化疗。
6 PBK/TOPK抑制剂
PBK/TOPK抑制剂通过抑制PBK/TOPK的活性,阻断PBK/TOPK下游信号通路,抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,从而达到抑制肿瘤生长的作用。近年来,关于PBK/TOPK抑制剂在各种恶性肿瘤中的作用机制及临床效果的研究取得明显进展。
6.1 针对PBK/TOPK结构设计合成的化合物
Kim等首次提取出能抑制PBK/TOPK蛋白活性的合成化合物,其中,HI-TOPK-032可显著上调p53的表达,提高caspase 7、CDC2、多腺苷二磷酸核糖聚合酶 [poly(ADP-ribose)polymerase,PARP]等在细胞中的磷酸化水平,并明显降低PBK/TOPK下游分子ERK、核糖体S6激酶(ribosomal S6 kinase,RSK)的磷酸化水平,有效促进结肠癌细胞凋亡。该抑制剂尚未应用于临床,但在小鼠移植瘤模型实验中暂未发现严重不良反应。Matsuo等发现了OTS514和OTS964两种药物,这两种药物可能会造成严重的造血功能障碍,但其脂质体形式抑制剂基本无毒性。两者可抑制肺癌细胞A549、乳腺癌细胞LU-99以及原代卵巢癌细胞和小鼠卵巢癌移植瘤模型的生长,还可协同母体胚胎亮氨酸拉链蛋白激酶(maternal embryonic leucine zipper kinase,MELK)抑制剂诱导肾肿瘤细胞凋亡。研究发现,OTS514还能上调FOXO3及其转录靶点 CDKN1A(P21)和 CDKN1B(P27)的表达,诱导人骨髓瘤细胞系凋亡。
6.2 临床发现的TOPK抑制活性药物
降血脂药物阿托伐他汀可通过抑制甲羟戊酸途径和香叶酰化,失活Yes相关蛋白(Yes-associated protein,YAP)信号通路,下调PBK的表达,从而抑制雌激素受体(ER)阴性表达的乳腺癌细胞MDA-MB-231的增殖,对ER阳性表达的乳腺癌细胞MCF7的增殖无明显影响。抗生素头孢拉定也可作为PBK/TOPK的抑制剂,以时间、剂量依赖的方式抑制下游分子p38、JNK、ERK1/2和核因子κB(nuclear factor-κB,NF-κB)p65等的磷酸化,下调第139位丝氨酸磷酸化的组蛋白H2AX(the phosphorylation of histone H2AX at Ser 139,γ-H2AX)基因的表达,抑制白细胞介素-6(interleukin-6,IL-6)与肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎性因子的分泌,可用于治疗紫外线引起的皮肤疾病,如日光性皮炎、银屑病、恶性黑色素瘤和基底细胞癌等。临床上,用于胃食管反流病、消化性溃疡的泮托拉唑也是一种PBK/TOPK抑制剂,能抑制结直肠肿瘤的生长。Zheng等推测其他质子泵抑制剂类药物也可能具有此抗肿瘤活性,并通过实验证实,艾普拉唑可以有效抑制TOPK下游分子的活性,明显减低组蛋白H3的磷酸化,起到抑制结直肠癌细胞生长的作用。上述几种药物运用于临床多年,其不良反应已研究得较为透彻,对于药品开发,不仅降低了成本,还节省了时间。可用作男性避孕药的多酚化合物棉酚也可明显抑制PBK/TOPK磷酸化,诱导白血病HL-60细胞分化,虽然使用棉酚后可能会出现低钾血症、肝功能损害等不良反应,但相较于白血病,这些不良反应更易治疗。
6.3 从自然界直接提取的PBK/TOPK抑制剂
咖啡中富含的酚类植物化学物质(如咖啡酸、绿原酸)能够以三磷酸腺苷(adenosine triphosphate,ATP)非竞争性的方式与PBK/TOPK相互作用,抑制其活性,从而抑制结肠癌发生肺部转移。无毒化合物岩藻多糖(fucoidan)能抑制TOPK/ERK1/ERK2/丝裂原和应激激活蛋白激酶1(mitogen-and stress-activated protein kinase 1,MSK1)信号通路的激活,抑制EGF诱导的细胞发生恶性转化。从甘草中提取的甘草香豆素可下调PBK/TOPK的磷酸化水平,从而激活p53,抑制肝癌细胞的增殖,并诱导其凋亡。姜黄素和人参皂苷Rh2可与PBK/TOPK直接结合,以剂量依赖的方式降低PBK/TOPK下游信号因子ERK1/2和H3的磷酸化水平,诱导结肠癌细胞HCT116凋亡。芍药醇能以浓度依赖的方式靶向抑制PBK/TOPK,减少日光性皮炎的发生。黄芩苷在体内外均可通过直接与PBK/TOPK结合抑制TOPK的活性,降低肺癌细胞的增殖速度。越来越多的中药成分被发现具有抑制PBK/TOPK活性的作用,在今后的研究中,中国学者应利用本国优势,大力开发传统中草药的医用价值。
由于胎儿体内也存在大量PBK/TOPK,因此,PBK/TOPK抑制剂不能应用于妊娠期妇女。另有研究发现,在局部缺血或再灌注损伤的脑组织、心肌细胞及肾脏中,PBK/TOPK可发挥抗炎、抗氧化等作用,保护神经细胞,修复心肌,并通过激活TOPK-PTEN-AKT信号通路保护肾脏,提示PBK/TOPK可能是临床治疗缺血再灌注损伤的潜在治疗靶点,而患有缺血或再灌注损伤的肿瘤患者应禁用其靶向抑制剂。
7 小结与展望
随着对PBK/TOPK介导的信号通路及其影响的细胞因子的不断研究,调控肿瘤细胞增殖、存活、侵袭、转移、抵抗凋亡及耐药形成等方面的机制逐渐清晰,但在部分肿瘤中的作用机制仍不十分明确,有待进一步探索。PBK/TOPK抑制剂能够特异性结合PBK/TOPK,目前,有关PBK/TOPK抑制剂的研究相对较多,且在细胞株和移植瘤动物模型试验中显示出了良好的抗肿瘤效应,在肿瘤靶向治疗方面具有很好的临床价值和应用前景。然而,PBK/TOPK抑制剂的开发大多还处于临床前研究阶段或临床试验阶段,并未真正应用于临床肿瘤治疗领域。尽管如此,PBK/TOPK的重要作用是有目共睹的,相信越来越多的特异性PBK/TOPK抑制剂将会被应用于肿瘤的基础和临床研究中,为肿瘤患者及家庭带来新的希望。

