脂肪因子CTRP1 与2 型糖尿病合并脑梗死患者脂代谢异常的相关性研究
辛雅萍 祝艺涵 李天天 张 琦
郑州大学第二附属医院,河南 郑州450003
2 型糖尿病是由环境、遗传、免疫等多因素所引起的代谢性疾病,糖/脂代谢紊乱是其重要病理特征,脑梗死是其主要并发症之一[1]。动脉粥样硬化作为脑梗死的主要发病原因,与体内炎症状态和脂代谢障碍密切相关[2]。脂肪细胞因子补体C1q 肿瘤坏死因子相关蛋白1(complement C1 tumor necrosis factor-related protein 1,CTRP1)是CTRP 超家族成员之一,是一种分泌型糖蛋白,由199个氨基酸组成,属G蛋白耦连受体作用蛋白,主要由脂肪基质细胞,如脂肪前体细胞、成纤维细胞、成熟内皮细胞和平滑肌细胞等产生,参与调控葡萄糖、脂肪酸代谢和炎症等多个环节[3]。本课题组前期发现2 型糖尿病患者血清中CTRP1 高表达,并可作为促炎因子放大炎症反应,加重糖/脂代谢紊乱[4-5]。相关研究也证实CTRP1参与脂代谢过程,并与动脉粥样硬化关系密切[6]。但CTRP1 是否与糖尿病患者合并脑梗死相关,还尚未见相关研究报道。
动脉粥样硬化与脂代谢异常密切相关。三酰甘油脂肪酶(adipose triglyceride lipase,ATGL)是一种新发现的脂肪因子,是三酰甘油水解的主要限速酶,在三酰甘油水解中起最基础的作用,其活性下降可导致高三酰甘油血症和高密度脂蛋白水平下降,是形成动脉粥样硬化的危险因素[7]。内皮脂酶(endothelial lipase,EL)是近年来发现的甘油三酯脂肪酶基因家族的新成员,不仅参与高密度脂蛋白的代谢,还可能通过其他非脂解作用参与动脉粥样硬化的形成,是一种值得关注的新型脂肪酶[8-10]。脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)是由血管内膜的巨噬细胞、T细胞和肥大细胞合并、分泌的,能促使氧化磷脂水解的磷脂酶,可参与动脉硬化硬化斑块的形成[11-12]。本研究采用病例对照研究,检测血清CTRP1 及 相 关 脂代谢 酶ATGL、EL 和Lp-PLA2 水平,并结合相关临床指标,进一步分析CTRP1 与相关脂代谢酶在2 型糖尿病患者脑梗死发生中的作用,为明确2 型糖尿病合并脑梗死的临床诊断和发病机制研究提供实验依据。
1 对象和方法
1.1 研究对象 选取2018-12—2020-10 在郑州大学第二附属医院确诊的2型糖尿病患者72例为研究对象,其中2 型糖尿病患者36 例,2 型糖尿病合并脑梗死患者36例。选取34例来院健康体检且年龄、性别匹配者为对照组。所有患者进行疾病相关检查,包括血压、血糖、血脂、颈动脉超声、磁共振成像和磁共振血管造影等。根据患者的病史、神经学检查、实验室检查、磁共振成像和血管造影结果诊断脑梗死。脑梗死按TOAST 分类[13]分为大动脉粥样硬化型、心源性脑栓塞、小动脉腔隙性脑梗死、其他特殊病因和不明原因脑梗死。本研究合并脑梗死组中,只有大动脉粥样硬化性脑梗死患者入选。所有2 型糖尿病患者按1999 年世界卫生组织标准诊断,空腹血糖≥7 mmol/L(126 mg/dL),口服葡萄糖耐量试验2 h 血糖≥11.1 mmol/L(200 mg/dL),或经临床诊断[14]。排除心房颤动、心肌梗死、肿瘤、急性感染性疾病、严重免疫性疾病、血液疾病、肝肾衰竭以及脑出血患者。
1.2 血清样本采集 于清晨空腹状态下抽取受试者肘静脉血约6 mL,静置2 h,使用离心机以2 000 r/min转速离心10 min,吸取上层血清保存至2 mL冻存管,并标记患者住院号、姓名后保存于 80 ℃冰箱待检。
1.3 临床相关数据 记录研究对象的年龄、身高、体质量等一般情况。采用标准公式[体质量(kg)/身高(m2)]计算体重指数(BMI)。在静息状态下用标准血压计测量坐位收缩压和舒张压。用全自动生化分析仪测定空腹血糖(FPG)、糖化血红蛋白(HbA1c)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)和甘油三酯(TG)。
1.4 实验方法 采用酶联免疫吸附试验(ELISA)检测血清CTRP1、ATGL、EL 和Lp-PLA2 水平。上述试剂均由上海江莱生物公司提供,严格按照说明书要求进行操作。
1.5 统计学分析 采用SPSS 20.0 软件进行统计分析。数据用均值±标准差,或中位数、最大值和最小值描述,不同组间分类资料的比较采用χ2检验或Fisher 精确检验,多样本定量资料的比较采用方差分析,计量资料相关性检验采用Pearson 相关分析和R 软件分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料分析 3组年龄和血压比较均无显著性差异(P>0.05)。而糖尿病合并脑梗死组BMI 显著高于对照组(P<0.01)和糖尿病组(P=0.01)。各组血脂相关指标对比分析显示,糖尿病合并脑梗死组TC 和TG 均显著高于对照组(TC:P<0.01 和TG:P=0.047),而HDL-C较对照组明显下降(P=0.037)。糖尿病患者是否合并脑梗死相关血脂分析显示,合并脑梗死患者TC 水平较单纯糖尿病患者显著升高(P<0.01),而TG、HDL-C和LDL-C水平在糖尿病是否合并脑梗死患者间差异无统计学意义(P>0.05)。见表1。
表1 3组临床资料及血清CTRP1、相关脂代谢酶水平比较 (±s)Table 1 Comparative analysis of clinical data, serum CTRP1 and related lipid metabolic enzymes (±s)
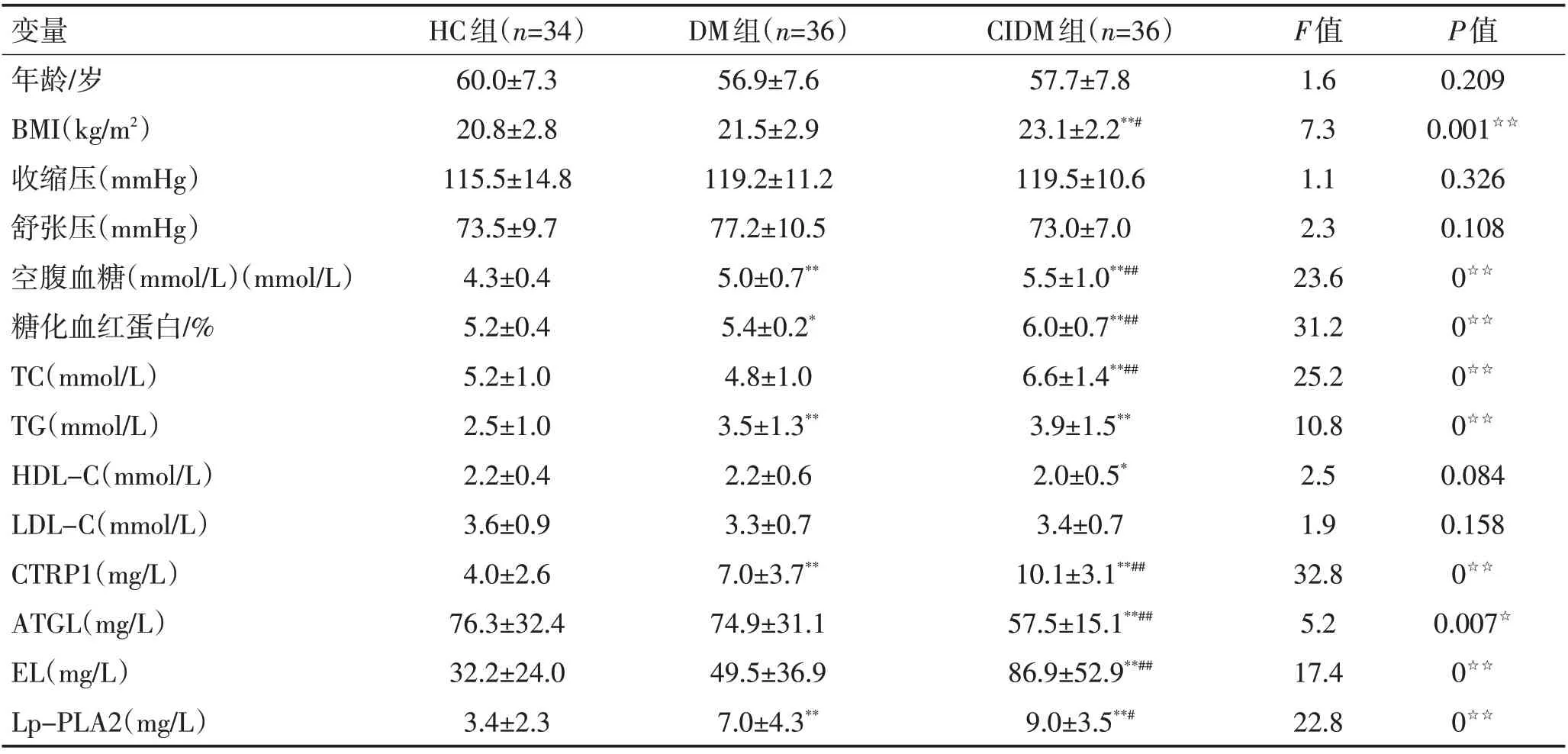
表1 3组临床资料及血清CTRP1、相关脂代谢酶水平比较 (±s)Table 1 Comparative analysis of clinical data, serum CTRP1 and related lipid metabolic enzymes (±s)
注:BMI=体重/身高2(kg/m2)。☆P<0.05,☆☆P<0.01;与对照组比较,*P<0.05,**P<0.01;与DM组比较,#P<0.05,##P<0.01
变量年龄/岁BMI(kg/m2)收缩压(mmHg)舒张压(mmHg)空腹血糖(mmol/L)(mmol/L)糖化血红蛋白/%TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)CTRP1(mg/L)ATGL(mg/L)EL(mg/L)Lp-PLA2(mg/L)HC组(n=34)60.0±7.3 20.8±2.8 115.5±14.8 73.5±9.7 4.3±0.4 5.2±0.4 5.2±1.0 2.5±1.0 2.2±0.4 3.6±0.9 4.0±2.6 76.3±32.4 32.2±24.0 3.4±2.3 DM组(n=36)56.9±7.6 21.5±2.9 119.2±11.2 77.2±10.5 5.0±0.7**5.4±0.2*4.8±1.0 3.5±1.3**2.2±0.6 3.3±0.7 7.0±3.7**74.9±31.1 49.5±36.9 7.0±4.3**CIDM组(n=36)57.7±7.8 23.1±2.2**#119.5±10.6 73.0±7.0 5.5±1.0**##6.0±0.7**##6.6±1.4**##3.9±1.5**2.0±0.5*3.4±0.7 10.1±3.1**##57.5±15.1**##86.9±52.9**##9.0±3.5**#F值1.6 7.3 1.1 2.3 23.6 31.2 25.2 10.8 2.5 1.9 32.8 5.2 17.4 22.8 P值0.209 0.001☆☆0.326 0.108 0☆☆0☆☆0☆☆0☆☆0.084 0.158 0☆☆0.007☆0☆☆0☆☆
2.2 血清CTRP1 及相关脂代谢酶水平组间对比相关血清实验结果显示(表1),糖尿病合并脑梗死组血清CTRP1与相关脂代谢酶水平均较另2组有显著差异。其中,糖尿病合并脑梗死组CTRP1水平较高,而糖尿病组和对照组依次下降,且较2组均有显著性差异(较糖尿病组,P<0.01;较对照组,P<0.01)。合并脑梗死组ATGL 水平较低,较对照组和糖尿病组均有显著性差异(较糖尿病组,P=0.007;较对照组,P=0.005)。EL和Lp-PLA2在合并脑梗死组中水平较高,与对照组和糖尿病组均有显著差异(EL:较糖尿病组,P<0.01,较对照组,P<0.01;Lp-PLA2:较糖尿病组,P=0.018,较对照组,P<0.01)。糖尿病组和对照组血清ATGL和EL水平比较差异无统计学意义(P>0.05)。
2.3 合并脑梗死患者血清CTRP1 与相关脂代谢酶的相关性分析 血清CTRP1与相关脂代谢酶ATGL、EL 和Lp-PLA2 的相关分析显示,CTRP1 均与EL 和Lp-PLA2 呈正相关(EL:r=0.64,P<0.01;Lp-PLA2:r=0.37,P=0.026),但与ATGL 无相关性。而EL 也与Lp-PLA2呈正相关(r=0.37,P=0.027)(图1)。

图1 血清CTRP1与相关脂代谢酶相关性分析Figure 1 Analysis of the relationship between serum CTRP1 and related lipid metabolic enzymes
3 讨论
2 型糖尿病患者体内的炎症状态和脂代谢异常是脑梗死的重要危险因素。2 型糖尿病患者血清中高表达的CTRP1,不仅与脂代谢异常和动脉粥样硬化相关,还可作为促炎因子放大炎症反应,其可能在2型糖尿病合并脑梗死患者的发病中扮演重要角色。
本研究显示,2 型糖尿病合并脑梗死患者组BMI 及相关脂代谢指标TC、TG 和HDL-C 均与对照组存在显著性差异,而其中TC血清水平较单纯糖尿病组也有显著性差异,提示脂代谢异常可能是合并大动脉粥样硬化性脑梗死的危险因素,而TC 水平的升高与糖尿病合并脑梗死关系密切。研究证实,HDL-C 与2 型糖尿病合并颈动脉粥样硬化相关,而代谢综合征中TC和TG水平也是脑梗死发生的危险因素[2,15-17]。然而糖尿病的炎症状态,伴随的脂代谢紊乱及大血管粥样硬化之间的关系尚未明确。
CTRP1 可参与2 型糖尿病发病过程中调控葡萄糖、脂肪酸代谢和炎症等多个环节。高强度间歇训练(high-intensity interval training,HIIT)是一种有效的运动训练方案,可增强能量物质的代谢及提高胰岛素敏感性。研究发现,HIIT 后120 min CTRP1 浓度显著增加,提示CTRP1 可提高葡萄糖的代谢水平并增加胰岛素的敏感性[18]。转基因小鼠研究也表明,CTRP1 过表达可致小鼠在高脂喂养的代谢应激状态下,糖负荷后血糖升高程度明显低于非转基因对照,外周组织胰岛素敏感性更高。此外,CTRP1高表达还可改善因脂连素基因敲除导致的小鼠高血糖及胰岛素抵抗现象,提示CTRP1 可能有类脂连素功能,或独立于脂连素机制的降血糖功能[19-22];而糖代谢异常小鼠经胰岛素增敏药物罗格列酮治疗后,其脂肪组织CTRP1 mRNA 表达也有上调,提示其可能参与了胰岛素增敏药物的血糖调节作用[23-24]。本课题组前期也发现CTRP1具有调节“糖代谢稳态”的作用,可降低血糖,改善胰岛素抵抗。但其本身也可作为促炎因子放大炎症反应,加重糖/脂代谢紊乱[4-5]。而CTRP1 是否作用于糖尿病合并脑梗死的发生,尚未见相关研究报道。本研究血清CTRP1 结果显示,合并脑梗死组CTRP1水平较单纯糖尿病组和对照组有显著性差异,提示CTRP1 可能与糖尿病患者发生动脉粥样硬化型脑梗死相关。LU 等[6]研究发现,主动脉粥样硬化患者血清CTRP1水平显著升高。同时动物实验也证实,CTRP1 可导致小鼠动脉粥样硬化。而MUENDLEIN等[25]研究报道,CTRP1与主要不良心血管事件的发生率显著相关。上述研究与本研究结果相似,CTRP1 可能与脑血管动脉粥样硬化的发生密切相关,是合并脑梗死的危险因素。
动脉粥样硬化的发生与异常脂代谢和炎症因子密切相关。CTRP1本身可以作为促炎因子加重炎症反应,而其诱发的炎症状态是否导致脂代谢酶功能改变,加重脂代谢紊乱,从而导致动脉粥样硬化,相关机制尚未明确。本研究相关脂代谢酶结果显示,血清中ATGL水平显著低于对照组和单纯糖尿病组,而EL和Lp-PLA2水平显著高于另外两组,提示它们与动脉粥样硬化型脑梗死的发生密切相关。以往研究报道,脂肪酶ATGL 具有水解三酰甘油的能力,此酶活性下降可导致高三酰甘油血症和HDL 水平下降,从而形成动脉粥样硬化[26-29]。而EL 则可以介导脂蛋白特别是HDL 和硫酸肝素蛋白多糖结合,这一过程与胆固醇逆向转运和脂蛋白再循环密切相关,可产生抗动脉粥样硬化作用[30-32]。Lp-PLA2 不仅可水解LDL-C上的氧化卵磷脂以生成氧化型游离脂肪酸及溶血型卵磷脂,进而导致氧化型LDL 转变为泡沫细胞,最终形成动脉粥样硬化斑块。Lp-PLA2 可促进斑块的不稳定性,参与斑块形成各阶段,在动脉粥样硬化晚期Lp-PLA2水平显著升高[33-36]。本研究结果与上述研究一致,说明3种脂代谢酶与动脉粥样硬化型脑梗死的发生密切相关。而合并脑梗死组血清CTRP1 水平也显著升高,且本身具有炎症放大和参与脂代谢功能。CTRP1与上述脂代谢酶是否有关联?本研究针对CTRP1 与脂代谢酶相关性研究显示,CTRP1 与EL 和Lp-PLA2 均 呈 正 相 关,提 示CTRP1 可能通过正向调节脂肪酶EL 和Lp-PLA2 的水平参与脂代谢过程,诱发/加重动脉粥样硬化的发生发展,是导致糖尿病患者合并脑梗死的高危因素。
大血管病变作为2型糖尿病常见的并发症,其中合并脑梗死的发生一直受到关注。脂肪因子CTRP1不仅在2 型糖尿病发病中作为调节糖代谢稳态的重要因素,还是连接脂代谢与炎症状态的耦联分子。本研究发现,脂肪因子CTRP1 可能通过刺激调节脂代谢酶EL和Lp-PLA2的水平,诱发/加重2型糖尿病患者脑梗死的发生,可作为预测合并脑梗死发生的高危因素之一。

