硝黄散外敷联合阿奇霉素干混悬剂对肺炎支原体肺炎患儿的临床疗效研究①
李宏贵,梁俊杰,蔡伟桐
(广州中医药大学第一附属医院儿科,广州510405)
小儿肺炎支原体肺炎(Mycoplasma Pneumoniae Pneumonia,MPP)是由肺炎支原体(Mycoplasma Pneumoniae,MP)感染引起的儿童时期常见的社区获得性肺炎[1],在不同地区、不同季节可引起一定范围的流行[2],其发病机制尚未完全阐明,目前学者认为是MP对呼吸道粘膜直接损伤及免疫炎症反应有关[3-4],部分患儿可遗留不同程度的肺部后遗症[5-6],还可出现肺外并发症[7],甚至导致哮喘的发生[8],对儿童健康造成不同程度的危害[9]。目前西医常规治疗主要采用抗感染及对症支持为主[10],但随着药物耐药率的增加[11-12],难治及重症病例需要激素或人免疫丙种球蛋白治疗[13-14],但仍有部分患儿不能取得较好的疗效,并对肺功能造成不同程度的损伤[15]。硝黄散主要由芒硝、大黄研末与大蒜泥按比例混合而成,具有清热泻火、宣肺平喘、止咳化痰、解毒散瘀作用。据现代药理研究发现,芒硝主要成分是硫酸钠,外敷时可促使组织水分向体外渗出,从而大量摄取组织内渗出,并具有抑菌抗炎的作用[16];大黄具有抗病原微生物及抗炎作用[17],通过减轻炎症反应,从而改善肺功能。本研究探讨硝黄散外敷联合阿奇霉素干混悬剂对肺炎支原体肺炎患儿的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料 选择2018年9月-2019年12月在广州中医药大学第一附属医院儿科住院的MPP患儿100例为研究对象,按入院的先后顺序随机编号,采用随机数字表法,分为阿奇霉素组及联合治疗组,每组各50例。阿奇霉素组:男性27例,女性23例,年龄6~14岁,平均年龄(8.52±1.80)岁,病程1~7 d,平均病程(4.10±1.68)d;联合治疗组:男性25例,女性25例,年龄6~14岁,平均年龄(8.12±2.13)岁,病程1~7 d,平均病程(3.66±1.59)d。两组患儿性别比、平均年龄及病程等基线水平比较,差异无统计学意义(P>0.05),具有可比性。本研究经过广州中医药大学第一附属医院伦理委员会审核批准。
1.2 诊断标准 诊断标准参考《诸福棠实用儿科学》(第8版)[18]和《儿童社区获得性肺炎管理指南》(2013修订)[19]:(1)发热,咳嗽,部分伴有喘息等症状;(2)肺部听诊呼吸音粗或减弱,或可闻及固定细湿啰音;(3)血清学检测MP-IgM阳性或单份血清MP-Ab≥1∶160,或恢复期和急性期双份血清MP-IgM或IgG抗体滴度呈4倍或4倍以上增高或减低;(4)放射学检测:胸片检查提示肺炎。符合上述各项可诊断为MPP。
1.3 纳入及排除标准
1.3.1纳入标准(1)符合MPP诊断标准者;(2)年龄6岁-14岁;(3)病程在1周以内;(4)该研究经医院伦理委员会审查批准;(5)患儿监护人签署知情同意书。
1.3.2排除标准(1)难治性MPP;(2)伴有原发性疾病患儿;(3)近2个月出现其他感染性疾病患儿;(4)监护人不同意参与本实验者。
1.4 治疗方法 两组患儿按10mg/kg体质量口服阿奇霉素干混悬剂(希舒美,辉瑞制药有限公司,国药准字号H10960112)抗支原体治疗,连续口服3 d为1个疗程。联合治疗组口服阿奇霉素同时配合硝黄散外敷(广州中医药大学第一附属制剂室制备),将药散与蒜泥按5∶4混合,以清水调成糊状;根据敷药面积,取大小合适的敷料,将调好的硝黄散,均匀地平摊在敷料上,厚度约0.3 cm~0.5 cm,每个药饼面积约8 cm×8 cm~10 cm×10 cm,每次敷药时间为20 min,连续治疗7 d。
1.5 观察指标的测定
1.5.1 患儿治疗前后指标的记录 记录患儿治疗前后的体温、咳嗽、肺部啰音及住院天数。
1.5.2 血液分析的检测 2组患儿治疗前及治疗7 d后分别取静脉血2 mL,离心后,使用迈瑞血液分析仪(迈瑞医疗国际股份有限公司生产,型号:BC-6800)检测患儿治疗前后白细胞计数(WBC×109/L)、中性粒细胞比例(NEU%)、淋巴细胞比例(LYM%)的变化。
1.5.3 C-反应蛋白的检测 2组患儿治疗前及治疗7 d后分别取静脉血2 mL,使用乳胶免疫比浊法检测(试剂盒生产厂家:贝克曼,型号:immage,批号M002204)患儿治疗前后静脉血C-反应蛋白(CRP)的变化。
1.5.4 肺功能的测定 采用肺功能检测仪(德国耶格公司生产,型号:MasterScreen PFT System,国械注进20152210628)测定两组患儿用力肺活量(FVC)、1s用力肺活量(FEV1)、峰流速(PEF)、75%、50%、25%肺活量时的呼气流量(FEF25、FEF50、FEF75)。
1.6 疗效评价标准[20]痊愈:临床症状、体征消失或基本消失,症候积分减少>90%;显效:临床症状、体征改善明显,75%<症候积分减少<90%;有效:临床症状、体征均有好转,30%<症候积分减少<75%;无效:临床症状体征无改善,甚至加重,症候积分减少<30%。总有效率=(痊愈+显效+有效)/总人数×100%。
1.7 统计学处理 采用SPSS25.0统计学软件进行统计分析,计量资料以均数±标准差(±s)表示,采用t检验,计数资料以例(%)表示,采用χ2检验,检验水准α=0.05。
2 结果
2.1两组患儿治疗后有效率比较 与阿奇霉素组比较,联合治疗组患儿总有效率提高,差异有统计学意义(P<0.05),见表1。
2.2 两组患儿治疗临床症状体征、住院天数比较 与阿奇霉素组比较,联合治疗组患儿治疗后发热、咳嗽消失、肺部啰音消失、住院时间均缩短,差异有统计学意义(P<0.05),见表2。

表1 两组患儿有效率比较/例(%)
表2 两组MPP患儿临床症状体征、住院天数比较(-±s)

表2 两组MPP患儿临床症状体征、住院天数比较(-±s)
注:与阿奇霉素组治疗后比较,*P<0.05。
组别阿奇霉素组(n=50)联合治疗组(n=50)P值t值发热时间/d 3.14±1.37 2.48±1.09 0.009 2.663咳嗽消失时间/d 5.02±1.42 4.50±1.05 0.040 2.078肺部啰音消失时间/d 5.30±1.88 4.66±1.89 0.044 2.038住院天数/d 7.00±1.94 6.00±1.21 0.003*3.094
2.3 两组患儿治疗前后白细胞计数、中性粒细胞比 例、淋巴细胞比例、C-反应蛋白比较 两组治疗前WBC、NEU%、LMY%、CRP比较,差异无统计学意义(P>0.05);两组治疗后WBC、NEU%、CRP低于治疗前,LMY%高于治疗前,差异有统计学意义(P<0.05);与阿奇霉素组比较,联合治疗组治疗后WBC、NEU%、CRP降低,LMY%升高,差异有统计学意义(P<0.05),见表3。
2.4 两组治疗前后肺功能比较 两组治疗前肺功能FVC、FEV1、PEF、FEF25、FEF50、FEF75比较,差异无统计学意义(P>0.05);两组治疗后FVC、FEV1、PEF、FEF25、FEF50、FEF75高于治疗前,差异有统计学意义(P<0.05);与阿奇霉素组比较,联合治疗组治疗后FVC、FEV1、PEF、FEF25、FEF50、FEF75升高,差异有统计学意义(P<0.05),见表4。
表3 两组患儿治疗前后炎症指标比较(-±s)

表3 两组患儿治疗前后炎症指标比较(-±s)
注:与阿奇霉素组治疗前比较,*P>0.05;与同组治疗前比较,#P<0.05;与阿奇霉素组治疗后比较,&P<0.05。WBC:白细胞计数;NEU:中性粒细胞比例;LYM:淋巴细胞;CRP:C-反应蛋白。
组别阿奇霉素组(n=50)治疗前治疗后联合治疗组(n=50)治疗前治疗后WBC/(×109/L)12.52±3.38 8.26±1.74#13.30±2.58*6.62±1.95#&NEU/%64.89±13.07 58.47±8.55#66.22±12.44*50.51±6.99#&LYM/%31.79±12.53 39.95±8.36#32.39±12.49*47.11±7.10#&CRP/(mg/L)12.44±7.63 6.87±3.25#18.04±11.56*5.30±3.08#&
表4两组MPP患儿肺功能比较(±s)
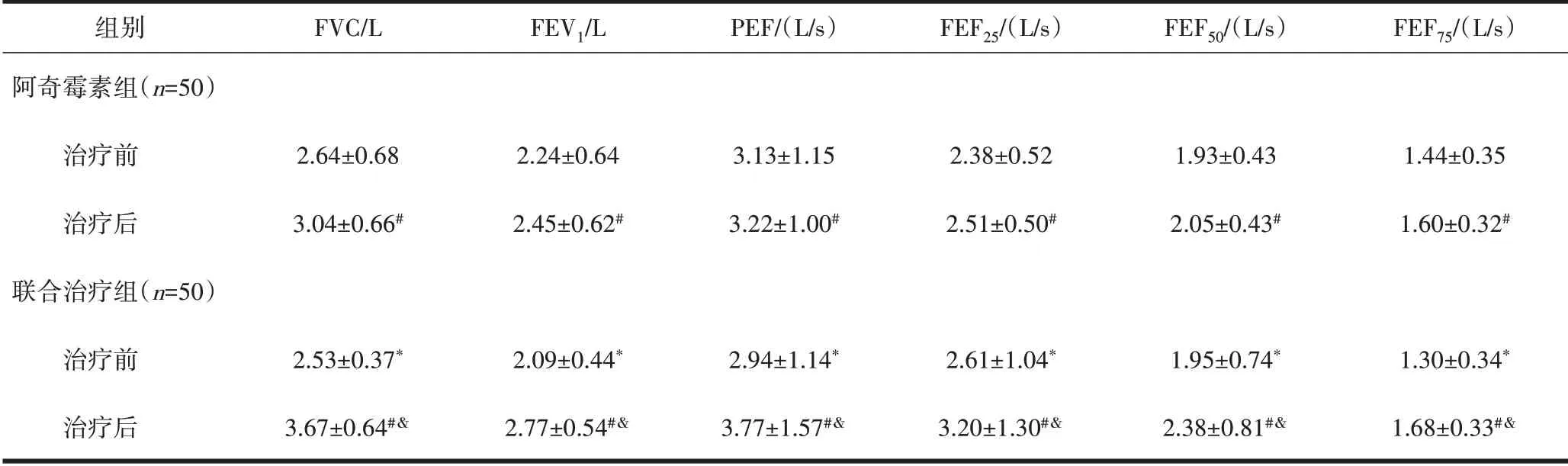
表4两组MPP患儿肺功能比较(±s)
注:与阿奇霉素组治疗前比较,*P>0.05;与同组治疗前比较,#P<0.05;与阿奇霉素组治疗后比较,&P<0.05。FVC用力肺活量;FEV1:1s用力肺活量;PEF:峰流速;FEF25、FEF50、FEF75:75%、50%、25%肺活量时的呼气流量。
组别阿奇霉素组(n=50)治疗前治疗后联合治疗组(n=50)治疗前治疗后FVC/L 2.64±0.68 3.04±0.66#2.53±0.37*3.67±0.64#&FEV1/L 2.24±0.64 2.45±0.62#2.09±0.44*2.77±0.54#&PEF/(L/s)3.13±1.15 3.22±1.00#2.94±1.14*3.77±1.57#&FEF25/(L/s)2.38±0.52 2.51±0.50#2.61±1.04*3.20±1.30#&FEF50/(L/s)1.93±0.43 2.05±0.43#1.95±0.74*2.38±0.81#&FEF75/(L/s)1.44±0.35 1.60±0.32#1.30±0.34*1.68±0.33#&
3 讨论
肺炎支原体感染机体后可激活中性粒细胞,释放肿瘤坏死因子α(TNF-α)等炎症因子,TNF-α并可刺激B细胞增殖和IgG分泌,增加毛细血管的通透性,TNF-α通过上调内皮细胞表达粘附分子,趋化中性粒细胞至支气管肺组织,并与其他细胞因子如IFN-γ、IL-1等增加及活化中性粒细胞的蛋白水解酶,引起气道炎症和气流阻塞的形成,从而引起肺功能的改变[21]。研究[22]还证实,肺炎支原体感染后可致呼吸道上皮细胞纤毛运动功能障碍或上皮细胞脱落,堵塞管腔,导致小气道闭塞,气流不畅,通气受限,从而出现反映肺功能的参数,如FVC、FEV1、PEF、FEF25、FEF50、FEF75等的变化。
本研究采用口服阿奇霉素干混悬剂联合硝黄散外敷治疗,结果显示,与阿奇霉素组比较,联合治疗组的总有效率高于阿奇霉素组。联合治疗组退热时间、咳嗽消失时间、肺部啰音吸收时间及住院天数均短于阿奇霉素组,这一结果表明,硝黄散外敷联合阿奇霉素干混悬剂口服能够明显改善患儿临床症状体征,减少住院天数。
MP感染后可引起强烈的炎症反应,导致肺功能损害,因此抑制过强的炎症反应,能够减轻对肺功能的损害[23]。本研究中采用的硝黄散外敷联合阿奇霉素口服治疗后,联合治疗组患儿白细胞计数、中性粒细胞比例、超敏C反应蛋白含量等炎症指标低于单独使用阿奇霉素组,并且治疗后肺功能FVC、FEV1、PEF、FEF25、FEF50、FEF75高于阿奇霉素组。这一结果表明硝黄散外敷联合阿奇霉素干混悬剂口服,能够减轻炎症反应,促进肺功能的恢复。
综上所述,硝黄散外敷联合阿奇霉素干混悬剂运用于MPP患儿的治疗,效果明显,能够较好缓解临床症状,减轻炎症反应,促进肺功能的恢复,值得在临床上推广应用。

