负载人工抗原递呈细胞的Fe3O4磁性碳纳米粒子对滋养细胞凋亡、侵袭及黏附能力的影响①
贺红梅,邵长好,陆春燕,才秋敏
(秦皇岛市妇幼保健院病理科,河北秦皇岛066001)
原因不明复发性流产(unexplained recurrent spontaneous abortion,URSA)是指与同一性伴侣发生≥2次自然流产,且无解剖、内分泌、染色体、生殖道感染及自身免疫功能异常等病因[1]。已有研究显示,正常胚胎被母体接纳有赖于母-胎界面的妊娠免疫耐受,一旦该种耐受格局被打破,将导致URSA[2]。目前USRA以淋巴细胞主动免疫治疗、普通免疫抑制剂治疗为主,但成本高、操作复杂、毒副作用严重[3]。近年随着分子生物学的深入,已有研究发现,URSA患者绒毛组织中可见特征性的滋养细胞凋亡,且凋亡率相较于正常妊娠患者绒毛组织更高,提示滋养细胞过度凋亡可能是URSA发病原因之一[4]。滋养细胞的增殖、侵袭和黏附功能对于正常妊娠起着重要作用,若滋养细胞的大量凋亡则可导致其侵袭和黏附功能减弱,影响胎盘生长、成熟及功能,从而出现URSA等不良妊娠结局[5]。因此,探究诱导妊娠免疫耐受的有效方式,在治疗USRA上应用前景广阔。磁性Fe3O4具有优良的磁学性能,可结合纳米载药系统进行靶向药物输送及蛋白磁性分离,在基因治疗中可提高靶细胞的转染效率[6]。碳是一种理想的磁性纳米颗粒包覆材料,具有密度小,表面积大,稳定性高等特点。复合空心碳材料与磁性Fe3O4有助于提高生物体和磁性金属间的相容性,具有广阔的医学应用前景[7]。本研究旨在寻求一种综合的生物学方法来诱导母胎免疫耐受状态,采用生物学手段联合材料学前沿技术复合空心碳材料与磁性Fe3O4,同时负载人工抗原递呈细胞(artificial antigen presenting cells,aAPC)行生物靶向治疗,研究其对滋养细胞凋亡、侵袭、黏附的影响。
1 材料与方法
1.1材料 正常早孕流产妇女(孕7~9周)的绒毛,URSA患者外周血16 mL左右,均在患者同意且签署知情同意书后获取;aAPC购自中国科学院上海细胞库。
1.2 主要试剂和仪器 直标鼠抗人CK7-FITC单克隆抗体、CD3-FITC抗体(美国Thermo Fisher Scientific公司),Anexin V-FITC染液、PI染液(北京中山金桥生物技术有限公司);二甲基噻唑(dimethylthiazole,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)(上海源叶生物科技有限公司)。Transwell小室(北京优尼康生物科技有限公司),FACSCanto II流式细胞仪(美国BD公司),MPR-A100酶标仪(日本ASONE株式会社)。
1.3 方法
1.3.1 绒毛膜滋养细胞分离和鉴定 取正常早孕流产妇女的绒毛,用改良密度梯度离心法分离、培养原代胎盘滋养细胞[8]。培养72 h后,取500µL新鲜分离细胞悬液,固定并破膜后,加直标鼠抗人CK7-FITC单克隆抗体及山羊抗鼠IgG,各2µL,充分振荡,4℃孵育20 min,流式细胞仪鉴定细胞纯度。
1.3.2 CD3+T细胞分离和鉴定(1)与磁化aAPC结合的CD3+T细胞分离:合成直径分布在1~10µm、表面光滑的碳空心球,依次进行水解和热处理,合成碳空心球包覆Fe3O4纳米颗粒的复合粉末。以抗CD3和抗CD28mAb包被Fe3O4磁性碳纳米粒子形成磁化aAPC。采集URSA患者外周血8 mL,分离血浆,将磁化aAPC与血浆混合,从磁选柱中流过,与磁化aAPC结合的CD3+T细胞会附着在磁选柱一侧并被冲洗到液体培养基中进行生长和分裂。(2)CD3+T细胞分离:采用免疫磁珠分选技术分离CD3+T细胞。采集URSA患者外周血8 mL,分离外周血单个核细胞,调整细胞密度至1.0×107个/mL,加入20µL CD3磁珠,4℃避光孵育20 min,细胞悬浮、离心后弃上清,培养基500µL悬浮细胞,悬浮液过CD3+T细胞富集柱后经培养基500µL洗涤3次,转移至细胞收集试管中,添加培养基1 mL至柱中,活塞冲洗柱子,收集CD3+T细胞。(3)CD3+T细胞鉴定:调整细胞密度至1.0×106个/mL,取20µL CD3-FITC抗体,混合均匀后遮光孵育15 min,PBS震荡后洗涤、离心,弃上清,加入500µL PBS悬浮细胞,流式细胞仪鉴定纯度。
1.3.3与磁化aAPC结合的CD3+T细胞、滋养细胞共培养及分组 取6.4 mm膜直径、8µm孔径、24孔板细胞迁移(Transwell)小室,冰浴融化基底膜(Matrigel)胶,PBS稀释为1 mg/mL,50µL/孔预先铺设于Transwell小室上室滤膜上。下室中加入600µL密度为1.0×106个/mL与磁化aAPC结合的CD3+T细胞,培养基培养24 h后用于后续实验。与磁化aAPC结合的CD3+T细胞、滋养细胞,CD3+T细胞、滋养细胞共培养体系分别设置为A组、B组,每组设置5个复孔。Transwell小室下室中加入100µL密度为1.0×106个/mL与磁化aAPC结合的CD3+T细胞或培养基孵育,上室中加入100µL密度为1.0×106个/mL滋养细胞培养基。将单独滋养细胞培养体系设置为C组,设置5个复孔。Transwell小室下室中加入培养基孵育,上室中加入100µL密度为1.0×106个/mL滋养细胞培养基。各共培养体系均于37℃孵育24 h,取各组上室细胞行后续实验[9]。
1.3.4 AnnexinV-FITC/PI染色法测定各组凋亡情况取各组细胞制成单个细胞悬液,调整细胞密度为1×105个/mL。取1 mL细胞以2 800 r/min离心10 min,用PBS吹打15次重悬后再次离心10 min,弃上清液。用冷PBS洗涤2次,在细胞悬浮液中加入5µL Anexin V-FITC,混匀并置于2~8℃避光条件下孵育15 min后,加入5µL PI染液,混均并在2-8℃避光条件孵育5 min后,加入binding buffer标记液100µL洗涤2次。在制备完成的60 min内使用流式细胞仪测定细胞凋亡率,Cell Quest软件分析、计算数据。实验重复3次取平均值。
1.3.5 Transwell小室实验测定各组侵袭能力 冰浴融化Matrigel胶,PBS稀释为1 mg/mL,50µL/孔预先铺设于Transwell小室滤膜上,上室中加入密度为5.0×105个/mL的各组细胞,下室中加入200µL培养基。常规培养48 h至Matrigel胶被降解,PBS冲洗后0.25%戊二醛固定,30 min后0.1%结晶紫染色,洗涤、晾干。随机选取滤膜中央及周围共5个视野,计算穿过微孔细胞数/视野。实验重复3次取平均值。
1.3.6 黏附实验测定各组黏附能力 以无血清培养基RPMI-1640配置人工Matrigel胶(0.04µg/mL),预先铺设于96孔板(2µg/孔),超净台中风干24 h至凝固。取各组细胞,调整密度为1.0×105个/mL,将细胞悬液加入96孔板(200µL/孔),培养基中培养6 h后取出孔板,弃培养液,PBS清洗,加入培养基(200µL/孔)和新制备MTT溶液(5 mg/mL,20µL/孔),培养箱中继续培养4 h,吸干剩余培养基后加入DMSO溶液(150µL/孔),震荡15 min使结晶溶解,酶标仪检测490 nm吸光度值,以吸光度值表示黏附能力。实验重复3次取平均值。
1.4 统计学分析 应用SPSS19.0分析数据,计量资料用t检验,以均数±标准差(±s)表示,多样本资料比较用单因素方差分析,如Levene检验方差齐,用单因素方差分析,再用LSD-t两两比较,如Levene检验方差不齐,改用welch检验,再用Dunnett T3检验两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1滋养细胞纯度鉴定 经流式细胞仪检测,细胞表面CK7阳性细胞构成比为97.50%,见图1。
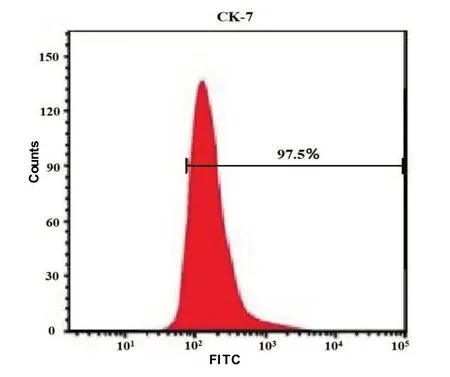
图1 滋养细胞表面特异性标志物表达情况
2.2 CD3+T细胞纯度鉴定 经流式细胞仪检测,与磁化aAPC结合的CD3+T细胞、CD3+T细胞表面CD3阳性细胞构成比分别为95.90%、97.54%,见图2。
2.3 各组滋养细胞凋亡率比较 与A组滋养细胞凋亡率[(5.68±0.74)%]比较,B组[(13.64±2.05)%]、C组[(29.90±4.78)%]滋养细胞凋亡率均升高(P均<0.05);与B组[(13.64±2.05)%]比较,C组[(29.90±4.78)%]滋养细胞凋亡率升高(P<0.05),见图3。

图2 CD3+T细胞表面特异性标志物表达情况

图3 流式细胞仪检测各组细胞凋亡率
2.4各组滋养细胞侵袭能力比较 与A组[(195.20±24.13)个]滋养细胞穿过微孔细胞数/视野比较,B组[(102.00±15.47)个]、C组[(45.40±8.56)个]滋养细胞穿过微孔细胞数/视野减少(P<0.05);与B组[(102.00±15.47)个]比较,C组[(45.40±8.56)个]滋养细胞穿过微孔细胞数/视野减少(P<0.05),见图4。

图4 各组微孔细胞数比较(×400)
2.5 各组滋养细胞黏附能力比较 与A组(0.74±0.13)滋养细胞光密度值比较,B组(0.48±0.09)、C组(0.29±0.05)滋养细胞光密度值光密度值减小(P<0.05);与B组(0.48±0.09)比较,C组(0.29±0.05)滋养细胞光密度值光密度值减小(P<0.05)。
3 讨论
妊娠免疫耐受是正常妊娠时母体一种特殊的外周免疫耐受,保护作为半同种移植物的胎儿不被母体免疫系统排斥,从而成功妊娠[10]。当该种免疫耐受状态失衡时,将诱发一系列病理妊娠如URSA的发生。滋养细胞侵袭、黏附及免疫细胞活化、游走等行为在诱导妊娠免疫耐受中起到重要作用,且滋养细胞存在于与母体免疫系统直接接触的胚胎性组织中,通过接触蜕膜、释放细胞因子等方式调控母体蜕膜免疫活性细胞,被认为是妊娠耐受的始动细胞,其侵袭、黏附能力降低,凋亡增加与URSA的发生关系密切,改善其生物学行为也是治疗该病的主要思路[11-12]。
抗原递呈细胞提供的双重刺激信号是CD3+T细胞活化、增殖及分化为效应细胞的重要基础,aAPC是在磁珠、胶乳微球、脂质体等人工载体表面交联抗CD、CD28单克隆抗体或主要组织相容性复合体[13]。随着新兴技术的发展,aAPC在制备、应用、效果评价等方面渐趋完善与成熟。与自身APC存在的缺点如自体分离培养困难,T细胞活化增殖周期较长、活化条件不易控制相比,aAPC具有培养较易、T细胞活化增殖周期较短、活化条件可控等优点[14]。由于aAPC存在的优势,其在临床免疫治疗和基础免疫治疗中具有前瞻性意义。因此,本实验通过现代生物学手段,与材料学前沿技术联合,探寻合适的aAPC载体,进一步探究生物学靶向治疗URSA的可行性,有望为该病免疫治疗带来新的突破。Fe3O4磁性纳米碳粒子是一种重要的复合过渡金属氧化物超微颗粒,具有生物相容性良好、比表面积大、无毒性、高饱和磁化强度等诸多优势[15]。目前尚未发现其对肾、胃肠道和骨髓的毒副作用,糖类、脂类代谢异常或过度免疫现象,亦未增加发生肿瘤的可能性等不良反应,安全性较高[16-17]。Fe3O4磁性纳米碳粒子在生物医学中的应用日益增多,目前主要应用于靶向定位给药、细胞标记、细胞和组织定位、转染、免疫分析及核磁共振成像等生物医学领域[18]。淋巴系统作为机体的免疫系统,对于机体抵御外来侵害具有重要作用。纳米粒子具有淋巴靶向性,易在淋巴系统分布和存留,能够影响固有免疫细胞的活性及免疫系统免疫分子的分泌。因此,研究纳米粒子对免疫系统的影响具有重要意义。Hou等[19]研究发现,静脉注射Fe3O4磁性纳米粒子能够以剂量依赖的方式影响正常ICR小鼠的免疫功能。低剂量组Fe3O4纳米粒子淋巴细胞增殖率高于对照组,而生理盐水和高剂量组的淋巴细胞增殖与对照组相比却较低。在外周血中,低剂量组的CD4+T淋巴细胞和CD8+T淋巴细胞的比例要高于对照组。此外,Fe3O4纳米复合材料还能够作为抗肿瘤药或疫苗载体,Cao等[20]采用溶剂蒸发技术、响应表面法对雷帕霉素负载的中空磁性Fe3O4纳米复合材料进行开发、优化,可显著提升雷帕霉素杀死肝癌细胞的能力,且表现出浓度依赖性,暗示中空磁性Fe3O4纳米复合材料作为载体的潜在价值。本研究将改造后的aAPC负载至制备完善的磁性Fe3O4纳米碳颗粒上,再利用外加磁场分离URSA患者外周血CD3+T细胞,结果显示C组、B组、A组滋养细胞凋亡率依次降低,滋养细胞穿过微孔细胞数/视野依次增加,光密度值依次增大,提示与磁化aAPC结合的CD3+T细胞可促进滋养细胞侵袭及黏附能力的增强,减少其凋亡,验证磁化aAPC诱导妊娠免疫耐受的能力。目前针对URSA的主动免疫治疗途径以皮内注射为主,免疫原可采用丈夫或无关个体的淋巴细胞、单个核细胞或合体滋养细胞膜等,其中最常用的是淋巴细胞。然而URSA可依赖的免疫学检查较为有限,暂无特异的免疫学指标对治疗前后的免疫状态进行监测和指导[21]。已有研究发现,在体外实验中根据实验方法和样品类型不同,1%~10%的T细胞群体可能存在同种异体反应性,可使用混合淋巴细胞反应(mixed lymphocyte reaction,MLR)对体外实验中同种异体细胞排斥反应进行监测[22]。然而,本研究由于人员和经费限制,未进行MLR监测,这可能对实验结果造成一定影响,在未来的进一步研究中将予以完善。
综上所述,与磁化aAPC结合的CD3+T细胞可增强滋养细胞侵袭及黏附能力,减少其凋亡,为URSA的治疗提供新的可能。

