基于iTRAQ蛋白组学技术筛选的关键差异蛋白PCNA和MCM 2在食管鳞癌中的表达及意义①
李 超,刘文颖,马遇庆
(新疆医科大学第一附属医院1呼吸与呼吸危重症医学科,2病理科,乌鲁木齐830054)
我国食管癌发病率在各类肿瘤中居第6位,死亡率居第4位,病理类型以食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)为主,约占90%[1]。食管鳞癌由于其早期无明显吞咽困难等典型临床症状,多于中晚期确诊[2],死亡率高且预后差[2];由于其增殖迅速极易发生淋巴结转移,而转移是造成肿瘤患者死亡的主要原因。iTRAQ蛋白组学技术分析在基础研究中是一种常用工具,能为临床诊断和预后评估提供新的生物标记蛋白。本研究利用iTRAQ技术,通过分析食管鳞癌组织差异蛋白表达,筛选出PCNA和MCM2作为靶点基因,采用免疫组化检测食管鳞癌及癌旁正常组织中PCNA和MCM2的蛋白表达情况,结合患者临床病理参数相关性分析,探讨其在食管鳞状细胞癌形成和进展中的作用。
1 材料与方法
1.1临床资料 选择2012年3月—2013年6月在新疆医科大学第一附属医院胸外科接受手术,术后病理诊断为食管鳞癌6例患者。收集其新鲜食管鳞癌癌组织及癌旁正常组织,其中高分化鳞癌3例,中分化鳞癌3例。收集2013年6月—2018年6月新疆医科大学第一附属医院病理科确诊的食管鳞癌患者的癌及癌旁正常组织石蜡包埋标本118例,其中男性81例,女性37例,年龄32~82岁之间,平均为(64.03±8.05)岁。其中,高分化鳞癌17例,中分化鳞癌76例,低分化鳞癌25例。颈部及胸上、中段70例,下段48例。根据2017年美国癌症联合会(American joint committee on cancer,AJCC)食管癌第8版分期标准:Ⅰ期9例,Ⅱ期70例,Ⅲ期29例,Ⅳ期10例。淋巴结转移37例,未发生淋巴结转移81例。本研究已经获得新疆医科大学第一附属医院伦理委员会批准,所有患者均已签署知情同意书。
1.2 方法
1.2.1同位素标记的相对与绝对定量技术(isobaric tags for relative and absolute quantification,iTRAQ)用蛋白酶酶解6例研磨碎裂的配对新鲜食管鳞癌癌组织及癌旁正常组织样本,分别标记为B1960C/L、B1990C/L、B2001C/L、B2029C/L、B2043C/L、B2044C/L。iTRAQ同位素标记不同的肽段样本,使用强阳离子交换色谱(HPLC)、Triple TOF5600进行液相色谱-质谱/质谱联用技术(LC-ESI-MS/MS),进行分析鉴定多肽混合物。本次实验分2次上机。Triple TOF 5600质谱仪的一级质谱和二级质谱质量精确度均小于2 ppm。使用Mascot 2.3.02鉴定软件分析蛋白质,选用Uniprot homo数据库进行检索,比对鉴定蛋白。
1.2.2关键基因筛选 在iTRAQ鉴定结果中筛选差异表达基因,差异倍数≥1.5,P<0.05的基因为上调差异表达基因;差异倍数≤0.67,P<0.05的基因为下调差异表达基因。通过Venn Diagram(http://bioinformatics.psb.ugent.be/webtools/Venn/)交集分析,获得上调和下调差异基因。通过String(https://string-db.org/cgi/input.pl)对上调和下调差异表达基因进行蛋白互作网络分析,进一步通过Cytoscape 3.7.2中MOCDE app筛选关键基因作为研究基因。
1.2.3免疫组化染色 118例病例的组织蜡块标本制成5µm厚度的切片,在二甲苯中脱蜡,0.01 mmol/L柠檬酸盐缓冲液用于抗原修复,采用ENVISION法进行免疫组化染色,严格按照试剂盒说明操作。添加MCM2(ab108935,Abcam,美国)1∶500,PCNA单克隆抗体(ab29,Abcam,美国)1∶10 000,在37℃下孵育1 h,后加入二抗并在室温下孵育2 h,3,3-二氨基联苯胺(DAB)5 min复染,显微镜下观察染色情况终止染色,苏木素染色,盐酸乙酸分化,磷酸盐缓冲液(PBS)反蓝1 min。脱水透明后封片,由2名病理医师进行双盲法在显微镜下观察二者的免疫组化表达情况,对结果进行判读。
1.3 免疫组化检验结果判读(1)PCNA定位在细胞核内,棕色颗粒为阳性细胞,蓝色为阴性细胞。随机观察10个高倍视野,阳性细胞占计数细胞的百分比即为阳性表达率。PCNA结果判断标准:无表达(-)为切片中无阳性细胞;低度表达(+)为阳性细胞数<25%;中度表达(++)为阳性细胞数≥25%,<50%;高度表达(+++)为阳性细胞数≥50%。为便于分析,本实验以(-)、(+)作为低表达,(++)、(+++)作为高表达[2]。(2)根据Amaro Filho评价标准[3],MCM2采用着色比例判读模式。MCM2阳性表达是细胞核内出现黄色或棕黄色颗粒。着色比例:镜下随机选取10个背景清晰高倍视野,每个高倍视野计数100个细胞,无细胞着色为0分,阳性细胞数≤25%细胞着色为1分,26%~75%细胞着色为2分,≥76%细胞着色为3分。0分和1分为低表达,2分和3分为高表达。
1.4 统计学分析 采用SPSS 22.0软件进行统计分析。计数资料采用百分比表示,2个样本均数比较采用t检验,组间比较采用χ2检验,若T<5,采用χ2检验的校正公式或Fisher精确概率法;相关分析采用Spearman法。按检验水准P<0.05为差异有统计学意义。
2 结果
2.1 iTRAQ鉴定结果中筛选差异关键基因 6例样本分2次iTRAQ上机,鉴定出4 999和4 935个蛋白。编号B1960样本中上调基因563个,下调基因339个;编号B1990样本中上调基因350个,下调基因329个;编号B2001样本中上调基因373个,下调基因228个;编号B2029样本中上调基因750个,下调基因370个;编号B2043样本中上调基因538个,下调基因246个;编号B2044样本中上调基因563个,下调基因252个;PCNA和MCM2均为上调蛋白,即促癌蛋白,见图1 A。筛选的差异基因经Venn Diagram交集分析获得上调基因30个,下调基因47个,见图1 A、B、C。通过Cytoscape中的MCODEapp获得关键基因PCNA和MCM2为进一步研究基因,见图1 D、E。
2.2 PCNA、MCM2的免疫组化表达情况 PCNA、MCM2均定位于肿瘤细胞核中,正常组织中仅少量表达或不表达于食管鳞状上皮基底层,见图2。PCNA在118例食管鳞癌癌组织中高表达率为56.8%(67/118),MCM2为80.5%(95/118);在癌旁正常组织高表达率分别为6.8%(8/118)及15.3%(18/118),二者在癌组织中的表达均高于癌旁正常组织,差异均有统计学意义(P<0.001),见表1,图3 A、B。

表1 PCNA及MCM2蛋白在食管鳞癌及癌旁正常组织中的表达/例(%)

图1 iTRAQ蛋白组学筛选关键基因

图2 PCNA、MCM2表达情况
2.3 PCNA、MCM2表达与食管鳞癌患者临床病理特征之间的关系PCNA、MCM2表达水平显示,二者与食管鳞癌患者年龄、性别、肿瘤长度和侵犯部位等各临床病理特征差异无统计学意义;二者在低分化组中的表达率高于高分化和中分化组,差异有统计学意义(P=0.011,P=0.009);二者在淋巴结转移组中表达高于淋巴结无转移组,差异有统计学意义(P=0.002,P=0.035)。PCNA表达结果显示,IV期的表达高于Ⅰ、Ⅱ、Ⅲ期,差异有统计学意义(P=0.006);N1、N2分期的表达高于N0分期,差异有统计学意义(P=0.007);有远处转移组中的表达高于无远处转移组,差异有统计学意义(P=0.048);在局部浸润全层组中的表达高于肌层组和黏膜组,差异有统计学意义(P=0.047),见表2。
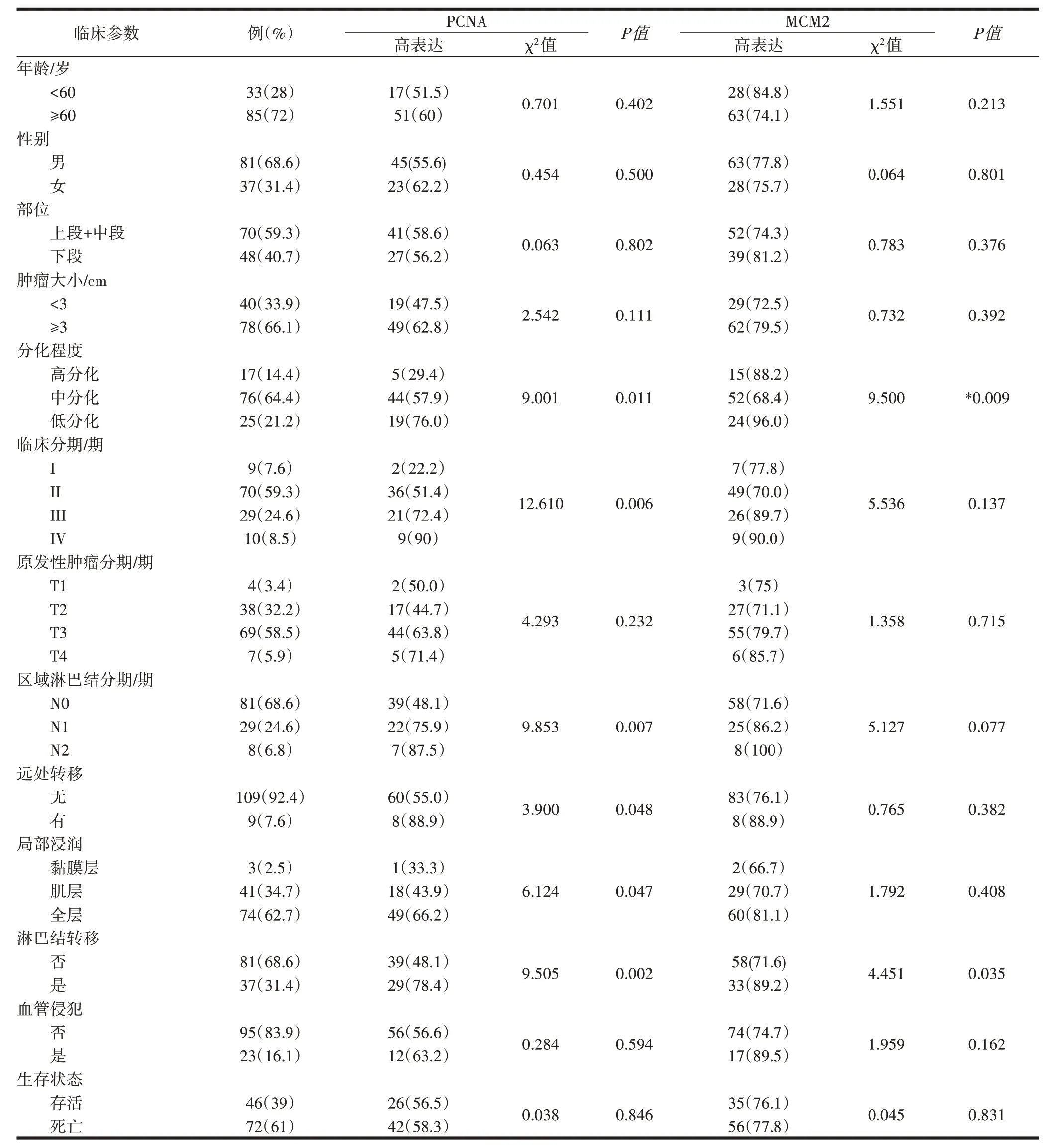
表2 PCNA、MCM2与食管鳞癌患者临床病理参数的关系/例(%)
2.4 PCNA和MCM2与食管鳞癌临床病理特征相关性分析 Spearman分析显示临床分期、原发性肿瘤分期、区域淋巴结分期、远处转移分期、分化程度、局部浸润及淋巴结转移均与PCNA表达呈正相关,N分期和淋巴结转移与MCM2表达呈正相关,见表3。
2.5 基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)数据库比对结果PCNA、MCM2在118例食管鳞癌癌组织中表达率高于癌旁正常组织,差异有统计学意义(P<0.001),见图3 A、B,这一结果与GEPIA数据库比对后一致,见图3 C、D;PCNA、MCM2在食管鳞癌组织中的高表达与总体生存期和无疾病进展生存期无相关性,此结果与GEPIA数据库比对结果一致,见图3 E~H。

表3 PCNA和MCM2与临床参数Spearman相关性分析

图3 PCNA、MCM2比对GEPIA数据库结果
3 讨论
本研究通过对食管鳞癌癌及癌旁组织应用iTRAQ蛋白组学和生物信息分析方法筛选出关键基因PCNA和MCM2作为本次研究的靶点蛋白。通过免疫组化结合临床病理资料和网络数据库进一步分析关键蛋白与临床资料的关系,进一步证实PCNA和MCM2是食管鳞癌的高表达蛋白和促进食管肿瘤发生、发展的重要生物标志物。
PCNA又称周期素,作为DNA聚合酶δ的辅助蛋白直接参与细胞增殖过程中DNA的复制。已有研究表明PCNA在肺癌、胃癌、肝癌和宫颈癌等肿瘤中高表达,促进肿瘤的增殖和侵袭[4-5]。PCNA在低分化程度的食管鳞癌细胞表达远高于食管发育不良和正常食管黏膜。热休克蛋白介导PCNA升高促进肝癌细胞增殖和抑制其分化[6]。PCNA蛋白表达随着临床分期的增高、病理分级级别的增高及淋巴结转移数目的增多而增高[7]。结直肠癌研究中PCNA在远处转移组中表达水平高于无转移组[8]。但PCNA在食管鳞状细胞癌中的研究未见,本研究发现PCNA在食管鳞状细胞癌中的特异性表达与食管鳞癌淋巴结转移、浸润深度和组织低分化程度相关,尤其与食管鳞癌远处转移和临床分期相关(P<0.05),说明PCNA促进食管鳞癌的增殖、侵袭和细胞的异型性。有报道称PCNA表达增高诱导食管鳞癌对顺铂耐药和放疗不敏感,导致食管鳞癌预后极差[9];在乳腺癌治疗中降低PCNA表达可抑制78%的癌细胞活性,显著抑制肿瘤生长,增强顺铂药物敏感性。PCNA抑制剂有望成为临床肿瘤治疗药物[10]。提示PCNA基因可能是一个有效的基因治疗靶点,为食管鳞癌的治疗提供方向。
MCM2是微小染色体维持蛋白(MCMs)家族成员之一,MCM蛋白家族是一组在细胞增殖中负责启动并精准控制DNA复制的关键蛋白。MCM2是重要的肿瘤标志物,在宫颈癌、乳腺癌、胃癌、结肠癌、肝癌、肺癌等多种肿瘤中均高表达[11-12]。本研究结果显示MCM2在食管鳞癌组织表达阳性率高达80.5%,癌旁正常食管组织表达阳性率15.3%,但这一标志物尚未应用于食管鳞癌的诊断中,提示能否通过内镜取检少量组织,检测其MCM2的表达有助早期诊断食道鳞癌,需要进一步探索研究。本研究发现MCM2高表达与淋巴结转移、浸润深度和组织低分化程度相关。乳腺癌、结直肠癌的研究证实MCM2表达越高,分化越差,临床分期越晚,临床预后越差[13-14]。Nasri等[15]发现MCM2在肺癌和结肠癌中明显增高,与高死亡显著相关。MCM2被视为非小细胞肺癌独立的生存预测基因,同时MCM2降低有助增加化疗药物的敏感性[16]。综上所述,MCM2可能作为临床预后判断指标和辅助化疗药物靶向治疗的生物标志物。
Zhong等[17]通过食管鳞癌GEO数据库和TCGA数据库比对发现PCNA、MCM2与总体生存和无疾病进展生存无相关性,与本研究结果一致。本研究未发现与总体生存期相关,这可能与有限的样本数量及食管鳞癌晚期患者数相对较少相关,并且考虑GEPIA数据库主要作为欧美国家病例库,欧美国家食管癌以腺癌为主,而我国食管癌以食管鳞状细胞癌为主,其参考意义有限。作为食管鳞癌的关键增殖基因,PCNA、MCM2在食管鳞癌预后判定中的价值仍有待进一步研究。

