虾青素对幽门螺杆菌感染AGS细胞自噬及凋亡的抑制作用
白 洁,纪文静,舍 玲,努尔麦麦提·叶尔逊
(新疆医科大学第二附属医院 消化内科,新疆 乌鲁木齐,830028)
幽门螺杆菌(Hp)是定植于胃黏膜的一种革兰氏阴性杆菌,与胃炎、胃溃疡的关系密切,研究[1]发现其与胃癌有关,是导致胃黏膜癌变的主要原因。自噬是维持细胞稳定的重要方式,在介导机体免疫应答、炎症反应、细胞正常生长和分化、细胞损伤和修复等病理生理活动中发挥重要的作用,但过度自噬会对细胞造成损害[2]。研究[3]表明,Hp可通过自噬途径损伤胃黏膜,诱导慢性炎症,进而导致癌变。凋亡是细胞在相关基因的调控下发生的正常死亡过程。研究[4]表明,Hp VacA可影响细胞线粒体膜点位,诱导细胞凋亡。研究[5]发现,Hp(+)胃黏膜细胞的凋亡发生率明显高于Hp(-)细胞。虾青素是天然存在的类胡萝卜素,具有抗氧化、抗炎症和抗肿瘤等功效,已成为研究的热点。马于林等[6]研究发现,虾青素可通过抑制氧化应激来抑制细胞凋亡。本研究通过构建Hp感染的胃上皮细胞株AGS细胞,加入不同浓度的虾青素,观察细胞自噬及凋亡的情况,现将结果报告如下。
1 材料与方法
1.1 主要试剂、细胞株及仪器
人胃上皮细胞株AGS细胞(上海生命科学研究所); 虾青素(纯度>98%,长沙上禾生物科技有限公司); Hp标准株 NCTC11637、SS1(中国疾病预防控制中心传染病预防控制所); Ham′s F12培养液、哥伦比亚琼脂培养基(Sigma公司,美国); 胎牛血清、双抗、胰蛋白酶(Biosciences,美国); 兔抗人微管相关蛋白1轻链3-Ⅱ(LC3-Ⅱ)、LC3-Ⅰ、Beclin1、B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、β-actin多克隆一抗、鼠抗兔单克隆二抗、FITC标记鼠抗兔抗体(Sigma公司,美国); Trizol试剂(江苏碧云天科技有限公司); LC3-Ⅱ、LC3-Ⅰ、Beclin1、Bcl-2、Bax及DADPH引物序列(上海生工有限公司); RNA提取试剂盒、PCR试剂盒(武汉博士德生物公司); 白细胞介素-17(IL-17)酶联免疫检测试剂盒(南京奥尼多福公司); TUNEL原位凋亡细胞检测试剂盒、DAPI染色试剂盒(BioVision公司,美国); 酶标仪、倒置荧光显微镜(上海仪电分析仪器有限公司); ABI 7900PCR扩增仪(上海仪电分析仪器有限公司); Trans Blot 转膜仪、化学发光成像仪(上海仪电分析仪器有限公司); 凝胶成像系统(UVP bioimaging systems,美国)。
1.2 细胞、Hp培养
含10%胎牛血清(FBS)和青霉素、链霉素各100 U/L的Ham′s F12培养基培养AGS细胞,培养条件为37 ℃、5% CO2。待细胞铺满培养瓶后,用0.25%胰酶消化,制备单细胞悬液,使用血清培养基继续培养,定期更换培养基、传代。
吸取50 μL Hp菌种,均匀接种到哥伦比亚琼脂培养基中,放入37 ℃下10%CO2、5%O2、85%N2培养箱中培养96 h。
1.3 抑菌试验
用培养液配成10 μmol/L的虾青素。在24孔板中加入10 μL Hp菌悬液(109cfu/mL)以及990 μL虾青素,空白对照组加入不含药物的培养液[含0.1%二甲基亚砜(DMSO)、10%FBS的培养液]和菌悬液,阳性对照组则加入含100 μg/mL阿莫西林和50 μg/mL克拉霉素混合抗生素的培养液和Hp菌悬液。37 ℃微需氧条件下培养24 h后,适当稀释,取50 μL转至哥伦比亚血琼脂培养基上,培养48 h后计数菌落。
1.4 Hp感染AGS细胞的方法及分组
选取第3代细胞,0.25%胰酶消化,调整浓度为1×106/L的单细胞悬液,接种于6孔板,每组设置5个复孔。Hp菌种培养24 h后,测定细菌浓度,更换新鲜培养基,并按照Hp菌落: 细胞数=100∶1加入Hp菌悬液,37 ℃、5% CO2共培养。更换培养液,保证每孔中培养液为2.0 mL,将不同浓度的虾青素0.5 mL加入到6孔板中,对照组(虾青素0 μmol/L,DMSO代替),10 μmol/L组(虾青素10 μmol/L),20 μmol/L组(虾青素20 μmol/L),50 μmol/L组(虾青素50 μmol/L)。细胞继续培养96 h,用于后续实验。
1.5 免疫荧光检测Hp感染AGS细胞
取Hp感染的AGS细胞,去培养液,PBS冲洗,3%多聚甲醛孵育10 min,PBS洗涤,用1%牛血清白蛋白(BSA)、22.52 mg/mL甘氨酸的磷酸盐吐温缓冲液(PBST)孵育细胞30 min以封闭抗体,PBS洗涤,加入外膜蛋白(OMP)单克隆一抗孵育4 ℃室温过夜,PBS洗涤,与相应荧光标记二抗反应,PBS洗涤,加入DAPI,37 ℃孵育15 min,弃染色液,甲醇洗涤; 加入甘油,激光共聚焦显微镜下观察。
1.6 实时荧光定量PCR (qRT-PCR)检测细胞LC3-Ⅱ、LC3-Ⅰ、Beclin1、Bcl-2、Bax mRNA表达
对数生长期的细胞,胰酶消化,离心。加入等体积TRIzol试剂,根据试剂盒说明书提取总RNA,溶于20 μL二乙基焦碳酸酯(DEPC)水,取1 μL加入79 μL DEPC水检测纯度。根据反转录试剂盒合成cDNA,样品总RNA 1 μg,随机引物或oligo(dT)18-20为100 pmol,脱氧核苷三磷酸(每种dNTP各10 mmol/L) 1 μL,反转录缓冲液(5×) 4 μL,RNase抑制剂 (20~40 U/μL) 1 μL,M-MLV反转录酶 20 U,DEPC处理水补至20 μL,目标引物序列见表1。根据试剂盒说明书进行PCR扩增: cDNA 2 μL,上、下引物各3 μL,Taq聚合酶0.5 μL,总体积共25 μL,反应参数设置为92 ℃ 20 s、96 ℃ 2 s、85 ℃ 20 s、80 ℃ 6 s,共40个循环。构建溶解曲线。采用2-△△Ct法计算目标引物mRNA的相对表达量。引物序列见表1。
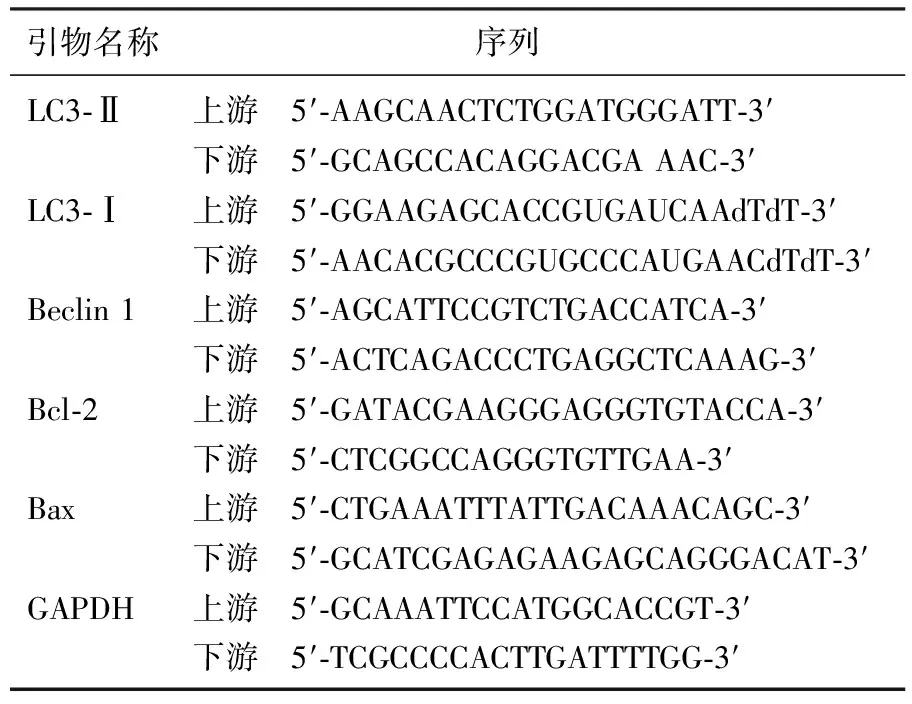
表1 引物序列
1.7 Western blot法检测LC3-Ⅱ、LC3-Ⅰ、Beclin1、Bcl-2、Bax蛋白的表达
细胞经胰酶消化,40 ℃下1 500转/min离心5 min,去上清,超声波破核,离心,取上清液。配胶、上样、电泳、转膜、切膜,封闭液封闭1 h,逐次LC3-Ⅱ(1∶500)、LC3-Ⅰ(1∶500)、Beclin1(1∶500)、Bcl-2(1∶100)、Bax(1∶100)、辣根过氧化物酶标记的二抗(1∶100)。Bio-Rad成像仪曝光成像,Image Lab Software测定光密度,以目标蛋白与β-actin条带光密度值比值表示相对表达量。
1.8 TUNEL实验及ELISA检测IL-17浓度
取Hp感染的AGS细胞,去除培养液,PBS冲洗,3%多聚甲醛孵育10 min,PBS洗涤,加入适量凋亡检测液,37 ℃孵育60 min,PBS洗涤,加入DAPI室温避光孵育8 min,PBS冲洗,加抗淬灭剂,激光共聚焦显微镜下观察,计算凋亡率。细胞核呈蓝色,凋亡细胞呈绿色。
取各组AGS细胞,3 000转/min离心10 min,收集细胞上清,ELISA检测IL-17浓度。具体操作步骤严格按照说明书进行。
1.9 统计学分析
2 结 果
2.1 Hp感染AGS细胞
Hp在AGS细胞质中弥散分布,进行自我复制,提示Hp感染AGS细胞成功,并在细胞内增殖。见图1。
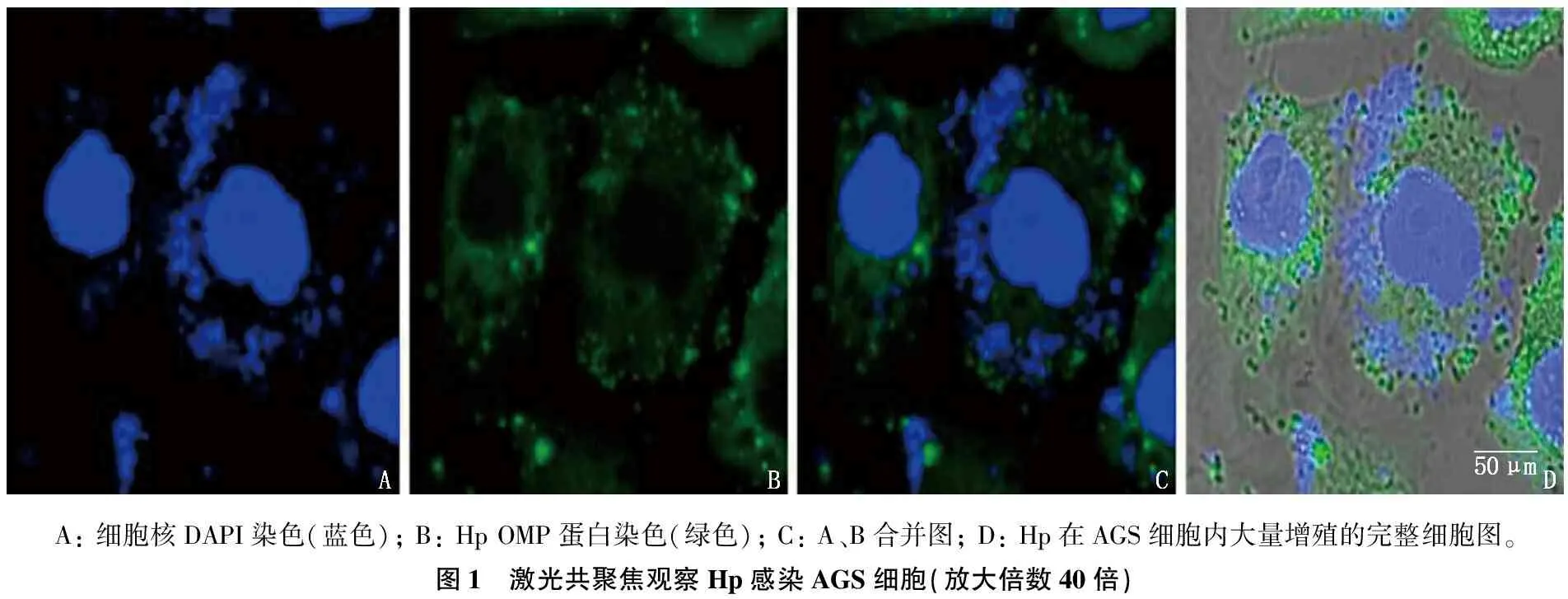
A: 细胞核DAPI染色(蓝色); B: Hp OMP蛋白染色(绿色); C: A、B合并图; D: Hp在AGS细胞内大量增殖的完整细胞图。图1 激光共聚焦观察Hp感染AGS细胞(放大倍数40倍)
2.2 虾青素对Hp增殖的影响
与对照组比较,虾青素对Hp增殖起到显著的抑制作用(P<0.05),但弱于抗生素组,差异有统计学意义(P<0.05)。见图2。
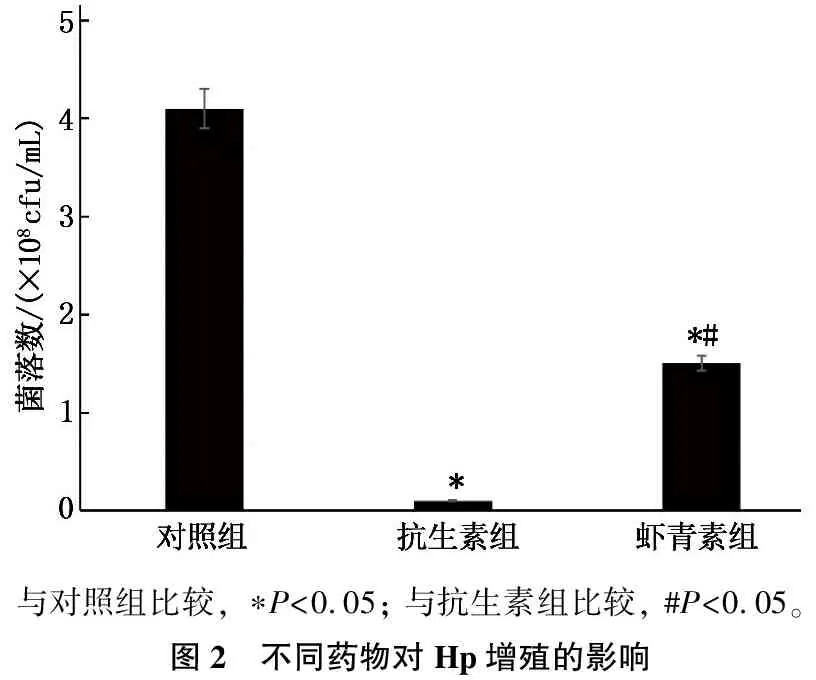
与对照组比较, ∗P<0.05; 与抗生素组比较, #P<0.05。图2 不同药物对Hp增殖的影响
2.3 虾青素对Hp感染AGS细胞凋亡的抑制作用
虾青素10 μmol/L组细胞凋亡率为(1.11±0.03)%,20 μmol/L组为(0.35±0.04)%,50 μmol/L组为(0.22±0.03)%,均低于对照组的(2.14±0.04)%,差异有统计学意义(P<0.01)。随着虾青素浓度的增高,细胞凋亡率逐渐下降,提示虾青素对Hp感染AGS细胞凋亡的抑制作用具有浓度依赖性。见图3、4。
2.4 虾青素对Hp感染AGS细胞LC3-Ⅱ、LC3-Ⅰ、Beclin1、Bcl-2、Bax蛋白及mRNA的影响
虾青素10、20、50 μmol/L组细胞Bcl-2蛋白表达量高于对照组,差异有统计学意义(P<0.01),且随着浓度的增高,表达量逐渐升高。虾青素10、20、50 μmol/L组细胞Beclin1、LC3-Ⅱ与LC3-Ⅰ比值(LC3-Ⅱ/LC3-Ⅰ)、Bax表达低于对照组,差异有统计学意义(P<0.01),且随着浓度的增高,表达量逐渐下降。
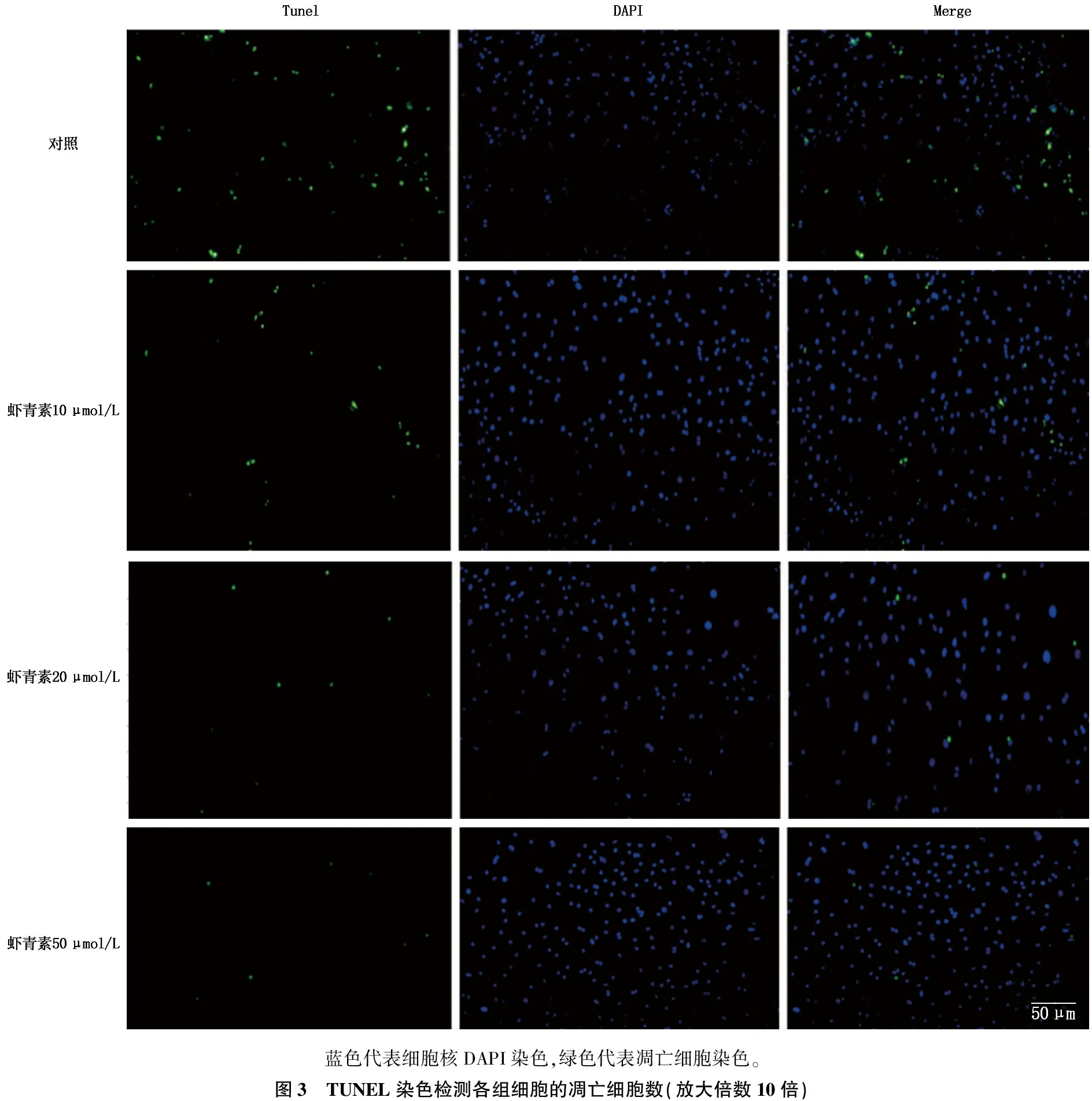
蓝色代表细胞核DAPI染色,绿色代表凋亡细胞染色。图3 TUNEL染色检测各组细胞的凋亡细胞数(放大倍数10倍)
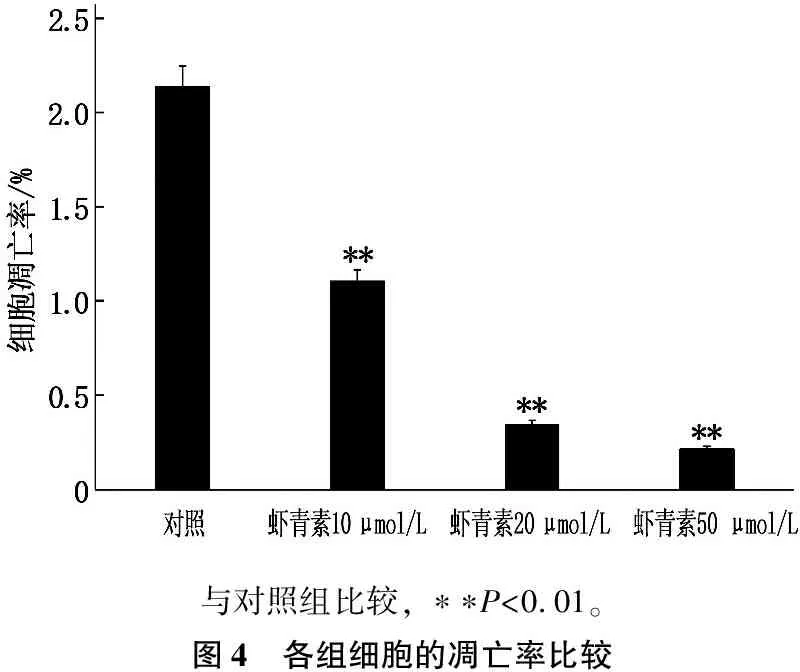
与对照组比较, ∗∗P<0.01。图4 各组细胞的凋亡率比较
虾青素10、20、50 μmol/L组细胞Bcl-2 mRNA表达量高于对照组,差异有统计学意义(P<0.01),且随着浓度的增高,表达量逐渐升高。虾青素10、20、50 μmol/L组细胞Beclin1、LC3-Ⅱ/LC3-Ⅰ、Bax mRNA表达低于对照组,差异有统计学意义(P<0.01),且随着浓度的增高,表达量逐渐下降。见图5、6。
2.5 虾青素对Hp感染AGS细胞IL-17的影响
虾青素10、20、50 μmol/L组IL-17含量依次为(102.12±21.92)、(91.02±11.23)、(72.23±12.34) pg/mL,均低于对照组的(123.84±14.39) pg/mL,差异有统计学意义(P<0.05),且随着浓度的增高,IL-17含量逐渐下降,提示虾青素对Hp感染AGS细胞的炎症抑制作用具有浓度依赖性。

A: Western blot结果; B: 蛋白表达量; C: mRNA表达量。与对照组比较, ∗∗P<0.01。图5 各组Bcl-2、Bax蛋白、mRNA的表达
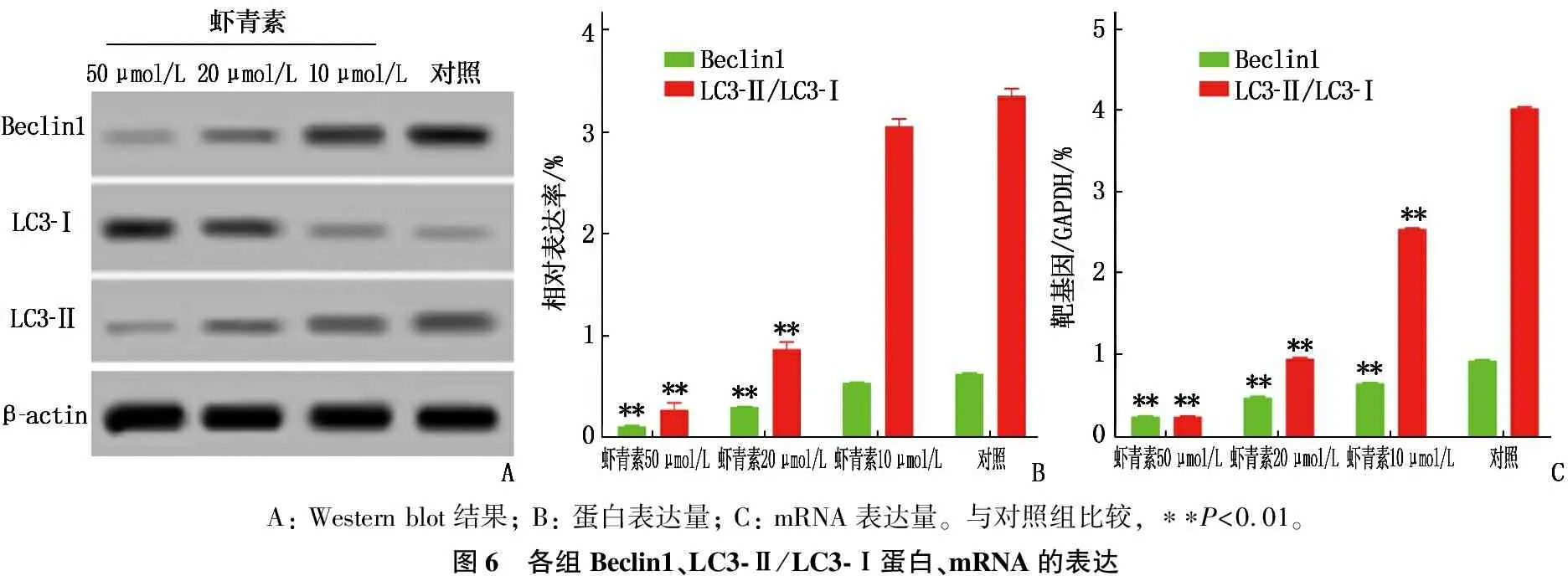
A: Western blot结果; B: 蛋白表达量; C: mRNA表达量。与对照组比较, ∗∗P<0.01。图6 各组Beclin1、LC3-Ⅱ/LC3-Ⅰ蛋白、mRNA的表达
3 讨 论
近年来,随着生物化学及提纯分离方法的进步,越来越多的天然药物获得分离,虾青素属于类胡萝卜素化合物,具有抗炎、抗肿瘤、抗凋亡等功效[7-10]。研究结果[11]显示,虾青素可激活过氧化物酶增殖物激活受体-γ(PPAR-γ)及其下游靶基因过氧化氢酶,减轻Hp感染AGS细胞的氧化应激及炎症反应。凋亡和自噬是细胞死亡的2种途径,但存在密不可分、相互作用的关系,在肿瘤发生、发展中起关键作用[12]。
自噬是真核细胞维持细胞稳定、提供能量的过程,人体多种疾病与自噬相关。研究[13]发现,自噬在胃黏膜细胞Hp感染导致癌变的发生、发展中发挥重要的作用。自噬过程受到多种因子调控,其中自噬相关蛋白在自噬过程中发挥不可替代的作用。Beclin1蛋白是启动自噬的重要蛋白,与PI3K形成结合体,调控Atg蛋白的位置,进而加速自噬体的形成[14]。研究[15]发现,胃癌组织中Hp感染与Beclin1表达有关,提示Hp可能通过自噬参与了胃癌的发生、发展。LC3位于自噬泡膜,参与自噬体的合成,与自噬泡的数量呈正相关。LC3主要包括Ⅰ型和Ⅱ型,LC3-Ⅰ代表了自噬前状态,发生自噬后,LC3-Ⅰ与自噬泡膜的PE结合形成LC3-Ⅱ[16]。LC3-Ⅱ、LC3-Ⅰ及Beclin1是与自噬密切相关的蛋白,在自噬体形成中发挥至关重要的作用,可反映自噬活动,是研究自噬活动的特异性指标[17]。本研究结果显示,加入虾青素后Hp感染AGS细胞Beclin1蛋白及mRNA表达量,LC3-Ⅱ/LC3-Ⅰ均降低,提示虾青素抑制了细胞的自噬过程。Hp介导的细胞自噬机制复杂,目前认为与活性氧、炎症因子的释放密切相关,虾青素作为一种天然化合物,具有抗炎、抗氧化的作用,因而可以有效抑制自噬过程。
细胞凋亡是细胞在一系列基因激活下进行的一种死亡过程,通过这种过程,人体可消除无功能或异常细胞。Hp感染细胞后,会诱发细胞启动凋亡过程以清除被感染的细胞。TUNEL染色是最常用的一种凋亡研究方法,主要是通过特定的染料标记凋亡细胞,从而区分凋亡、正常细胞[18]。本研究结果显示,虾青素能显著降低Hp感染后AGS细胞TUNEL的阳性表达率。Bcl-2家族是调控细胞凋亡的关键蛋白,主要包括抗凋亡蛋白(Bcl-2)和促凋亡蛋白(Bax)。Bcl-2通过结合Bax蛋白,形成二聚体,使Bax蛋白处于失活状态,导致细胞不能启动凋亡途径[19]。当Bcl-2表达被抑制后,则与Bax分离,引起凋亡的发生。雷艳杰等[20]研究发现,胃癌组织中Bcl-2蛋白高表达,其含量与Hp感染呈正相关。蒋漫琦等[21]研究结果表明,Bcl-2蛋白在Hp感染的慢性萎缩性胃炎组织中高表达。本研究结果显示,加入虾青素后,Bcl-2蛋白含量增加,Bax蛋白含量降低,且抑制作用具有浓度依赖性,进一步说明了虾青素可抑制Hp感染后AGS细胞的凋亡,且浓度越高,这种抑制性越强。岳亮等[22]研究结果显示,虾青素可通过调控Wnt/β-catenin信号通路促进胶质瘤细胞凋亡。Hp感染细胞过程中会发生氧化应激反应,产生大量的自由基,而虾青素具有抗氧化、清除自由基的功效,因而可以抑制细胞的凋亡过程。
IL-17是重要的促炎性细胞因子,其可诱导多种细胞释放炎症介质,IL-17不仅与炎性反应密切相关,还与消化道恶性肿瘤等相关[23]。研究[24]表明,IL-17广泛存在于乳腺癌、肝癌及胃癌等多种肿瘤中。IL-17具有促进肿瘤发生、发展的作用,同时肿瘤所处的微环境可直接诱导 IL-17细胞因子。本研究结果显示,加入虾青素后IL-17含量降低,且抑制作用具有浓度依赖性,进一步说明了虾青素可抑制Hp感染后炎症反应,且浓度越高,这种抑制性越强。
综上所述,虾青素可抑制Hp感染后AGS细胞的凋亡及自噬过程,具有浓度依赖性,为Hp的治疗及胃癌的防治提供了新的思路。但本研究只是初步研究,具体机制有待深入、全面的探索。

