红光处理对萝卜芽菜采后贮藏过程中芥子油苷和抗氧化能力的影响
冯尚坤 陈 浩 邵志勇,* 汪俏梅
(1 台州科技职业学院农业与生物工程学院, 浙江 台州 318020;2 浙江大学园艺系/农业农村部园艺植物生长发育与品质控制重点开放实验室,浙江 杭州 310058)
萝卜(RaphanussativusL.)是十字花科萝卜属的重要蔬菜,由于制种简单、价格便宜、营养丰富且风味独特,近年来被普遍用作芽苗菜。萝卜芽菜含有丰富的生物活性物质,其中最典型的是芥子油苷(glucosinolates)。芥子油苷是一类含氮和硫的次生代谢物,主要存在于十字花科植物中。根据侧链基团的不同,芥子油苷可分为脂肪类芥子油苷(aliphatic glucosinolates)、吲哚类芥子油苷(indolic glucosinolates)和芳香类芥子油苷(aromatic glucosinolates)[1]。研究表明,芥子油苷的水解产物异硫代氰酸盐具有很强的抗癌活性[2-3]。萝卜中含有丰富的脂肪类芥子油苷4-甲基亚磺酰基-3-丁烯基芥子油苷(glucoraphenin, GRE),其水解产物莱菔素(sulforaphene)对于结肠癌、宫颈癌、食道癌等具有显著的抑制作用,且具有抗诱变、抗菌和抗病毒活性[4-6]。除此之外,萝卜芽菜还含有叶绿素、花青素、维生素C和多酚化合物等抗氧化物质[7-10]。其中,叶绿素作为一种重要的光合色素,不仅对人体健康有促进作用[11],而且是影响萝卜芽菜外观品质的重要因素之一。然而,由于萝卜芽菜水分含量高,采后依然保持旺盛的代谢活动,其生物活性物质往往会在贮藏过程中大量损失,从而失去营养保健功效。因此,如何维持萝卜芽菜在贮藏过程中生物活性物质的含量,是目前萝卜芽菜产业亟待解决的问题。
光照是影响植物生长发育的重要因素之一,如光强、光周期和光质等[12]。不同光质会对植物体内的生物活性物质产生不同的影响[13-19]。其中,红光在多种蔬菜作物中具有提高或维持其营养品质的作用[16-19]。如,采后青花菜在红光照射下维生素C的降解速率和衰老进度受到显著抑制[16];采后红光处理可以提高番茄果实中番茄红素的含量[17]。此外,不同种类的蔬菜对红光的响应也存在明显差异[16-19],但红光对萝卜芽菜生物活性物质的影响有待进一步阐明。本研究探究了采后红光处理对萝卜芽菜芥子油苷、叶绿素、花青素等抗氧化物质,以及抗氧化能力的影响,旨在为萝卜芽菜采后营养品质的维持提供理论依据和技术支撑。
1 材料与方法
1.1 试验材料与试剂
供试萝卜品种为白玉春,购自杭州市新佳盛园艺专营店。
邻硝基苯-β-D-半乳糖苷(2-nitrophenyl-β-D-galactopyranoside)、硫酸酯酶(29 390 U·g-1),美国Sigma-Aldrich公司。
1.2 主要仪器与设备
RDN-300G-2 LED培养箱,宁波东南仪器有限公司;PLA-30植物光照分析仪,杭州远方光电信息股份有限公司;高效液相色谱,日本岛津;SP-1920紫外分光光度计,上海光谱仪器有限公司。
1.3 试验方法
1.3.1 芽菜种植、处理和取样方法 萝卜芽菜的清洗和消毒参照Cai等[20]的方法。将洗净的种子置于28℃恒温培养箱中浸种8 h,之后均匀播种于塑料培养盘(33 cm× 26 cm × 4.5 cm),再将培养盘上下叠放在一起放回28℃培养箱催芽1 d。待出芽整齐后,将萝卜芽菜转移到16 h光照/8 h 黑暗,温度22℃,相对湿度80%,光照强度80 μmol·m-2·s-1的条件下培养,期间根据需要补充水分。
采收生长8 d的芽菜分成两组,放入托盘中并用聚乙烯(polyethylene, PE)膜密封(防止芽菜失水),将其置于22℃的LED培养箱中分别进行红光(660 nm)和白光(对照)处理。光照处理方法参照常嘉琪等[18]的方法并加以改进,设置光强为80 μmol·m-2·s-1(通过植物光照分析仪测定),光照8 h。将光照处理结束的芽菜置于4℃,相对湿度80%,自然光照条件下,以模拟芽菜采后冷藏。分别于芽菜贮藏0、1、2和3 d取样,冷冻干燥后保存在-80℃冰箱,用于测定相关指标。100 g新鲜的萝卜芽菜大约需要5.6 g萝卜种子,每个处理和时间点重复3次。
1.3.2 芥子油苷测含量测定 参照Salehin等[21]的方法并加以改进。准确称取0.02 g冻干粉,加入2 mL 90%的甲醇,涡旋混匀,室温静置1 h后,10 000 r·min-1离心3 min,取1 mL上清液进行纯化。将上清液加入到DEAE-SephadexA-25柱中,经90%甲醇和ddH2O清洗纯化后,加入100 μL 0.1 mol·L-1的硫酸酯酶于28℃培养箱中恒温催化12 h,用1 mL ddH2O分两次洗脱后,即可得到脱硫芥子油苷纯化样品。采用高效液相色谱(high performance liquid chromatography, HPLC)法对纯化后的样品进行检测分析。检测条件:进样量为20 μL,流动相为乙腈和ddH2O,流速为1 mL·min-1。色谱柱为HypersilC18(5 μm, 4.6 mm × 250 mm, Elite),柱温30℃,检测器为Shimadzu SPD-M20A二极管阵列,检测波长226 nm。以邻硝基苯-β-D-半乳糖苷作为内标计算芥子油苷的含量。
1.3.3 叶绿素含量测定 参照孙勃等[22]的方法并加以改进。准确称取0.02 g冻干粉,加入2 mL 96%乙醇,4℃、13 000 r·min-1离心15 min,吸取上清液,用紫外分光光度计检测上清液在665和649 nm波长下的吸光度值,计算叶绿素含量。
1.3.4 花青素含量测定 参照 Wang等[23]的方法。准确称取0.02 g冻干粉样品,加入2 mL 含1% HCl的甲醇,4℃、13 000 r·min-1离心15 min,取上清液作为花青素提取液。以含1% HCl的甲醇为对照,用紫外分光光度计检测提取液在530 和567 nm波长下的吸光度值。按照公式计算花青素含量:
花青素含量=(A530- 0.25 × A657)/ m
(1)
式中,A530为530 nm波长下的吸光度值;A657为657 nm波长下的吸光度值;m为芽菜冻干粉的质量。
1.3.5 总抗氧化能力测定 称取0.02 g冻干粉,加入0.5 mL 30%的乙醇,涡旋混匀,用30%乙醇定容至2.5 mL,80℃水浴1 h,然后7 500 r·min-1离心10 min,吸取上清液作为提取液。铁离子还原抗氧化能力(ferric reducing antioxidant power assay, FRAP)法参照田玉肖等[24]研究。将0.3 mL提取液加入2.7 mL经37℃水浴预热的FRAP工作液,混匀,37℃水浴10 min,测定593 nm波长下的吸光度值,以硫酸亚铁溶液作为标样制作标准曲线,计算样品抗氧化能力。2, 2’-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐自由基[2, 2’-Azino-bis (3-ethylbenzothiazoline-6-sulfonic acid), ABTS]法参照蔡丛希等[10]的研究。将0.1 mL提取液加入到3.9 mL ABTS反应液中,室温下避光反应5 min。检测734 nm波长下反应前和反应后溶液的吸光度值,分别用A0和A1表示,总抗氧化活性用公式(A0-A1)/ A0×100%计算。
1.4 统计分析
采用软件SPSS 22.0中的单因素方差分析(one-way analysis of variance, ANOVA)对数据进行显著性分析,显著性水平为P<0.05。最终数据表示为平均值±标准误。
2 结果与分析
2.1 芥子油苷组分和含量
在萝卜芽菜中,通过HPLC共检测到6种芥子油苷(图1),包括3种脂肪类芥子油苷, 分别为4-甲基亚磺酰基-3-丁烯基芥子油苷(glucoraphenin, GRE)、4-甲硫丁基芥子油苷(glucoerucin,GER)和4-甲硫基-3-丁烯基芥子油苷(glucoraphasatin,GRH),以及3种吲哚类芥子油苷,分别为4-羟基-吲哚-3-甲基芥子油苷(4-hydroxy glucobrassicin,4OHGBS)、吲哚-3-甲基芥子油苷(glucobrassicin,GBS)和4-甲氧基-吲哚-3-甲基芥子油苷(4-methoxy glucobrassicin,4MEGBS)。
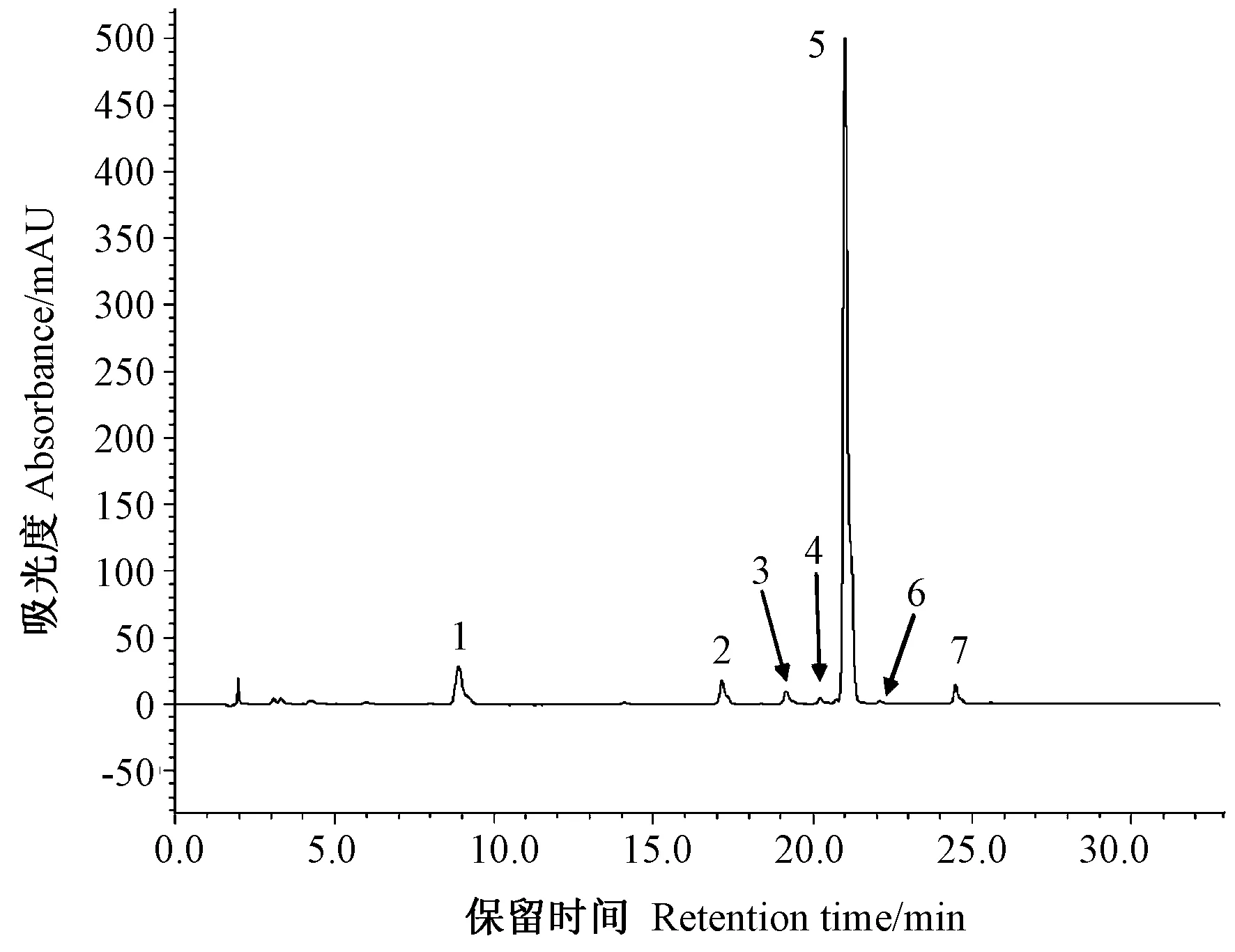
注:1: 4-甲基亚磺酰基-3-丁烯基芥子油苷;2: 4-羟基-吲哚-3-甲基芥子油苷;3:邻硝基苯-β-D-半乳糖苷(内标);4: 4-甲硫丁基芥子油苷;5: 4-甲硫基-3-丁烯基芥子油苷;6:吲哚-3-甲 基芥子油苷;7: 4-甲氧基-吲哚-3-甲基芥子油苷。
由表1可知,采收后的萝卜芽菜中脂肪族芥子油苷是最主要的芥子油苷,约占总芥子油苷含量的97.2%,其中GRH的含量远高于其他组分,约占总芥子油苷含量的92.3%,其次是GRE(占总量的4.1%)和GER(占总量的0.8%);在吲哚类芥子油苷中,主要成分是4MEGBS,约占总量的1.3%,其次是4OHGBS(占总量的0.8%)和GBS(占总量的0.7%)。采收后的萝卜芽菜在红光处理8 h后,脂肪类、吲哚类和总芥子油苷的含量分别比对照高9.5%、20.6%和9.8%,说明短暂的红光处理即可有效地提高萝卜芽菜中芥子油苷的含量。在4℃贮藏条件下,对照组萝卜芽菜中脂肪类芥子油苷,尤其是含量最高的GRH,在贮藏1 d后出现明显下降,而红光处理组萝卜芽菜中的含量显著高于同时期的对照组。在贮藏2 d和3 d,红光处理组的总脂肪类芥子油苷含量分别较对照高17.1%和16.2%,其中GRH含量分别比对照高17.0%和17.7%。GRE是萝卜芽菜中另一重要的脂肪类芥子油苷,在4℃贮藏过程中,该物质并未出现明显降解,但贮藏1 d和2 d红光处理的GRE含量显著高于同时期对照,分别高37.3%和18.5%。吲哚类芥子油苷在贮藏过程中出现先上升后下降的趋势,在贮藏3 d时,其含量下降到与贮藏0 d相当的水平,采后红光处理显著提高了萝卜芽菜中吲哚类芥子油苷的含量。贮藏1、2和3 d,红光处理组的总吲哚类芥子油苷含量分别比对照高39.6%、20.2%和22.3%,其中主要组分4MEGBS分别较对照高82.3%、13.9%和25.3%。
2.2 叶绿素和花青素含量
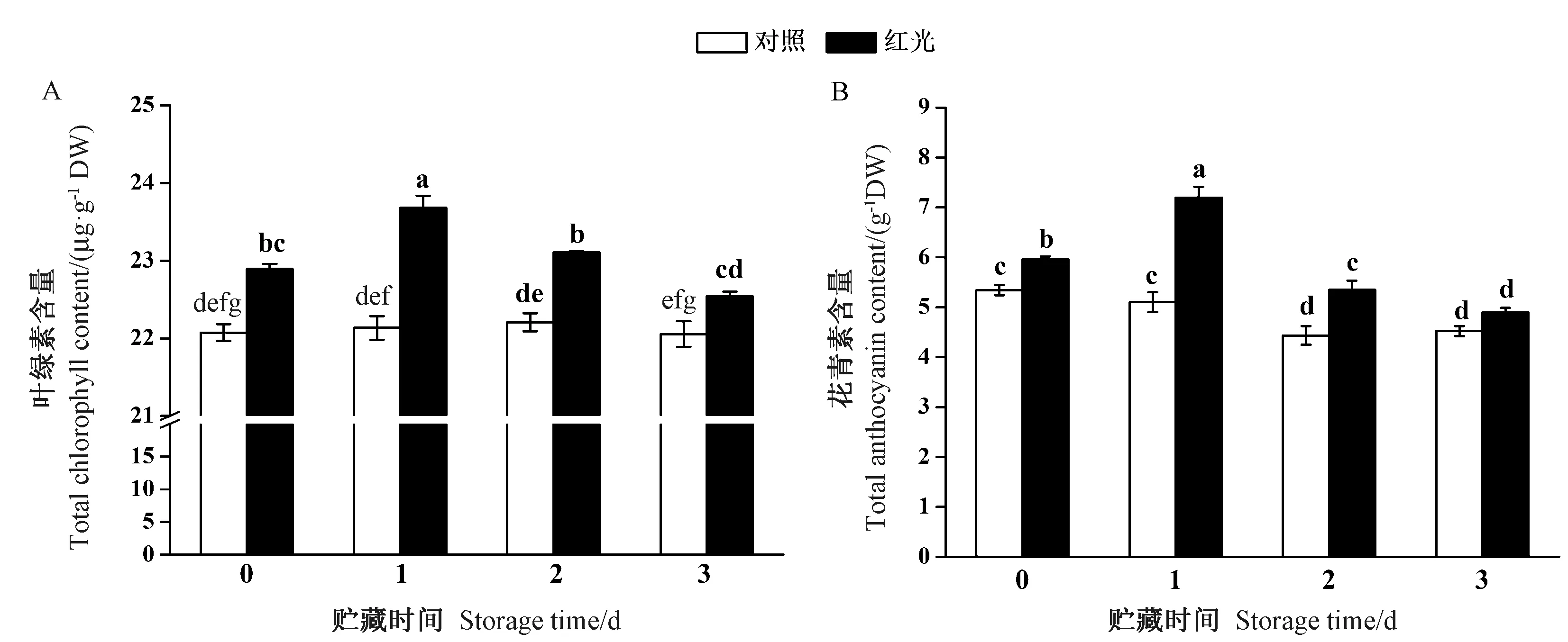
由图2-A可知,经过红光处理萝卜芽菜的叶绿素含量显著高于对照组。在4℃贮藏1~3 d,对照组萝卜芽菜的叶绿素含量基本维持稳定,但红光处理组的叶绿素含量始终显著高于对照组。花青素是萝卜芽菜中重要的抗氧化物质。由图2-B 可知,萝卜芽菜经红光处理后,花青素含量比对照高11.6%。随着贮藏时间的推移,对照组萝卜芽菜的花青素含量出现缓慢的下降趋势,然而,红光处理组萝卜芽菜的花青素含量则呈先上升后下降的变化过程。4℃贮藏1和2 d,红光处理组的萝卜芽菜花青素含量分别比对照高56.8%和20.8%,贮藏3 d时,红光处理组和对照组萝卜芽菜的花青素含量无显著差异。
2.3 抗氧化能力
如图3所示,2种测定抗氧化能力的方法得出的结果趋势基本一致。在贮藏前期(0~1 d),红光处理组萝卜芽菜的抗氧化能力显著高于对照,但随着贮藏时间的推移,至贮藏2~3 d时,两组间无显著差异。
3 讨论
本研究在萝卜芽菜中共检出3种脂肪族和3种吲哚类芥子油苷,其中,脂肪类芥子油苷GRH和GRE是萝卜芽菜中最主要的2种组分,两者的含量约占总含量的96.4%,这与前人的研究结果相一致[8-10]。研究表明,低温贮藏能较好地维持十字花科蔬菜芽菜中芥子油苷的含量[25-26]。如,青花菜芽菜在4℃贮藏3周,其GER、4-甲基亚磺酰基丁基芥子油(glucoraphanin)和3-甲基亚硫酰丙基芥子油苷(glucoiberin)含量基本不变[26]。然而,本研究发现,在4℃贮藏条件下,虽然萝卜芽菜中GRE以及所有吲哚类芥子油苷组分的含量较稳定,但某些脂肪类芥子油苷组分依然存在明显的降解,尤其是萝卜芽菜中含量最高的组分GRH,其含量在4℃贮藏2 d后下降了约20%。因此,对于萝卜芽菜,仅依赖低温贮藏并不能有效维持芥子油苷的含量,探索除低温之外的环境因子来维持萝卜芽菜中芥子油苷的含量具有重要意义。

表1 采后红光照射对萝卜芽菜中芥子油苷成分和含量的影响
注:不同字母表示差异显著(P < 0.05)。下同。

图3 红光处理对萝卜芽菜抗氧化能力的影响(FRAP/ABTS法)
光作为植物生长发育中必不可少的因素,影响植物体内生物活性物质的合成与代谢[13-19]。其中,红光作为一种长波长、低频率的光源,不仅安全、环保,而且在多种蔬菜中被证明具有维持和提高生物活性物质的作用[16-19]。如,常嘉琪等[18]发现,在25℃贮藏条件下,采后红光处理可显著延缓芥蓝芽菜中芥子油苷含量的下降。而本研究发现,对萝卜芽菜进行短暂的红光处理后,各芥子油苷的组分,尤其是具有抗癌活性的GRH和GRE,其含量均出现了显著上升。在4℃贮藏过程中,红光处理有效缓减了萝卜芽菜中GRH和GER等组分含量的下降,并且提高了GRE和各类吲哚类芥子油苷组分的含量。此结果进一步验证了红光处理对于芥子油苷的作用,这可能是因为红光作为一种信号,激活了芥子油苷的生物合成或抑制了黑芥子酶介导的芥子油苷的降解过程[14],具体机制有待进一步研究。
除芥子油苷外,萝卜芽菜中的叶绿素和花青素等植物色素不仅可以有效维持萝卜芽菜独特的外观品质,而且对人体健康具有重要作用[11, 27]。本研究发现,4℃贮藏能较好地维持萝卜芽菜中叶绿素的稳定,而红光处理能够显著提高叶绿素的含量。这可能与红光作为一种光合作用的能量来源,可以促进萝卜芽菜叶绿素的合成有关[28]。萝卜芽菜中的花青素在4℃贮藏条件下出现缓慢的下降,而红光处理能提高贮藏萝卜芽菜花青素的含量,这与前人在芥蓝芽菜[18]、甘蓝[29]和生菜[30]中的结果一致。此外,通过FRAP和ABTS法测定萝卜芽菜的抗氧化能力发现,红光处理提高了萝卜芽菜在贮藏前期(0~1 d)的抗氧化能力,这可能与红光处理提高芥子油苷、叶绿素、花青素等抗氧化物质的含量有关。
4 结论
本研究结果表明,采后进行8 h的红光处理能有效促进萝卜芽菜中各类芥子油苷的积累,延缓贮藏过程中具有抗癌活性芥子油苷组分降解,同时提升萝卜芽菜中叶绿素、花青素等抗氧化物质的含量以及抗氧化能力,并维持较好的外观品质。与化学调控相比,采后集中进行红光处理,不仅操作简单,而且安全可靠、效果显著,因此在萝卜芽菜采后品质维持方面具有潜在的应用价值。

