胸腺素家族多肽在大肠杆菌中的表达
魏 雪 刘淑君 辛凤姣
(中国农业科学院农产品加工研究所,北京 100193)
胸腺素 (又名胸腺肽,thymosin) 是胸腺组织分泌的具有免疫活性的一组多肽,归属于α、β、γ三类,共同诱导T细胞成熟分化,增强T细胞对抗原的反应,从而提高机体抵抗疾病的能力[1]。其中,胸腺素α、β具有较为明确的临床应用前景。目前临床上使用的胸腺素主要为胸腺素α1 (Tα1)[2],其为一种N末端乙酰化的含有28个氨基酸的多肽,通用商品名为胸腺法新 (thymalfasin)。胸腺素在病毒性肝炎、感染性疾病、免疫缺陷性疾病、脓毒血症和肿瘤等疾病的治疗方面均显示出良好的免疫调节效果[3-5]。胸腺素β4 (Tβ4) 的主要生理作用是隔离肌动蛋白,进而阻止肌动蛋白的聚集[6];Tβ4 也与损伤修复和受损组织重建密切相关,可以下调炎症趋化因子和细胞因子,保护缺血性事件后续的组织损伤程度[7]。
多肽类化合物的生产,一般可分为固相化学合成和重组表达两种方式[8-11]。虽然固相化学合成技术较为成熟,但对于较长的多肽 (15个氨基酸以上),其反应效率会随着链长增加急剧下降,不仅成本较高,反应耗时也较长;同时,固相化学合成中使用大量有毒物质,造成较大的环保压力[9]。对于 Tα1 而言,目前胸腺法新产品大多采用固相化学合成方法生产。相比之下,重组表达更适用于生产较长的多肽,最常见的是酵母和大肠杆菌表达系统[10, 12],其中大肠杆菌表达系统更简单高效。使用大肠杆菌体系重组表达非乙酰化的 Tα1 前体,可以有效降低生产成本和环境污染[13]。同时,前体可经体外 N 端乙酰化反应,高效生成最终产物。然而,较短多肽在大肠杆菌中直接表达时,由于多肽缺乏高级结构,往往会被细菌蛋白酶降解,不仅极大地降低了表达量,而且增大了纯化难度。融合标签能够增强重组蛋白质在宿主体内抵抗蛋白质水解酶的能力,有效解决短肽降解的问题。有报道表明,多种融合标签已经被成功用于 Tα1 在大肠杆菌中的表达,如蛋白质二硫键异构酶 (disulfide bond isomerase, DsbA)[14]、谷胱甘肽S-转移酶 (glutathione S-transferase, GST)[15]、内含肽 (intein)[16]等。这些融合蛋白标签虽然极大地提升了表达量,但由于标签本身分子量很大,是目的多肽的几倍甚至十几倍,去除标签后,产出效率较低,不利于大规模生产。为此,本研究通过筛选多种短肽 (8~18氨基酸) 表达标签,成功找到了2种能够高效表达Tα1和 Tβ4 的A18-KEKE、DKL6K融合标签。这2种融合标签的使用,可使目的多肽在融合序列中占比达到60%~80%,同时具有较高的单位表达量,大大提高胸腺肽类产品重组生产的效率,极大地降低生产成本。
1 材料与方法
1.1 材料与试剂
胸腺素及其他多肽融合蛋白基因合成,引物合成和表达质粒构建均由中美泰和生物技术(北京)有限公司完成;大肠杆菌感受态 BL21(DE3),美国Merck公司;聚丙烯酰胺凝胶,南京金斯瑞公司;高效液相色谱分析柱BEH-C18,美国Waters公司。
1.2 仪器与设备
H-Class 超高压四元液相系统高效液相色谱分析仪、Bioaccord质谱分析仪,美国Waters公司;JY-CZ-B蛋白电泳仪,北京君意东方电泳设备有限公司;哈希DR3000紫外分光光度计,美国梅特勒公司;BILON-R500超声破碎仪,上海比朗仪器有限公司;ZWY-200D恒温培养振荡器,上海智诚有限公司。
1.3 试验方法
1.3.1 重组质粒在大肠杆菌中的诱导表达及SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamidegel electrophoresis,SDS-PAGE)分析 胸腺素及其他多肽融合蛋白基因碱基合成后通过 NdeI/XhoI 限制性酶切位点插入 pET-11d 载体。所有质粒由中美泰和生物技术(北京)有限公司合成。重组蛋白表达质粒由热激法转化入大肠杆菌 BL21(DE3) 中, 37℃过夜培养后,将培养物以 1∶100 比例接种至 5 mL含有氨苄抗生素(ampicillin,AMP)的LB液体培养基中,在37℃、200 r·min-1下培养至 OD600值为0.8~1.0,加入1 mmol·L-1异丙基硫代-β-D-半乳糖苷 (isopropyl-beta-D-thiogalactopyranoside,IPTG),在37℃、200 r·min-1条件下培养4 h后5 000 r·min-1离心10 min,收集菌体沉淀,将其悬浮于细胞裂解液 (20 mmol·L-1Tris pH值8.0, 150 mmol·L-1NaCl) 中,每升菌液用30 mL细胞裂解液重悬。将悬浮菌液至于冰上,超声破碎5 s,冷却5 s,功率为30%,直至菌液澄清透明。分别取菌液60 μL 加入20 μL 的4×上样缓冲液,沸水煮10 min,上样 8 μL,用10%浓度SDS-PAGE 电泳分析,鉴定重组蛋白的表达。
1.3.2 超高效液相色谱分析 各种不同表达载体的单位表达量通过反相超高效液相色谱法测定, 色谱柱为美国Waters公司ACQUITY UPLC PROTEIN BEH 2.1 mm×100 mm C4反相色谱柱,粒径 1.7 μm,色谱系统为H-Class超高效液相色谱仪(ultra performance liquid chromatography,UPLC),流动相为含有 1% 三氟乙酸(trifluoroacetic acid,TFA)的水(A)和乙腈(B),洗脱梯度为 20%~60% B 相,洗脱时间为5 min。样品为不同表达载体的细胞裂解液,按表达结束后培养基 600 nm波长处光吸收值,稀释到10 OD600·L-1,而后经8 mol·L-1尿素溶液5倍稀释后(最终尿素浓度约6 mol·L-1), 以相同进样量使用反相液相色谱法定量。各样品主峰经积分后,根据多肽标准品峰面积标准曲线换算可得样品目的蛋白浓度。
1.3.3 质谱分析 利用超高效液相色谱-飞行时间质谱联用 (liquid chromatograph-mass spectrometer,LC/MS) 法对不同表达载体表达的目的蛋白的完整分子量进行鉴定, LC/MS法中色谱为反相液相色谱,所用色谱条件与高效液相色谱分析中类似,仅降低流动相中的TFA浓度至 0.04% 以保证质谱离子化效果。取得质核比数据后,经解卷积运算后得到单同位素分子量。
2 结果与分析
2.1 胸腺素α1和β4促表达融合标签的筛选
为了促进胸腺素α1和β4在大肠杆菌中的表达,将融合标签分别连接于胸腺素α1和β4的N端,并用酶切位点进行分隔,进行融合表达(图1)。表1列举了融合标签的序列信息,分子量范围为878.53~13 661.74 Da,等电点 (isoelectric point,pI) 从5.55到9.18。酶切位点选取的牛肠激酶酶切位点,氨基酸序列为DDDDK,在制备过程中可用于切掉融合标签,获得野生型胸腺素α1和β4。
由表2和表3可知融合蛋白的全序列。将构建好的质粒转入大肠杆菌 BL21(DE3) 菌株,并于37℃ 下培养,通过IPTG进行诱导表达4 h 后,进行菌体收集。收集后的菌体进行超声后,采用 SDS-PAGE 电泳观察全菌种融合蛋白的表达量。

图1 融合蛋白表达结构图

表1 促表达所用标签信息

表2 胸腺素 α1 融合蛋白信息
由图2和图3可知,无融合标签的胸腺素α1和β4在大肠杆菌 BL21(DE3) 表达菌株中未表达;在筛选的8种融合标签中,有4种可以使胸腺素α1有效表达,分别是A18-KEKE、DKL6K、A8-GFIL和SUMO;有3种融合标签可以使胸腺素β4有效表达,分别是A18-KEKE、DKL6K和SUMO。可见A18-KEKE、DKL6K和SUMO同时适用于2种胸腺素的表达。
2.2 融合标签应用于其他胸腺素家族蛋白的表达
由于SUMO分子量较大 (13 661.74 Da),在整个融合蛋白的占比较大。融合标签A18-KEKE和DKL6K的分子量较小,因此选取这2种融合标签与胸腺素家族蛋白 (胸腺素β4、胸腺素β4Y、胸腺素β10和胸腺素β15) 进行融合表达,结果如图4所示。A18-KEKE和DKL6K融合标签可以有效地促进胸腺素β4Y、胸腺素β10和胸腺素β15在大肠杆菌中的表达。为了进一步验证融合蛋白在大肠杆菌的表达形式,利用超声波破碎细胞壁,离心后通过 SDS-PAGE 电泳分析。由图5可知,A18-KEKE-胸腺素家族融合蛋白均表达在上清中,说明均为可溶性表达,这样更有利于下游的蛋白制备,从而避免形成不可溶性包涵体。

表3 胸腺素β4融合蛋白信息
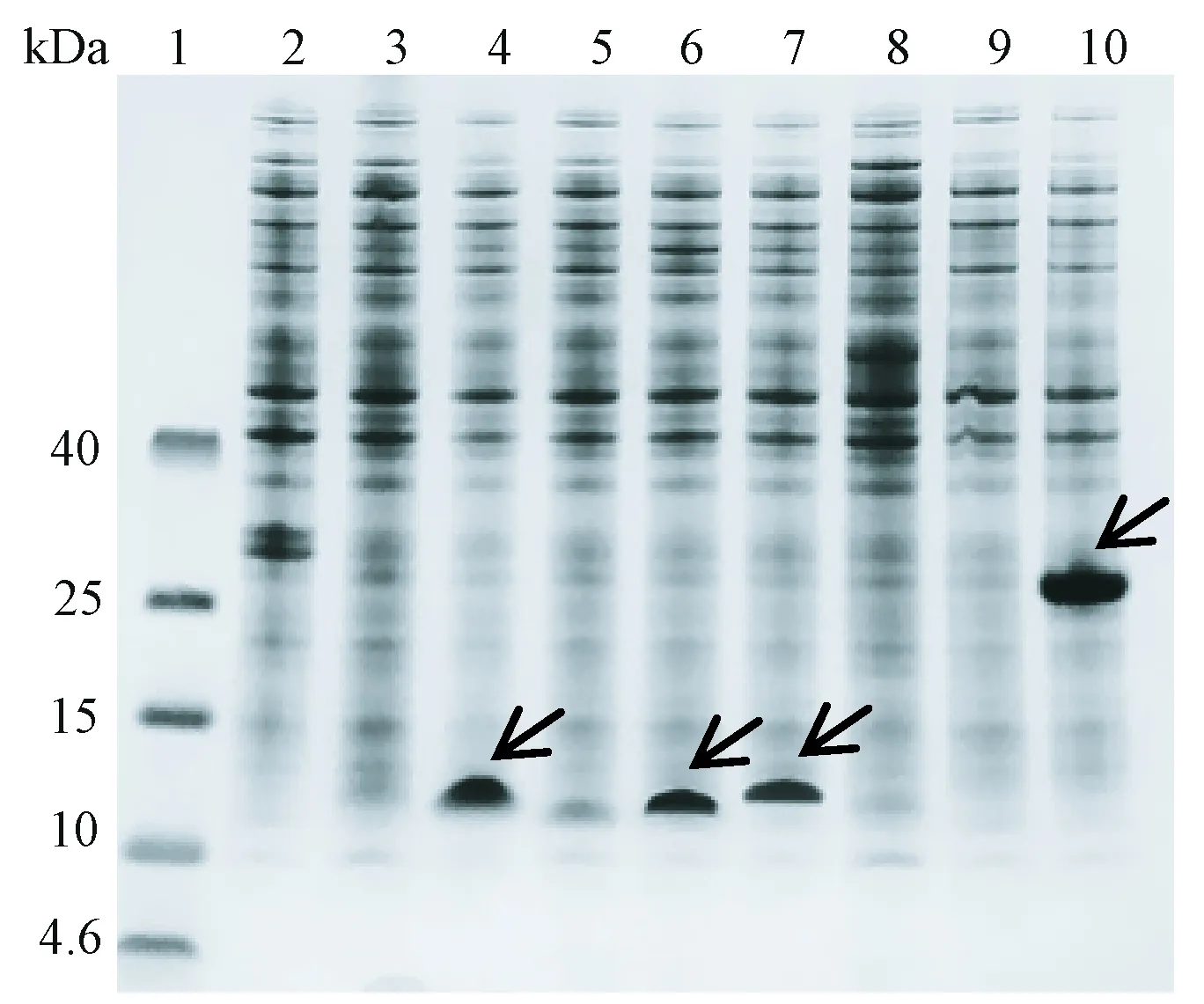
注:1:标准蛋白;2:无融合标签的胸腺素α1;3:A16-LELK融合胸腺素α1;4:A18-KEKE融合胸腺素α1;5: A18-EKEK融合胸腺素α1;6:DKL6K融合胸腺素α1;7:A8-GFIL融合胸腺素α1;8:A12-FKFE融合胸腺素α1;9:Insu.B融合胸腺素α1;10:SUMO融合胸腺素α1; 箭头表示重组蛋白位置。
2.3 融合蛋白的表达鉴定
利用LC/MS对不同表达载体所表达融合蛋白的完整分子量进行验证,结果显示(图6),所有被测样品的单同位素分子量均与理论值差值在1 Da 以内,表明过表达条带含有目的多肽。
2.4 融合蛋白表达量定量分析
利用反相超高效液相色谱法对不同表达载体的单位表达量进行检测,结果显示 (图7-A),几种目的蛋白均在洗脱梯度内表征为明显主峰。根据多肽标准品峰面积绘制标准曲线后,积分换算后可得每种样品中的目的融合多肽的单位表达量 (mg·OD-1·L-1)。结果显示(图7-B),带有融合标签A18-KEKE的胸腺素表达载体,可在大肠杆菌中实现高表达,单位表达量在73~123 mg·OD-1·L-1之间。
2.5 融合标签应用于其他常见治疗性多肽的表达
为了进一步拓展 A18-KEKE 和 DKL6K 对多肽类蛋白在体外表达的适用性,将这2种融合标签融合于促进胰高血糖素样肽-1 (glucagon like peptide 1,GLP-1)、胰高血糖素样肽-2 (glucagon like peptide 2,GLP-2)、甲状旁腺激素(parathyroid hormone,PTH 1-34) 和糖依赖性胰样多肽 (glucose-dependent insulinotropic polypeptide,GIP) (表4)。由图8可知,这2种融合标签可以有效地促进GLP-1、GLP-2、PTH 1-34和GIP,证实了这2种融合标签的广谱适用性。

注:1:标准蛋白;2:A18-KEKE-胸腺素α1表达菌体裂解液上清液;3:A18-KEKE-胸腺素α1表达菌体裂解液沉淀;4:A18-KEKE-胸腺素β4表达菌体裂解液上清液;5:A18-KEKE-胸腺素β4表达菌体裂解液沉淀;6:A18-KEKE-胸腺素β4Y表达菌体裂解液上清液;7:A18-KEKE-胸腺素β4Y表达菌体裂解液沉淀;8:A18-KEKE-胸腺素β10表达菌体裂解液上清液;9:A18-KEKE-胸腺素β10表达菌体裂解液沉淀;10:A18-KEKE-胸腺素β15表达菌体裂解液上清液;11:A18- KEKE-胸腺素β15表达菌体裂解液沉淀;箭头表示重组蛋白位置。
3 讨论
在胸腺素家族中,关于Tα1 的研究最为深入。Tα1 最早从牛胸腺组织提取的胸腺素组份5 (TF5) 中分离鉴定出来[5],是一种N端乙酰化的含有28个氨基酸的可溶性多肽。其主要功能是促进T淋巴细胞的成熟和分化,并促使成熟的T细胞分泌白介素-2,γ-干扰素等多种淋巴因子,同时促进白介素-2受体的生成[17];另外,Tα1 还可直接抑制或杀伤某些病毒感染细胞和肿瘤细胞[18]。因此,Tα1 已被广泛应用于原发性和继发性免疫缺陷症的预防和治疗,如乙型肝炎、丙型肝炎、艾滋病、恶性黑色素瘤、非小细胞性肺癌[17]、冠状病毒引起的 SARS 和 2019新冠肺炎等[19-20]。目前,国内外已有多家制药企业的 Tα1 产品上市,年销售额30亿人民币以上,市场十分广阔。Tβ4是胸腺素家族中另一有广泛临床应用潜力的成员,其主要功能为调节人体内肌动蛋白,在组织再生、重塑、创伤愈合、肿瘤发病与转移、炎症、毛囊发育等生理、病理过程中起重要作用[21-22]。目前,已有制药企业展开 Tβ4 在心肌埂塞等疾病领域的临床试验[23-24]。
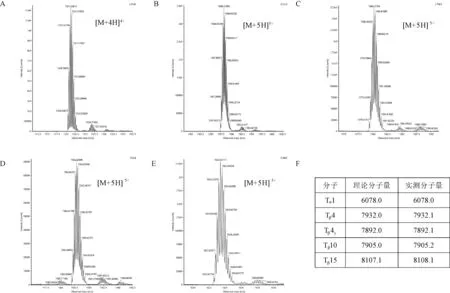
注:A~E分别表示胸腺素α1, β4, β4Y, β10, β15与表达标签A18-KEKE融合蛋白完整分子量鉴定,显示结果为质谱的质核比 图;F:融合蛋白理论和表观分子量比较。
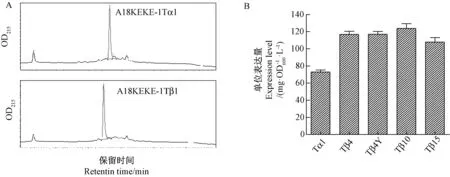
注:A为典型色谱图;B为随机选取3个克隆,表达后经高效液相色谱分析,主峰峰面积积分后,参照标准品峰面积换算,计算单位表达量。
近年来,随着体外N端乙酰化修饰技术的成熟, 利用基因工程技术制备重组 Tα1 成为替代化学合成的趋势,重组Tα1也已进入临床实验阶段[11]。目前体外制备多采用多串体(2~8个)基因不溶性包涵体表达[25]和单体基因细胞间质分泌表达[12]两种方式,虽取得一定成功,但缺点明显。多串体基因表达产生包涵体,需经变性溶解、复性、酶解等一系列复杂工艺,生产活性单体;而单体基因分泌表达,受细胞间质空间限制,表达量一般较低,不适于大规模工业化生产。因此,开发一种表达量高且后续工艺简单易行的 Tα1重组表达方法是一个亟待解决的问题。
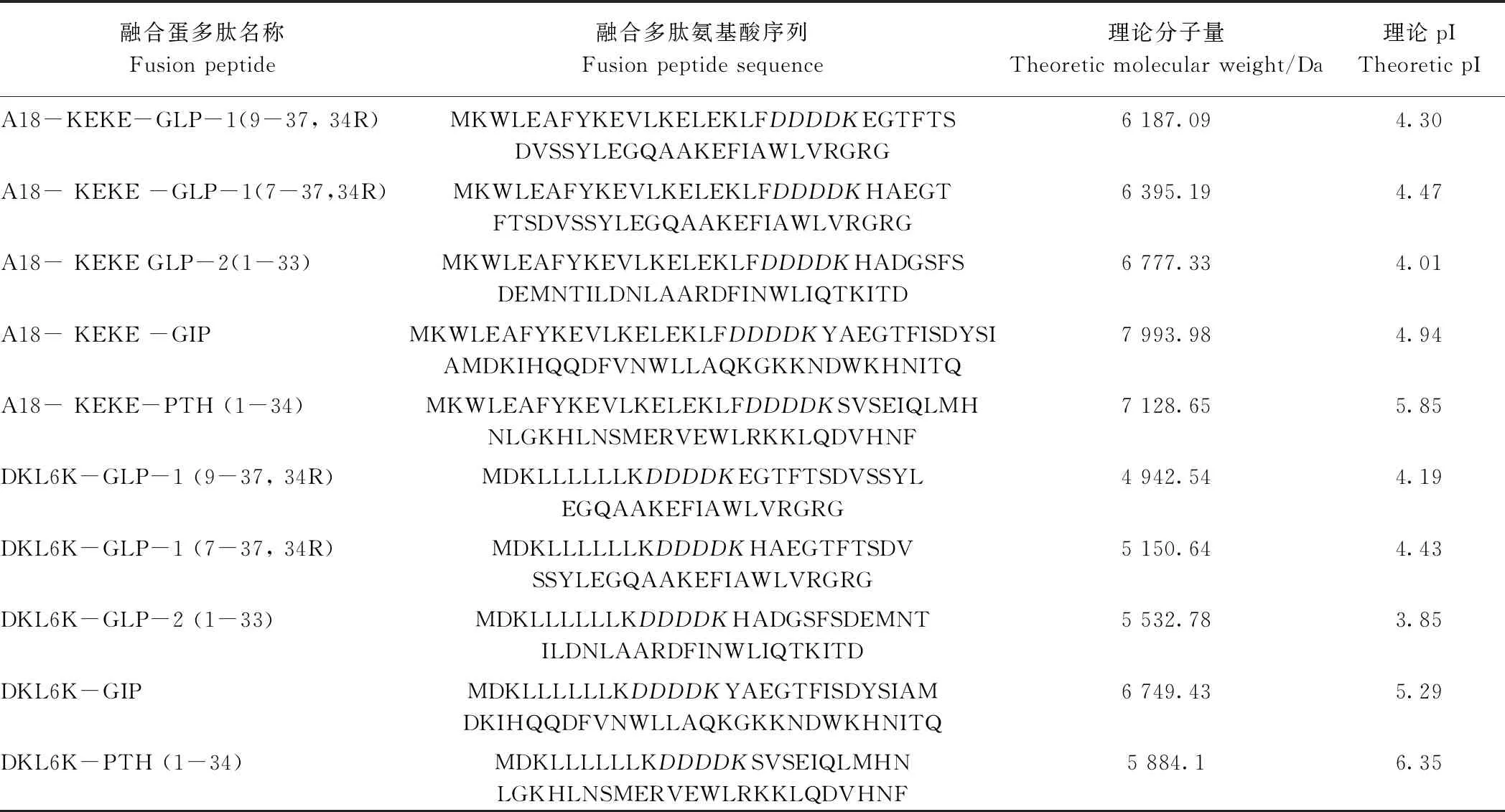
表4 标签A18-KEKE 及DKL6K融合蛋白信息

注:1:A18-KEKE-GLP-1 (9-37, 34R) 融合蛋白表达;2:A18- KEKE-GLP-1 (7-37, 34R) 融合蛋白表达;3:A18- KEKE GLP-2 (1-33) 融合蛋白表达;4:A18- KEKE-GIP融合蛋白表达;5:A18- KEKE PTH (1-34)融合蛋白表达;6:标准蛋白;7:DKL6K-GLP-1 (9-37, 34R)融合蛋白表达;8:DKL6K-GLP-1 (7-37, 34R)融合蛋白表达;9:DKL6K-GLP-2 (1-33)融合蛋白表达;10:DKL6K-GIP融合蛋白表达; 11:DKL6K-PTH (1-34)融合蛋白表达;箭头表示重组蛋白位置。
大肠杆菌平台已被广泛应用于多肽产品的生产,长度较短的(小于100个氨基酸)多肽在重组表达过程中易被蛋白酶降解,且在宿主菌内表达时,宿主菌会调动各种机制来阻止其过量表达,导致目的蛋白表达量降低,因此可通过添加融合标签应用于短肽的生产。常用的融合标签有:谷胱甘肽转移酶 (GST)、麦芽糖结合蛋白 (MBP)、硫氧还蛋白 (Trx)、SUMO蛋白酶 (SUMO)、泛素 (ubiquitin) 等[26-28],然而这些标签蛋白分子量较大 (10~40 kDa),在蛋白质过表达过程中会消耗更多代谢能量,因此造成如 Tα1 较短目的多肽在融合蛋白中所占比例较低 (20%以下),严重影响最终得率。近年来,很多两亲性 β 折叠、α 螺旋短肽及类表面活性剂短肽融合标签被成功应用于多种生物活性多肽重组表达,但融合蛋白均以不溶性的包涵体形式存在,需经变性溶解-复性等过程产生活性单体多肽分子,工艺相对复杂。且在复性过程中,蛋白往往产生多种异构体,不利于目的多肽的纯化。
本研究首次成功设计并筛选到了 2 种标签 (A18-KEKE和DKL6K),有效促进了Tα1 和 Tβ4 等胸腺素多肽的表达,且均为可溶性表达。后续可以利用离子交换,凝胶过滤层析等方法进行蛋白分离纯化,有效简化重组表达后纯化操作,为胸腺素家族多肽蛋白的大规模生产奠定基础。本研究筛选到的2种融合标签可能帮助多肽正确折叠进而促进其可溶性表达,但具体机制尚不清楚,还需进一步研究。通过超高效反相液相色谱对单位表达量进行测定,预期在高密度发酵中,目的多肽产量有望达到3 g·L-1培养液以上,应用潜力巨大。同时,这2种融合标签亦可有效促进人高血糖素样肽 (GLP-1, GLP-2)、人甲状旁腺素PTH (1-34)、糖依赖性胰样多肽 (GIP) 等多肽在大肠杆菌中的表达,具有一定的普适性。本研究对其中结构与组成较为复杂的甲状旁腺激素 (PTH 1-34) 进行了纯化和体外细胞活性测定,以检测所用标签及表达体系对蛋白的活性的影响情况,结果显示,纯化得到的PTH 1-34具有较好的细胞活性。而对于结构简单、不含有二硫键、不需要糖基化的胸腺素多肽,通过该系统表达、纯化得到了纯度较高、性质均一的目的蛋白,后续将进一步建立其活性测定方法,进行深入研究。本研究筛选出了2种短肽融合标签,能够有效提高多肽的表达产量,为拓宽多肽类药物的生产应用提供了理论参考。
4 结论
本研究筛选到了2种胸腺素家族多肽在大肠杆菌中重组表达的融合标签(A18-KEKE和DKL6K)。2种融合标签与胸腺肽所形成的融合蛋白,在被试验的条件下均以可溶性蛋白形式表达,易于分离纯化,且单位表达量较高。2种融合标签也被证实可用于人高血糖素样肽等多肽在大肠杆菌中的过表达,具备一定的普适性。本研究为胸腺素家族多肽的大量生产应用奠定科学基础。

