产科弥散性血管内凝血诊断的研究进展
耿墨钊,姜 昊
(1.首都医科大学附属北京妇产医院,北京 100026;2.首都医科大学附属北京友谊医院)
近年来,孕产妇死亡率显著下降[1],但是遭受严重的妊娠并发症的孕产妇却在增多。产科弥散性血管内凝血(disseminated intravascular coagulation;DIC)是严重妊娠并发症中占比最高的疾病,大约占34.5 %[2]。产科弥散性血管内凝血是指在许多产科疾病基础上,致病因素损伤微血管体系,导致凝血活化,全身微血管血栓形成、凝血因子大量消耗并继发纤溶亢进,引起以出血及微循环衰竭为特征的临床综合征[3]。这种综合征往往起病急、变化快,易与原发病混淆,易发生严重休克、多器官功能障碍,严重影响母婴的生存与健康。处理的关键是及早识别和及时干预[4]。因此,有必要就及早识别总结临床经验。
1 概述
就产科所有疾病而言,产科DIC的发生率相对较低,随着诊断标准变化及治疗水平增加,发达国家发生率有所下降,澳大利亚产科弥散性血管内凝血发生率约0.22 %,2008年发生率达峰(约0.36 %),近年来逐渐下降,2013年发生率约0.17 %;英国产科弥散性血管内凝血发生率约0.22 %,2010年发生率达峰(约0.42 %)后近年来逐渐下降,2013年发生率约0.08 %;美国产科弥散性血管内凝血发生率约0.52 %,2010年发生率达峰(约0.75 %)后近年来逐渐下降,2013年发生率约0.52 %[2]。同一时期不同国家发生率不同的原因可能与诊断标准不一致相关。因此有必要对国际上不同的产科DIC诊断标准进行综述,以对比吸取有益经验。
妊娠作为一个适应性的自然生理过程,为防止产后出血,机体处于血栓前状态,子宫蜕膜、绒毛膜和羊膜产生的大量组织因子可有效地局部止血。除此之外,孕妇的血浆还有以下改变:凝血因子Ⅶ、Ⅷ、Ⅸ、Ⅹ、Ⅻ和纤维蛋白原的浓度增加;抗凝蛋白如蛋白S和组织因子途径抑制物1浓度降低;机体对活化蛋白C敏感性的下降;因纤溶酶原激活物抑制剂低活化作用所致的纤维蛋白溶解作用减弱[5]。孕产妇DIC的诊断直接使用国际血栓与止血协会标准(ISTH)、日本卫生福利部标准(JMHW)、日本急诊医学学会标准(JAAM),敏感性和特异性均不能满足临床需求。
2 诊断
DIC的诊断没有金标准,现阶段主要是评分系统辅助诊断DIC,国际血栓与止血协会标准(ISTH)的标准妊娠特异性不佳。Erez等[5]2014年提出了敏感性和特异性较好的改良版产科DIC评分系统。使用该评分系统(表1)≥26分可诊断DIC[6]。使用该评分系统对产科DIC患者的各项凝血指标进行统计分析,认为PT的变化作为诊断标准,曲线下面积为0.96(P<0.001),PT延长超过1.55 s,DIC诊断的敏感性为87.0 %,特异性为90.0 %;血小板计数作为诊断标准,诊断敏感性为86.0 %,特异性为71.0 %;纤维蛋白原浓度作为诊断标准,曲线下面积为0.95(P<0.001),纤维蛋白原水平≤3.9 g/L为界值诊断DIC,具有87.0 %的诊断敏感性和92.0 %的特异性[4]。
但是上述评分系统未对产科DIC的原发病和临床表现赋予分值,并未被广泛使用。常见的产科DIC发病原因包括导致DIC的产科基础疾病如胎盘早剥、产后出血(与子宫收缩乏力、伴或不伴植入的前置胎盘、子宫破裂或软产道血肿、子宫内翻相关联的)、羊水栓塞、HELLP综合征、子痫前期或子痫、死胎滞留、妊娠期急性脂肪肝[7]。常见的临床表现包括不能用原发病解释的严重或多发出血倾向、微循环障碍或休克;广泛性皮肤、黏膜栓塞,灶性缺血性坏死、脱落及溃疡形成,不明原因的肺、肾、脑等脏器功能衰竭[3]。
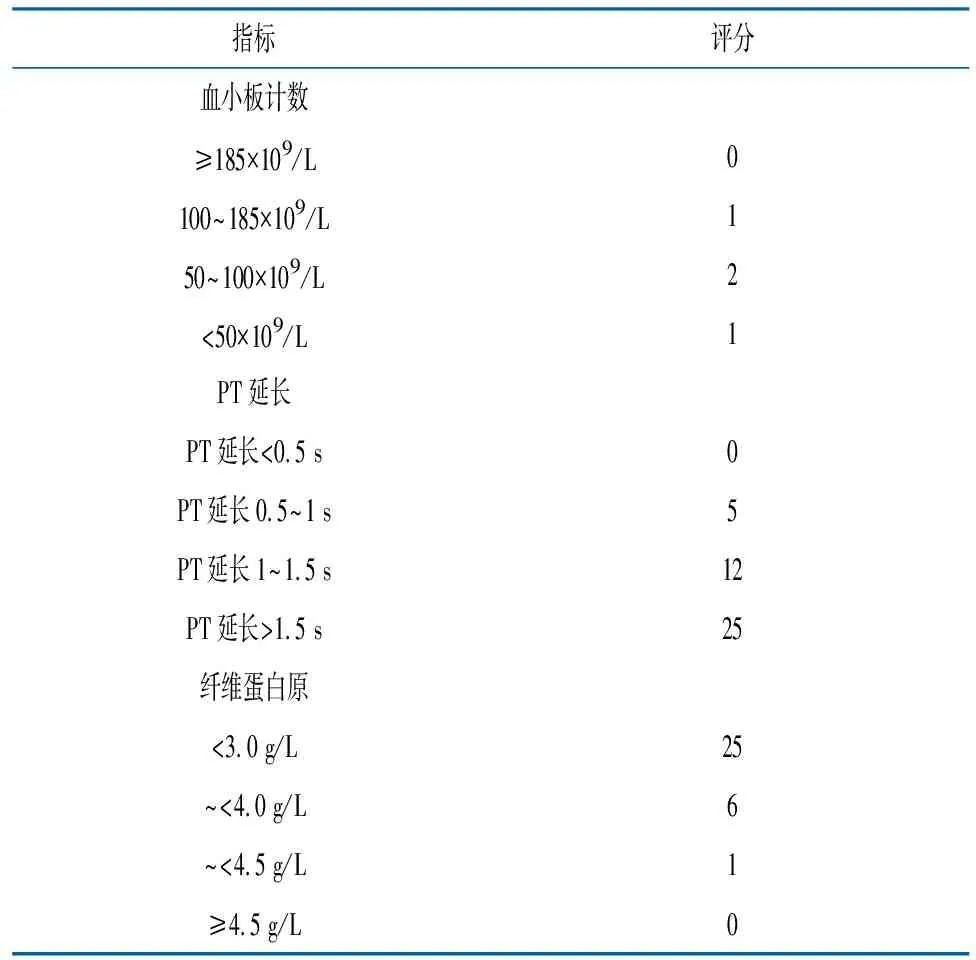
表1 改良ISTH产科DIC评分系统
中华医学会血液学分会血栓与止血学组2017年提出的中国弥散性血管内凝血诊断积分系统(CDSS)[3](表2),该系统突出了基础疾病和临床表现的重要性,强化动态监测原则,应用CDSS评分需计分1次/d,≥7分时可诊断为DIC。但其在产科的应用价值仍需要进一步的探讨。孕产妇的纤维蛋白原水平明显高于普通人,所以该系统界值定为1.0 g/L偏低,可能影响DIC的早期识别和早期救治。临床需要寻找适合于不同孕周及围生期的各项凝血指标DIC诊断界值,建立适合产科这一特殊人群的DIC诊断标准,且需要进一步作前瞻性验证。
当然,妊娠期发生的DIC的基础病因除了常见的妊娠期并发症,可以是其他非产科病因,如果合并有胎死宫内等胎儿并发症、子痫前期等母体并发症要考虑到急性早幼粒白血病的可能[8];如果合并静脉、淋巴管的异常,要考虑Klippel-Trenaunay综合征[9]可能;如果合并子痫前期、子痫、HELLP综合征,有上腹部症状,还要考虑肝破裂可能[6],高龄和多胎也会增加肝破裂风险;如果孕妇本身遭受了车祸等创伤,更需要警惕DIC的发生[10](Gonzalez等[10]报告了1例车祸致多发伤的孕妇发生了DIC,胎儿颅骨骨折,可见创伤对组织的损伤程度之重)。如果妊娠期发生不明原因的DIC,需要警惕孕妇合并未明确诊断的恶性肿瘤可能[11]。
妊娠期感染新型冠状病毒的孕妇发生的DIC,其诊断标准可以是感染引起的弥散性血管内凝血(sepsis-induced coagulopathy,SIC)标准(表3)[12-13]。SIC诊断总分≥4分即可诊断感染导致的DIC。SIC多表现为组织灌注不足导致的多器官功能障碍,而非出血,所以纤溶相关的指标如纤维蛋白原浓度及D二聚体水平与SIC的严重程度无关。因血小板水平下降和PT时间延长与脓毒症死亡率增加相关,SIC评分表列入了血小板计数、INR和SOFA评分。在这个评分系统中,SOFA是为了明确脓毒症的存在,而非反应疾病严重程度,所以SOFA≥2分时均记作2分。因此,不同原发病基础上的DIC产科标准可能不相同。
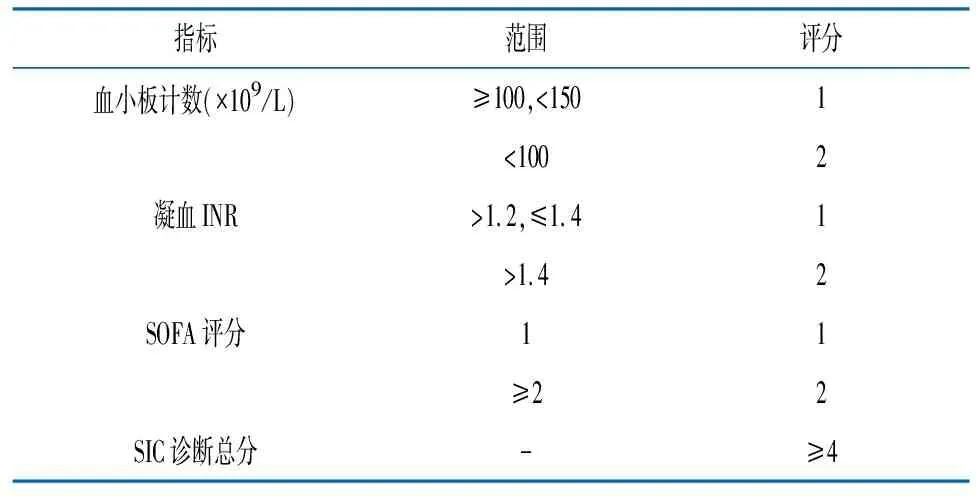
表3 cSIC评分系统
妊娠期DIC的诊断有时是临床诊断后再用实验室指标确认,所以当怀疑有DIC发生时就要积极的治疗,不能等待明确诊断后再处理,因为有时诸如胎盘早剥、多发创伤发生时必须及时外科处理。早期诊断可以使患者在发病的第一时间得到有效准确的诊断和治疗,使临床治疗效果进一步提高[14]。此外,判断凝血功能的指标除了传统的凝血检查,还可以结合血栓弹力图(thrombelastography,TEG)。TEG检测时间短,弥补了常规凝血检测不能反映纤溶系统和血小板功能的缺陷,可检测到75.0 %的临床凝血异常,帮助预防和治疗孕妇的产后出血[15]。
Alhousseini等[16]提出一个妊娠特异性的隐匿性DIC的评分系统,与妊娠期凝血系统的生理改变相适应,在识别需要输血治疗的产科出血的风险方面可能是一个有用的工具。
3 讨论
众所周知,严重的产后大出血往往伴有凝血功能的异常,这种异常往往被认为是DIC,ACOG,曾有专家认为这是错误的。DIC是以凝血物质消耗、纤溶亢进、出血及微循环衰竭为特征的,是需要抗凝治疗的。只有凝血物质真实地大量的消耗造成的不凝血才可以被认为是DIC,因产后出血导致的凝血物质丢失造成的低凝状态不是DIC。
但是,产科DIC有其不同于其他疾病导致的DIC的特点,通过积极的预防和处理,可避免不良的结局。所以相比于诊断工具的特异性,应更加强调诊断工具的敏感性。临床上及时明确诊断并采取有效的治疗措施,合理使用肝素,及时输血或血制品治疗,及时止血和防止凝血障碍的发展至关重要[17]。
值得注意的是,积分诊断工具是需要更新的,例如更新“推荐复查化验时间间隔”:鉴于诊断的依据主要是凝血功能化验,所以对于怀疑DIC的病人应加强产科患者凝血功能检验,根据积分分值建议化验时间,利于DIC疾病的早期诊断[18]。例如更新“中国CDSS可疑产科DIC标准”:可疑DIC时,早期成分输血有助于祛除病因、赢得抢救时间,根据凝血异常类型,合理使用各种成分血液制品,可提高抢救成功率。例如更新“凝血功能异常也可用R值替代纤维蛋白原浓度”:TEG可以实现对产科出血进行快速、准确、动态、直观的监测,为临床治疗提供直观依据的同时,也为产科输血治疗提供依据和指导,减少并发症的发生,避免血制品滥用,减少过敏反应的发生[15]。再例如更新“推荐可疑DIC时护士一对一观察”:医护团队的合作尤为重要,护士积极观察并尽早发现危重的症状,及时报告给主管医生,可以为医生的及早诊断提供有益依据。快速建立有效的静脉通道,准确及时地执行各项相应的治疗措施,为治疗成功提供有力保证。

