染色体微阵列分析技术在先天性心脏病胎儿中的临床应用
汪 敏,赵绍杰,卢 斌,肖建平,赵 丽
(南京医科大学附属无锡妇幼保健院妇产科,无锡 214000)
先天性心脏病(congenital heart disease,CHD)是最常见的出生缺陷之一,约占各种先天性疾病的1/3,在新生儿中的发病率约为(8~9)/1000,全世界每年约有135万例CHD新生儿出生[1]。染色体异常、单基因紊乱、环境致畸、孕产妇暴露和宫内感染都被认为是潜在的原因[2-4]。在产前诊断为CHD的胎儿中,染色体异常约占30%[5]。随着超声技术和外科手术的发展,大多数CHD在产前可被识别,大多数类型的CHD在修补术后能恢复正常或接近正常的心功能。合并染色体异常时,CHD胎儿的预后因严重的心外结构异常和(或)产后神经系统发育障碍而不尽人意。因此,推荐对患有CHD的胎儿进行产前遗传学诊断。过去几十年,G显带核型分析和荧光原位杂交(fluorescence in situ hybridization,FISH)是临床中CHD胎儿用来检测染色体异常的主要方法。然而G显带核型分析受限于耗时和分辨率低,而FISH受限于整个基因组的有限覆盖范围。染色体微阵列分析技术(chromosome microarray analysis,CMA)在整个基因水平上能同时检测染色体数目异常和微观的染色体不平衡,已被用于识别产前和产后CHD病例的染色体异常。单核苷酸多态性微阵列技术(single nucleotide polymorphism array,SNP array)是其中的一种检测技术。本研究旨在探讨SNP技术在检测胎儿CHD染色体异常的临床应用价值。
1 资料与方法
1.1 资料来源 收集2016年1月至2020年3月因产前检查存在高危因素在南京医科大学附属无锡妇幼保健院产前诊断中心就诊,行超声心动图提示CHD并接受侵入性产前诊断的100例胎儿的临床资料。所有胎儿标本均采用羊膜腔穿刺术采集,标本送至北京贝康医学检验所,采用SNP技术行CMA检测。纳入标准:产前检查存在以下1项或1项以上高危因素:唐氏筛查高风险或临界风险、早孕B超提示NT增厚(>2.5mm)或鼻骨缺失、孕妇高龄(>35岁)、既往畸形儿分娩史等。排除标准:双胎妊娠、无上述高危因素的单胎妊娠。由经验丰富的临床遗传医生对CMA的优点和潜在风险进行了预先遗传咨询,包括临床意义未明和成年发病的可能性。所有胎儿父母均签署知情同意书。孕妇的平均年龄(30.5±4.7)岁,平均诊断CHD孕周(23.4±2.5)周。100例CHD胎儿中,单纯CHD 22例,CHD合并超声软标记26例,CHD合并心外结构畸形52例。采用Botto等[7]描述的方法对CHD进行分类。
1.2 方法
1.2.1 基因组DNA提取 用QIAamp DNA mini试剂盒(Qiagen,Hilden,Germany)从10ml羊水样本中提取基因组DNA。
1.2.2 CMA检测和结果判读 使用Affy-metrix公司的CytoScan 750k芯片和扩增、杂交试剂盒(illumina),参照Infinium HD Assay标准操作流程进行扩增、杂交、扫描和分析。结果判读参照DGV、ISCA、OMIM、ECIPHER等数据库,判读检出的CNV性质,分为已知致病、疑似致病、临床意义未明、疑似良性、良性5类。对致病性CNV进行荧光定量PCR验证。对临床意义未明CNV胎儿的父母外周血行CMA检测,判断胎儿CNV是遗传父母或新发,以判断CNV的性质。
1.3 统计学处理 采用SPSS17.0软件,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 CHD胎儿染色体异常及CNV结果 100例CHD胎儿中,检出CMA异常70例(70.0%),其中染色体数目异常56例(56.0%),致病性CNV 14例(14.0%),临床意义未明CNV 3例(3.0%)。56例染色体数目异常中,21三体23例,18三体28例,13三体3例,45,XO 2例。14例致病性CNV中,22q11.2微缺失综合征6例,其他已知致病综合征5例,另3例病例中发现与心脏有关的致病基因:1例为右室双出口、主动脉缩窄、左心发育不良,在染色体14q11.2区域存在1.8Mb微缺失,包含基因PRKD1和NKX2-6(病例2),1例房间隔缺损、右室双出口、肺动脉狭窄,在染色体16p13.3区域存在0.3Mb微重复,包含AXIN1基因(病例11),1例永存动脉干、室间隔缺损,在染色体8p23.3区域存在0.2Mb微缺失,此缺失包含MYOM2基因(病例16)。临床意义未明CNV 3例,对其父母的外周血进行CMA检测,临床意义仍无法明确。见表1。
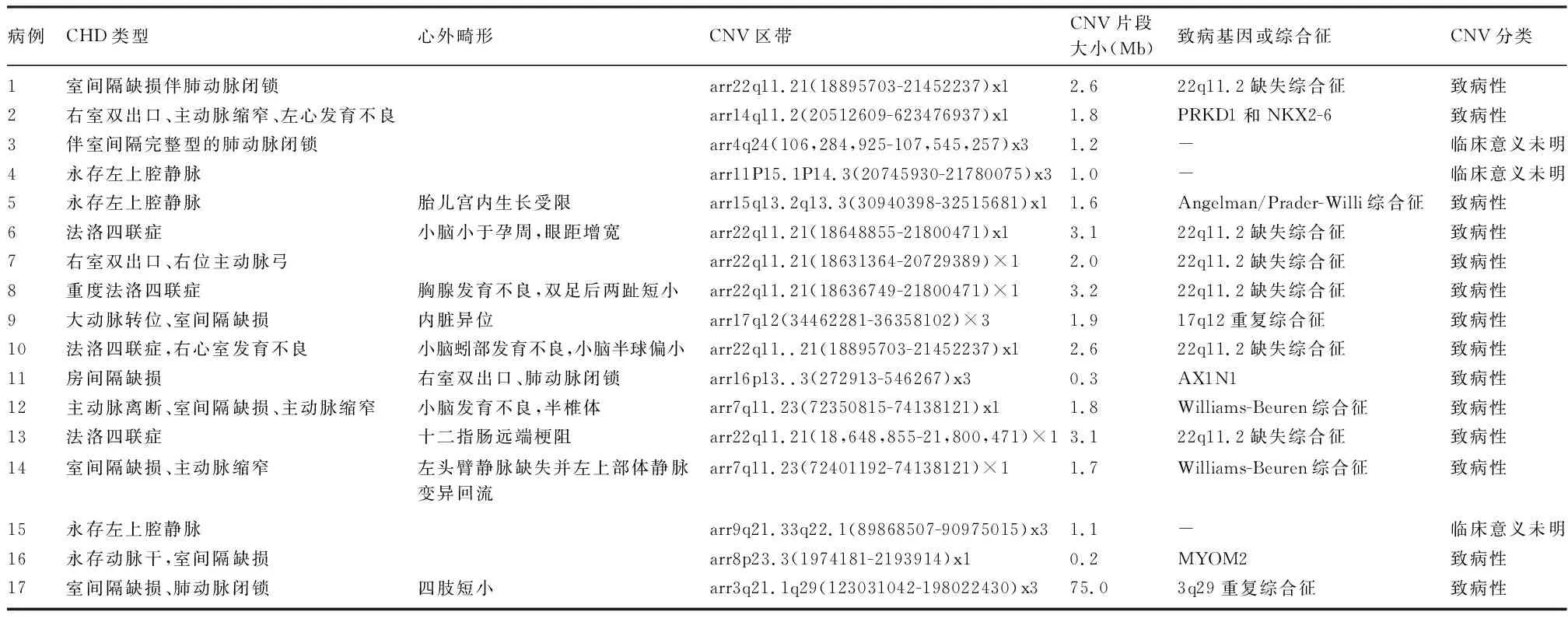
表1 17例CHD胎儿的CNV结果
2.2 不同CHD的亚型分类及染色体异常结果 100例CHD胎儿中,间隔缺损最常见,有43例(43.0%),其次是圆锥动脉干畸形(conotruncal defects,CTD),有32例(32.0%)。间隔缺损、房室间隔缺损、CTD的致病性染色体异常检出率分别为81.4%、80.0%和75.0%。致病性CNV检出率占前三位的是:CTD(34.3%)、左、右室流出道梗阻(20.8%)和间隔缺损(14.0%),各组间比较,差异无统计学意义(P>0.05)。流出道异常致病性CNV检出率是28.6%(16/56)。CTD致病性染色体异常检出率75.0%,其中染色体数目异常40.6%,致病性CNV 34.3%。22q11.2微缺失均为圆锥动脉干畸形,包括4例法洛四联症,1例右室双出口、右位主动脉弓,1例室间隔缺损伴肺动脉闭锁。见表2和表3。
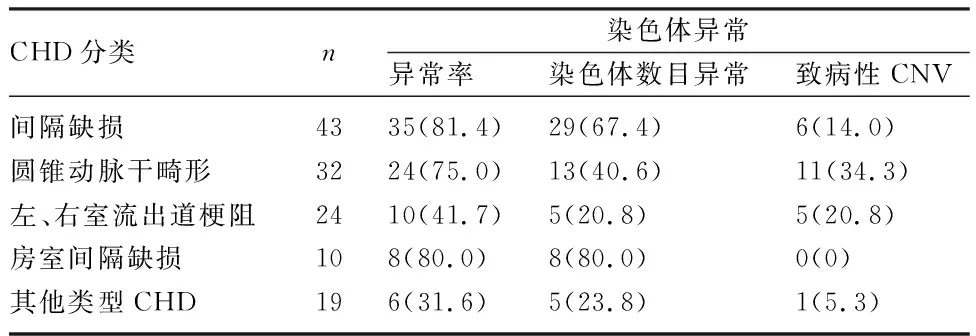
表2 不同CHD亚群致病性染色体异常检出率[n(%)]
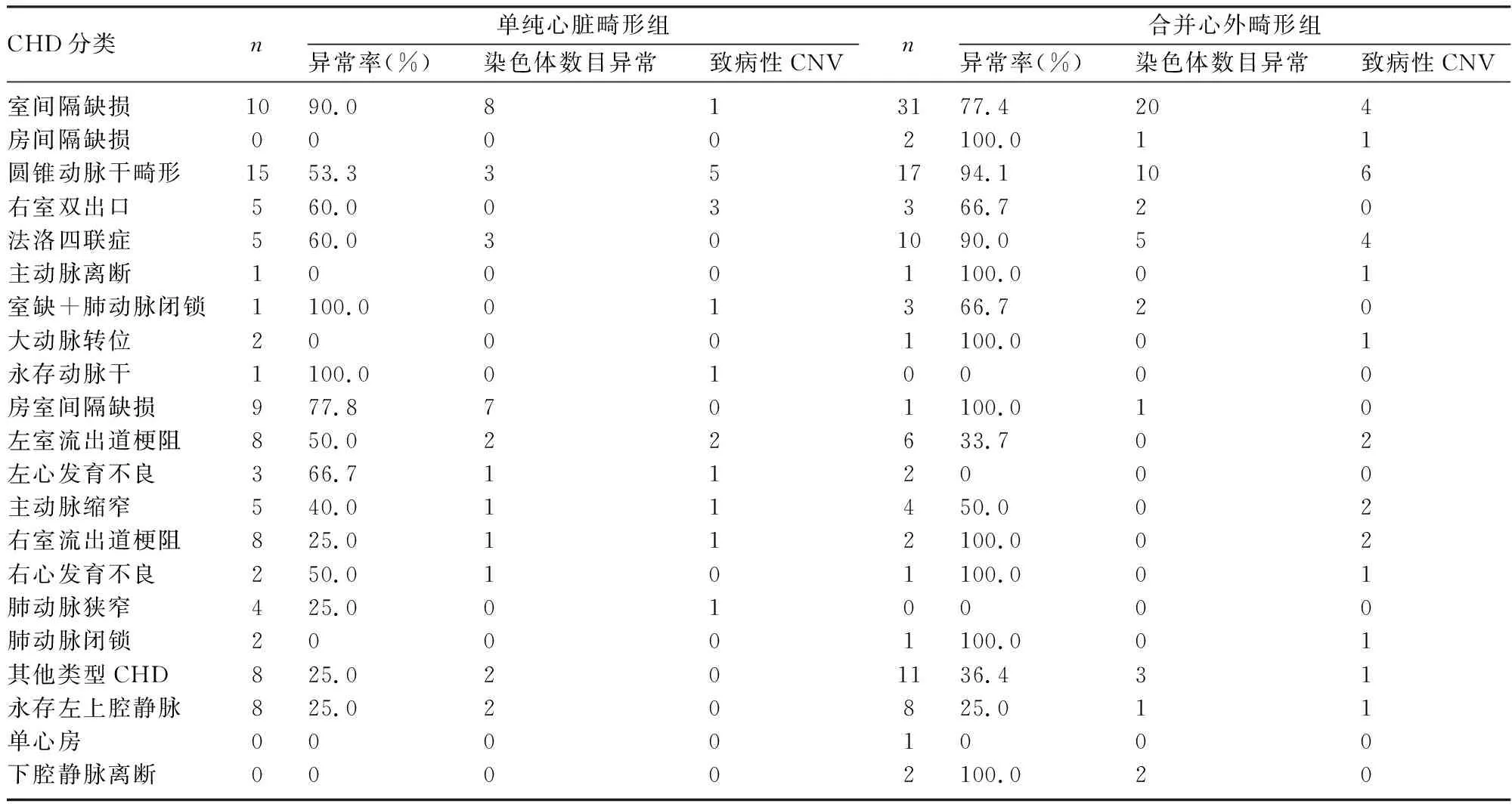
表3 不同CHD亚型致病性染色体异常情况
2.3 单纯CHD、CHD合并软标记、CHD合并心外结构畸形的致病性染色体异常结果 100例CHD胎儿中,单纯CHD、CHD合并软标记、CHD合并心外结构畸形的致病性染色体异常率分别为31.8%、76.9%、82.7%。伴有软标记的致病性染色体异常率明显高于单纯CHD组(P<0.05),伴有心外结构畸形的致病性染色体异常率明显高于单纯CHD组(P<0.05),CHD合并软标记和合并心外结构畸形的致病性染色体异常率无明显差异。单纯CHD、CHD合并软标记、CHD合并心外结构畸形的致病性CNV检出率分别为9.1%、19.2%、13.5%。统计分析显示,致病性CNV在这些组间均无显著差异。见表4。
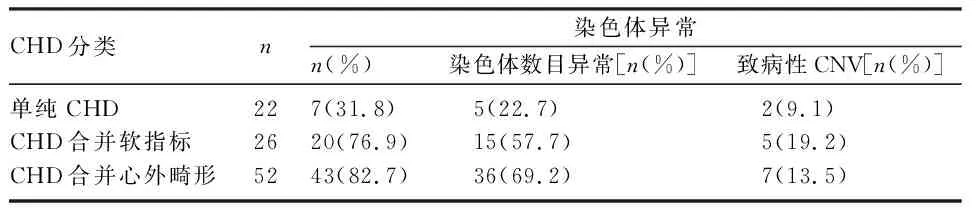
表4 不同组间CHD致病性染色体异常结果
2.4 CHD合并单个与多个心外结构畸形的染色体异常结果 52例合并心外结构畸形的胎儿中,单个结构畸形18例,多个结构畸形34例,伴有多个结构畸形的CHD组致病性染色体异常检出率(30/34,88.2%)与伴有单个结构畸形的CHD组(15/18,83.3%)比较,无统计学意义(P>0.05)。
3 讨 论
CHD是最常见的出生缺陷,各种治疗措施的改进降低了病死率,但是CHD仍是婴幼儿死亡的主要原因之一。目前研究认为,CHD除与染色体非整倍体有关外,还与染色体拷贝数变异有关,尤其是DiGeorge综合征TBXl基因的单倍剂量不足引起心脏发育异常,William综合征ELN基因缺失引起主动脉发育不良、主动脉瓣狭窄等。CMA不仅可检测出21三体、18三体、13三体等非整倍体,还可检测出与CHD相关的22q11.2微缺失/重复综合征、1p36微缺失综合征和1q21微缺失/重复综合征等致病性CNV,额外诊断15%~20%的染色体异常胎儿[6]。
本研究100例CHD胎儿中,致病性染色体异常检出率70.0%,56.0%为染色体数目异常,致病性CNV和临床意义未明CNV的检出率分别为14.0%和3.0%。一项CHD胎儿的系统综述提示CMA检测在染色体核型基础上增加的阳性率是12.0%[7]。Wang等[8]对602例CHD胎儿的研究发现,125例(20.8%)检出致病性染色体异常,其中65例(10.8%)为染色体非整倍体,20例(3.3%)为染色体结构异常,40例(6.6%)为致病性CNV。Luo等[9]研究发现,362例CHD胎儿中,140例(38.7%)检出染色体异常,其中111例(79.3%)为非整倍体,10例为染色体结构异常,19例(5.2%)为致病性或可能致病性CNV。与上述研究相比,本研究中致病性染色体异常检出率和致病性CNV检出率偏高,可能与本研究病例均来自于产前有高危因素的孕妇,且均为引产病例(心脏畸形较严重或合并心外畸形),上述因素导致染色体非整倍体异常升高,此外还可能与样本量较小有关,由于CMA检测费用较高,部分孕妇拒绝行CMA检测,导致样本量较小,需进一步扩大样本量。
CHD亚组中,间隔缺损(81.4%)、房室间隔缺损(AVSD)(80.0%)、圆锥动脉干畸形(75.0%)具有较高的致病性染色体异常检出率;房室间隔缺损病例中并未检出致病性CNV,致病性CNV在圆锥动脉干畸形、左右室流出道梗阻和间隔缺损中检出率分别是34.3%、20.8%、14.0%,心脏流出道异常致病性CNV检出率是28.6%。文献报道,在各种类型的CHD中,流出道异常与致病性CNV关系最为密切,单纯的心脏流出道异常胎儿致病性CNV的检出率可达30.0%[10]。本研究与文献报道一致。Wang等[8]研究中,AVSD胎儿(73.7%)、CTD胎儿(25.7%)的致病性染色体异常检出率较高。在AVSD胎儿中未检出致病性CNV,致病性CNV在CTD胎儿中增加的阳性率为16.9%。本研究AVSD胎儿致病性染色体异常检出率与文献报道接近,且AVSD胎儿亦未检出致病性CNV,但CTD胎儿的致病性染色体异常和致病性CNV检出率较文献报道偏高,可能与本研究所有病例均来自引产病例及样本量较小有关。
CTD是一类流出道异常的复杂型心脏畸形,占CHD的20%~30%[11],包括法洛四联症、大动脉转位、右室双出口、永存动脉干、主动脉离断以及伴有室间隔缺损的肺动脉狭窄或闭锁等。研究表明,CTD与染色体非整倍体及22q11.2微缺失等拷贝数变异有关。本研究中,CTD致病性染色体异常检出率75.0%,其中染色体数目异常40.6%,致病性CNV 34.3%。文献报道,107例CTD胎儿中,染色体非整倍体7例(6.5%),致病性CNV 15例(14.0%)[12],本研究与既往研究不符,可能与本研究所有病例均来自引产病例有关,也可能与检测方法、探针大小不同等有关。文献报道,22q11.2微缺失中CTD发生率最高,以法洛四联症最多见[13]。本研究22q11.2微缺失6例,包括4例法洛四联症,1例右室双出口、右位主动脉弓,1例室间隔缺损伴肺动脉闭锁。本研究22q11.2微缺失综合征均为CTD,且法洛四联症最多,与文献报道相符。本研究中,CTD胎儿检出22q11.2微缺失综合征(18.9%,6/32),比例高于文献报道的10%[12]。本研究中,有3例病例中发现与心脏有关的致病基因:1例为右室双出口、主动脉缩窄、左心发育不良,在染色体14q11.2区域存在1.8Mb微缺失,此缺失存在基因NKX2-6和PRKD1(病例2),NKX2-6是TBX1信号通路的下游基因,其在圆锥动脉干形成过程中起重要作用[14]。PRKD1基因是另一与圆锥动脉干异常有关的单基因,其作用机制是通过调节基因MEF2而发生重要作用[15]。1例房间隔缺损、右室双出口、肺动脉狭窄,在染色体16p13.3区域存在0.3Mb微重复(病例11),包含AXIN1基因,1例永存动脉干、室间隔缺损,在染色体8p23.3区域存在0.2Mb微缺失(病例16),此缺失包含MYOM2基因,AXIN1、MYOM2基因均与心脏异常有关。
众所周知,超声软标记与胎儿非整倍体形成的风险增加有关。文献报道,超声软标记与致病性CNV有关[16-18]。本研究中,伴有软标记的CHD胎儿染色体非整倍体检出率是57.7%,致病性CNV检出率是19.2%,且伴有软标记的致病性染色体异常检出率明显高于单纯CHD组(P<0.05)。文献报道[19],CHD合并其他结构异常时,染色体异常的发生率更高。本研究中,伴有心外结构畸形组致病性染色体异常检出率明显高于单纯CHD组(P<0.05),与文献报道一致。
综上所述,CMA在存在高危因素的CHD胎儿中,致病性染色体异常检出率是70.0%,致病性CNV检出率是14.0%,进一步证实CHD与染色体微缺失或微重复有关。因此,本研究推荐CMA技术应作为产前诊断CHD胎儿的一级检测方法,有利于发现CHD相关的致病基因,有利于产前咨询中正确评估胎儿的预后,为孕妇是否继续妊娠提供更客观的理论依据。

