常见消毒剂对塞内卡病毒杀灭作用的比较研究
齐志涛,王娥娥,张云星,郝苏云,路荣,方建国,高艳华,张燕红,陈九连
(金宇保灵生物药品有限公司,呼和浩特 010100)
塞内卡病毒(Senecavirus A,SVA)是近年来新发现的一种主要引起猪水疱样病变的病毒。早在1988年即在美国猪群中开始流行传播,并且一直在猪群中循环[1]。我国2015年首次在广东发现SVA的存在[2],此后,在我国福建、河南等多地相继检出SVA。猪感染后常表现为鼻端及蹄冠发生水疱、溃烂,发病特征与口蹄疫、猪水泡病、水泡性口炎极为相似,临床上难以区分。在感染猪群中,母猪最易感,发病率高达70%~90%,其次是仔猪,发病率达70%,1~4日龄仔猪感染后死亡率达15%~30%[3]。虽然SVA危害性不及口蹄疫病毒,但由于感染后的发病特征类似于口蹄疫,从而在一定程度上影响了猪的上市及交易。我国农业农村部2018年发布了《农业农村部办公厅关于做好SVA病防治工作的通知》,可见对该疫病的重视程度。目前尚无商品化疫苗可预防该疫病,而环境与圈舍消毒则是最为有效、实用的防范措施,国外学者的研究发现过氧化氢[4]、酚类消毒剂、漂白粉能有效杀灭该病毒,国内尚无此方面的研究。为切实开展相关研究,为疫病防控提供数据支持,维护养猪业生产及猪肉产品质量安全,本文研究了8种常用消毒剂和紫外线对SVA的杀灭作用。
1 材料与方法
1.1 试验材料
1.1.1 试验毒株及细胞 毒株:SVA CH/ZZ/2016株;细胞:PK-15细胞(猪肾细胞),由金宇保灵生物药品有限公司兽用疫苗国家工程实验室保存。
1.1.2 主要试剂 消毒剂:分析纯苯酚(天津市大茂化学试剂厂),常用消毒浓度为2%~5%;新洁尔灭消毒液(山东安杰高科消毒科技有限公司),苯扎溴铵含量为2.7%~3.3%,推荐稀释比例(原液:水)为1∶4;84消毒液(山东利尔康医疗科技股份有限公司),一般物体表面消毒推荐稀释比例(原液:水)为1∶100~1∶200,百毒杀(上海派斯德生化有限公司),圈舍器械消毒推荐使用浓度为0.02%~0.05%;NaOH(天津市北联精细化学品开发有限公司),常用消毒浓度为2%~5%;柠檬酸(天津市申泰化学试剂有限公司),口蹄疫疫苗生产车间常用消毒浓度为0.2%;复方甲酚皂消毒液(山东利尔康医疗科技股份有限公司),推荐稀释比例(原液:水)为1∶2;75%酒精消毒液(山东利尔康医疗科技股份有限公司);
中和剂:百毒杀、新洁尔灭消毒液、84消毒液的中和剂为含有5.0 g/L硫代硫酸钠的PBS溶液;苯酚、复方甲酚皂消毒液的中和剂为含有3%吐温-80+3%卵磷脂的PBS溶液;柠檬酸溶液的中和剂为0.75% NaHCO3溶液;NaOH溶液的中和剂为0.5% HCl溶液[5]。
标准硬水:硬度为342 mg/L,由CaCl20.034 g,MgCl2·6H2O 0.139 g,加蒸馏水至1.0 L配制而成。
其他:0.04 mol/L PH为7.4的PBS。
1.1.3 仪器设备 二级生物安全柜(香港力申发展有限公司)、水浴锅(常州智博瑞仪器制造有限公司 HH-420)、二氧化碳培养箱(Thermo Fisher 14291)。
1.2 试验方法
1.2.1 试验用毒株病毒滴度测定 将SVA CH/ZZ/2016株病毒液用DMEM培养基进行10倍系列倍比稀释(101~108),分别接种于单层PK-15贴壁细胞(96孔细胞培养板),每个稀释度接种4孔,置于37 ℃,含5% CO2培养箱中培养,以Reed-Muench法计算病毒的半数细胞感染量(TCID50)。
1.2.2 消毒剂、中和剂、中和产物对细胞的影响 根据卫生2002版《消毒技术规范》[6],评价中和剂、消毒剂及中和产物对细胞生长状况的影响,共设立6组试验:
第1组为消毒剂(正式试验的最高浓度),分别取消毒剂1.0 mL(用标准硬水分别配制5.0%苯酚溶液、5.0%柠檬酸溶液、2% NaOH溶液、0.5%百毒杀、1∶200稀释的84消毒液、1∶2稀释的复方甲酚皂消毒液、1∶4稀释的新洁尔灭溶液以及未稀释的75%酒精)接种单层PK-15细胞,补维持液9.0 mL,置37 ℃二氧化碳培养箱中培养,48 h观察细胞生长情况。
第2组为中和剂,分别取1.0 mL含5.0 g/L硫代硫酸钠的PBS溶液、含3%吐温-80+3%卵磷脂的PBS溶液、0.75% NaHCO3溶液和0.5% HCl溶液接种单层PK-15细胞,补维持液9.0 mL,置37 ℃二氧化碳培养箱中培养,48 h观察细胞生长情况。
第3组为中和产物,分别取消毒剂(5.0%苯酚溶液、5.0%柠檬酸溶液、2% NaOH溶液、0.5%百毒杀、1∶200稀释的84消毒液、1∶2稀释的复方甲酚皂消毒液、1∶4稀释的新洁尔灭溶液)与适量相对应中和剂混合,作用10 min后混合液即为中和产物,分别取中和产物1.0 mL接种单层PK-15细胞,补维持液9.0 mL,置37 ℃二氧化碳培养箱中培养,48 h观察细胞生长情况。
其余3组为对照组,分别取标准硬水、PBS和细胞维持液对照组各1.0 mL,接种单层PK-15细胞,补维持液9.0 mL,置37 ℃二氧化碳培养箱中培养,48 h观察细胞生长情况。
1.2.3 中和剂中和效果鉴定、中和剂及中和产物对SVA TCID50的影响 根据卫生2002版《消毒技术规范》[6],评价中和剂的中和作用,以及中和剂、中和产物对病毒滴度的影响,试验共设立6组:
第1组为消毒剂+病毒液,分别取消毒剂5.0 mL(用标准硬水分别配制10%苯酚溶液、10%柠檬酸溶液、4% NaOH溶液、1%百毒杀、1∶100稀释的84消毒液、1∶2稀释的新洁尔灭溶液以及未稀释的复方甲酚皂消毒液)与5.0 mL SVA病毒液混合,另取9.0 mL 75%酒精与1.0 mL SVA病毒液混合,于20 ℃水浴作用60 min,取样测定TCID50;
第2组为(消毒剂+病毒液)+中和剂,分别取消毒剂5.0 mL(用标准硬水分别配制10%苯酚溶液、10%柠檬酸溶液、4% NaOH溶液、1%百毒杀、1∶100稀释的84消毒液、1∶2稀释的新洁尔灭溶液以及未稀释的复方甲酚皂消毒液)与5.0 mL SVA病毒液混合,另取4.5 mL 75%酒精与0.5 mL SVA病毒液混合,于20 ℃水浴作用60 min取出混合液0.1 mL,加0.9 mL相应中和剂室温作用5 min,75%酒精试验组加0.9 mL维持液稀释即可,分别取样测定TCID50;
第3组为中和产物(消毒剂+中和剂)+病毒液,分别取消毒剂1.0 mL(用标准硬水分别配制10%苯酚溶液、10%柠檬酸溶液、4% NaOH溶液、1%百毒杀、1∶100稀释的84消毒液、1∶2稀释的新洁尔灭溶液以及未稀释的复方甲酚皂消毒液)加入9.0 mL相应中和剂室温作用5 min,分别取混合液5.0 mL与等量SVA病毒液混合,20 ℃水浴作用60 min,取样测定TCID50;
第4组为(标准硬水+病毒液)+中和剂,取标准硬水5.0 mL与等量SVA病毒液混合,于20 ℃水浴作用60 min后取4.0 mL均分4份,每份1.0 mL,分别加入4种中和剂9.0 mL作用5 min,取样测定TCID50;
第5组为(标准硬水+病毒液)+PBS,取标准硬水5.0 mL与等量SVA病毒液混合,于20 ℃水浴作用60 min后取1.0 mL,加入1.0 mL PBS作用5 min,取样测定TCID50;
第6组为标准硬水+PBS不接毒组,取标准硬水5.0 mL与等量PBS混合,于20 ℃水浴作用60 min后取样测定TCID50。
1.2.4 SVA杀灭试验 用标准硬水将所有消毒剂配制为双倍试验浓度,即4.0%、10.0%的苯酚溶液,复方甲酚皂原液及1∶2稀释液,0.4%、4.0%、10.0%柠檬酸溶液,1.0%、2.0%、4.0%、10.0%NaOH溶液,0.04%、0.1%、0.4%、1.0%百毒杀,1∶2、1∶4稀释的新洁尔灭,1∶50、1∶100、1∶200、1∶400稀释的84消毒液,分别吸取5.0 mL上述消毒剂及5.0 mL标准硬水置于15 mL离心管内,于20 ℃水浴中作用5 min,分别加入5.0 mL SVA病毒液,另取9.0 mL 75%酒精加入1.0 mL SVA病毒液,立即混匀于20 ℃水浴中作用至试验规定时间(10 min、30 min、60 min),立即取出0.1 mL混合液,加入0.9 mL相应中和剂混匀,75%酒精组及标准硬水组加入0.9 mL细胞维持液,作用10 min后测定TCID50。如此试验重复3次,计算各组平均灭活对数值。
取SVA病毒液5.0 mL加5.0 mL细胞维持液混匀,吸取2.5 mL平铺于底面积为12.56 cm2的平皿中,平皿开盖置于生物安全柜中用紫外线照射,照射强度为90 μW/cm2,同时设立同等条件下遮挡紫外线的对照组。作用至试验规定时间(10 min、30 min、60 min),立即取出0.1 mL,加入0.9 mL细胞维持液混匀,测定TCID50。如此试验重复3次,计算各组平均灭活对数值。
1.2.5 平均灭活对数值的计算及对比: 设阳性(病毒)对照组TCID50为NO,试验(消毒)组TCID50)NX,平均灭活对数值= log No-log Nx[6],对比各种消毒剂对SVA的杀灭效果。
2 结果与分析
2.1 试验用毒株病毒滴度测定 经测定,试验用SVA病毒液TCID50为10-7.0/0.1 mL。
2.2 消毒剂、中和剂及中和产物对细胞生长状况的影响 结果如图1所示,除百毒杀组(H所示)细胞出现稍许变圆、漂浮、数量减少以外,其他各组消毒剂均未对细胞生长产生明显影响;5.0 g/L硫代硫酸钠的PBS组(M所示)细胞出现少量变圆、漂浮的情况,其他中和剂实验组细胞生长未见异常;各中和产物对细胞生长未造成显著影响;由消毒剂或中和剂造成的细胞异常生长与SVA引起的细胞病变有明显区别。

注:图A~C分别为细胞维持液、PBS、标准硬水对细胞生长影响的情况;图D细胞病变;图E~L分别为消毒剂苯酚溶液、复方甲酚皂溶液、NaOH溶液、百毒杀溶液、新洁尔灭溶液、84消毒液、75%酒精及柠檬酸溶液对细胞生长影响情况;图M~P分别为中和剂5.0 g/L硫代硫酸钠的PBS、3%吐温-80+3%卵磷脂的PBS、0.75%碳酸氢钠溶液及0.5% HCl溶液对细胞生长影响情况;图Q~W分别为苯酚、复方甲酚皂、柠檬酸、NaOH、百毒杀、新洁尔灭和84消毒液与相应中和剂的中和产物对细胞生长影响情况。
2.3 中和剂中和效果鉴定、中和剂及中和产物对SVA TCID50的影响 表1、表2结果显示,第1组试验中苯酚组、NaOH组和84消毒液组TCID50检测结果为0,其他消毒剂组均不低于5.50;第2组试验中,苯酚组TCID50为2.50,NaOH组和84消毒液组TCID50为2.00,其他消毒剂组为5.50;第3、4、5组测定结果相同,TCID50在5.00~5.50之间;第6组细胞生长未见异常。结果表明,试验中所用中和剂均可中和相应消毒剂的消毒作用,中和剂及中和产物均不影响病毒滴度。
2.4 SVA杀灭试验结果 以下结果为不同消毒剂对SVA的平均灭活对数值,灭活对数值越大,表明灭活效果越强。
2.4.1 不同浓度苯酚溶液对SVA杀灭试验结果 表3结果显示,浓度为5.0%的苯酚溶液与SVA作用时间至少为10 min时,对其灭活对数值为5.50,表明SVA被完全杀灭;当苯酚浓度为2.0%时,与SVA作用60 min灭活对数值为3.00,表明病毒未完全杀灭。
2.4.2 不同浓度复方甲酚皂溶液对SVA杀灭试验结果 表4结果显示,以1∶2和1∶4稀释的复方甲酚皂消毒剂,与SVA作用60 min时,灭活对数值分别为0.75和0.25,表明病毒未被杀灭。
2.4.3 不同浓度柠檬酸溶液对SVA杀灭试验结果 表5结果显示,浓度为0.2%与2.0%的柠檬酸溶液与SVA作用60 min时,两种浓度消毒剂对病毒的平均灭活对数值为0.75,浓度为5.0%的柠檬酸溶液与病毒作用60 min时,灭活对数值为1.5,结果表明,试验所用浓度的柠檬酸溶液不能杀灭SVA。

表1 中和产物对病毒滴度的影响
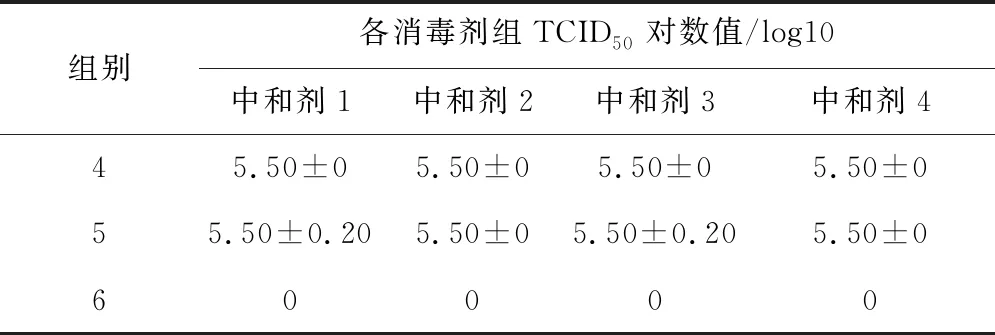
表2 中和剂对病毒滴度的影响

表3 苯酚对SVA杀灭试验结果
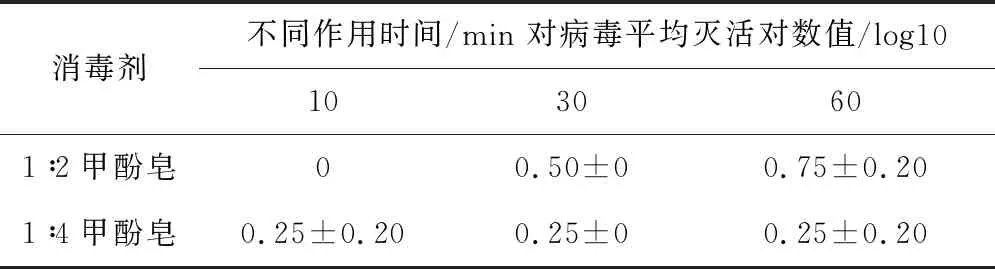
表4 不同浓度甲酚皂溶液对SVA杀灭试验结果
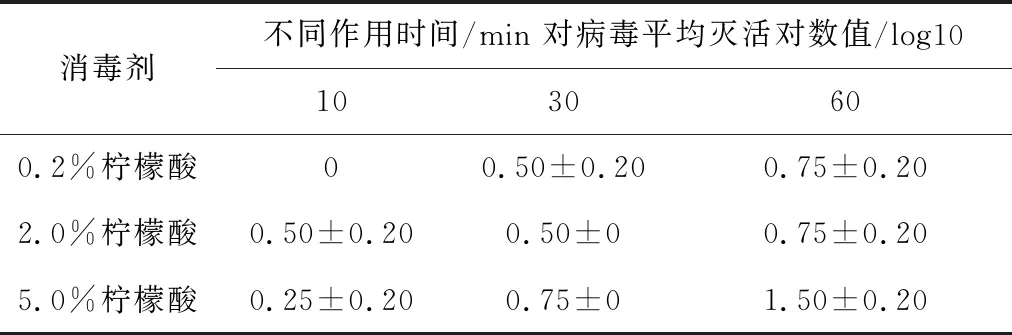
表5 柠檬酸溶液对SVA杀灭试验结果
2.4.4 不同浓度NaOH溶液对SVA杀灭试验结果表6结果显示,用浓度为0.5%、1.0%、2.0%和5.0%的NaOH溶液,分别与SVA作用至少10 min时,各组灭活对数值均为5.50,表明该病毒被完全杀灭。
2.4.5 不同浓度百毒杀溶液对SVA杀灭试验结果表7结果显示,浓度为0.02%的百毒杀与SVA作用60 min时,灭活对数值为0.50;同样作用60 min,百毒杀浓度为0.05%及0.2%时,灭活对数值为0.75,百毒杀浓度为0.5%时,灭活对数值为1.00,表明病毒未被杀灭。
2.4.6 不同浓度新洁尔灭溶液对SVA杀灭试验结果 表8结果显示,以1∶4比例稀释的新洁尔灭消毒液与SVA作用60 min,平均灭活对数值为1.00;1∶8稀释组平均灭活对数值为0.50,表明SVA未被杀灭。
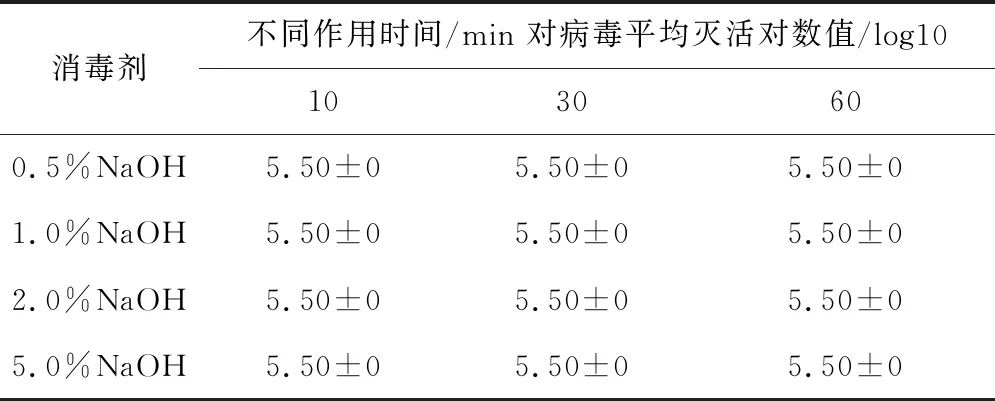
表6 NaOH对SVA杀灭试验结果
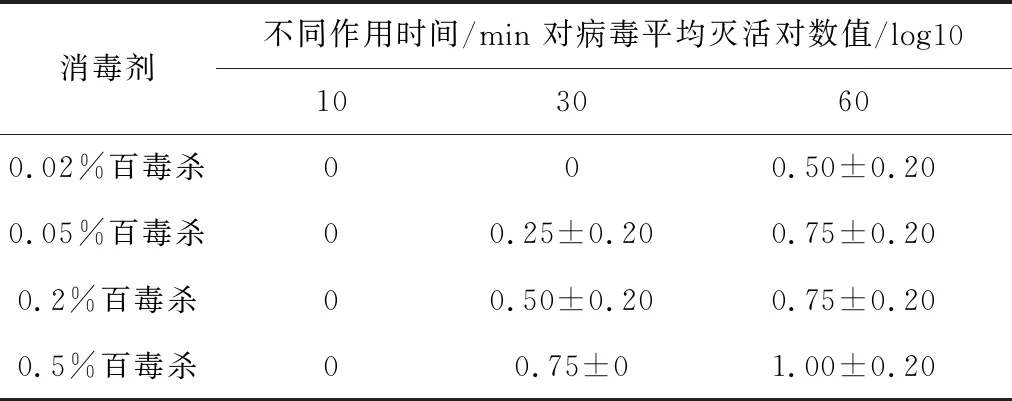
表7 百毒杀对SVA杀灭试验结果
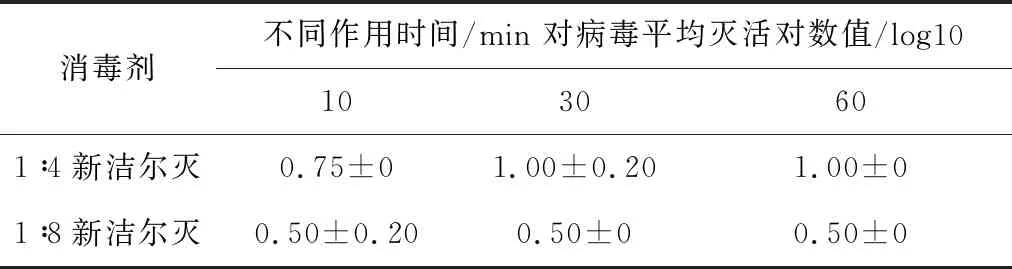
表8 新洁尔灭对SVA杀灭试验结果
2.4.7 不同浓度84消毒液对SVA杀灭试验结果表9结果显示,以1∶100、1∶200比例稀释的84消毒液与SVA作用10 min,对病毒平均灭活对数值为5.50,表明病毒被完全杀灭,以1∶400、1∶800比例稀释的84消毒液对SVA作用60 min,平均灭活对数值为1.00,表明病毒未被完全杀灭。
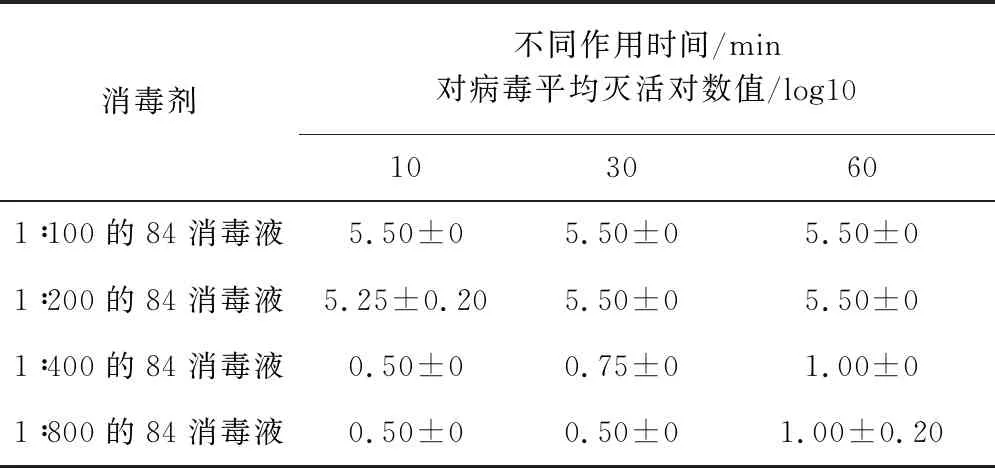
表9 84消毒液对SVA杀灭试验结果

表10 75%酒精、紫外线对SVA杀灭试验结果
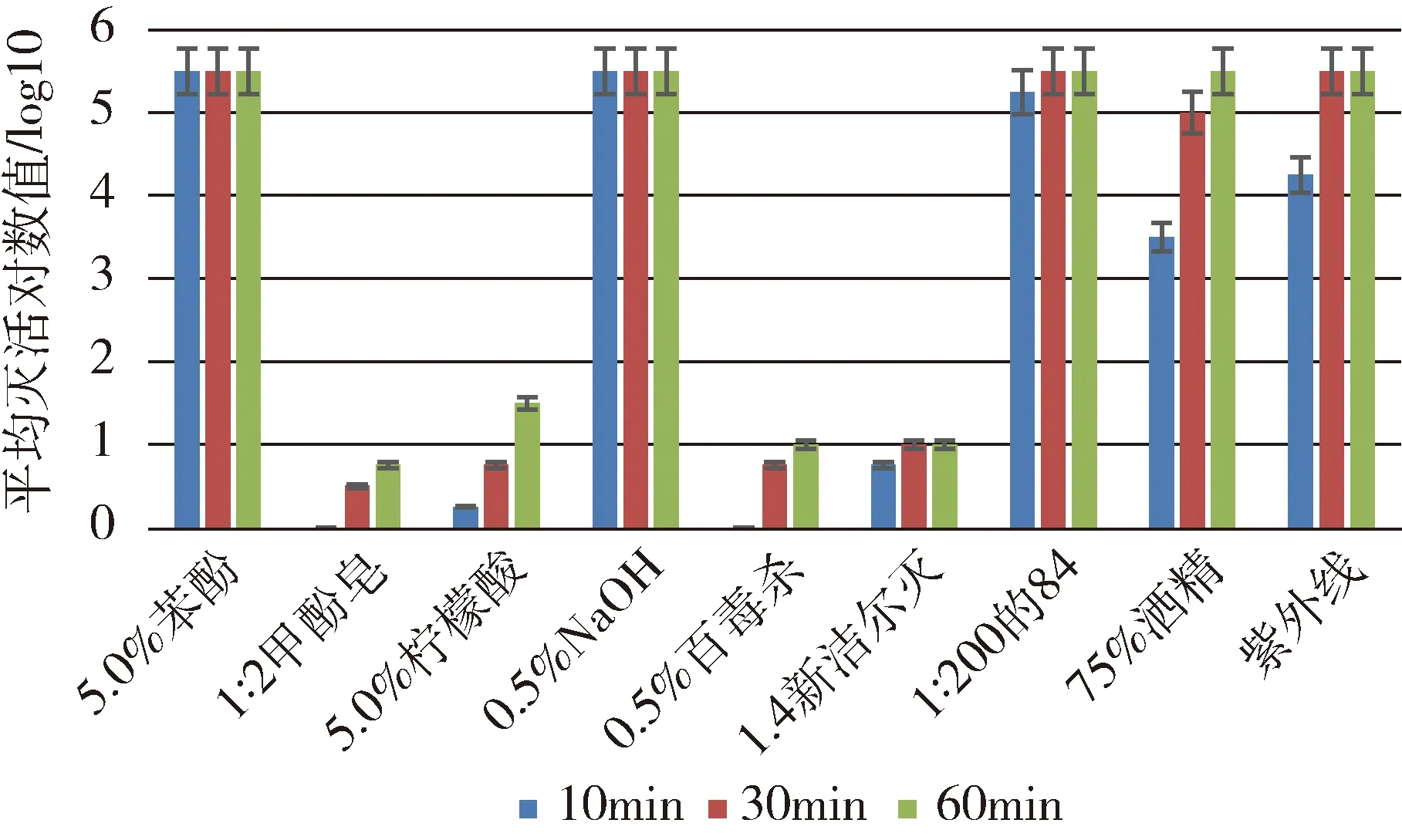
图2 不同消毒剂对SVA杀灭效果的对比
2.4.8 75%酒精、紫外线对SVA杀灭试验结果75%酒精与SVA作用10 min时,平均灭活对数值为3.50,作用30 min时,灭活对数值为5.00,当作用60 min时,平均灭活对数值为5.50,表明75%酒精作用60 min可将SVA完全杀灭;在紫外线照射作用10 min时,对SVA的平均灭活对数值为4.25;照射30 min时,平均灭活对数值为5.50,表明SVA被完全杀灭;紫外线对照组平均灭活对数值为0,表明毒价未降低;标准硬水与SVA作用60 min平均灭活对数值为0,表明标准硬水对SVA无杀灭作用,上述试验成立。
2.5 不同消毒剂对SVA杀灭效果的对比 选取上述结果中消毒剂对SVA最佳杀灭浓度,以及完全杀灭病毒的最低浓度数据进行对比分析,结果如图2所示。
由图2可知,5.0%苯酚溶液、0.5%NaOH溶液对SVA杀灭效果最好,均可在10 min杀灭病毒;其次为1∶200稀释的84消毒液,作用30 min即可将SVA完全杀灭;紫外线对病毒杀灭作用比1∶200的84消毒液稍弱,但也能在30 min杀灭SVA;75%酒精对SVA杀灭作用不及前几种消毒剂,需要60 min才能杀灭;其他消毒剂,包括1∶2复方甲酚皂消毒液、5.0%柠檬酸溶液、0.5%百毒杀及1∶4新洁尔灭溶液对SVA杀灭作用弱,60 min内不能杀灭病毒。
3 讨论与结论
选取8种常见消毒剂和紫外线,设置不同浓度和作用时间,评估对SVA的杀灭效果。结果表明,5.0%的苯酚溶液、0.5%以上的NaOH溶液、低于1∶200浓度的84消毒液、75%酒精以及紫外线对SVA有较强的杀灭作用,其他消毒剂对SVA杀灭作用较弱甚至无作用。
临床上常用1.0%~5.0%的苯酚溶液对医疗器械及排泄物进行消毒[7],有研究表明,苯酚类消毒剂也适用于洁净室的常规清洁消毒。Azad Singh等[8]的研究发现,使用推荐浓度的酚醛类消毒剂在25 ℃和4 ℃的温度下,能杀灭物体表面82.41%的SVA,本研究证明,5.0%的苯酚溶液对SVA有较强杀灭作用,且苯酚浓度符合国标[9]。因此,开展SVA相关研究的实验室,可以参考用5.0%的苯酚溶液处理某些试验器械及废弃物,以保证实验室生物安全;复方甲酚皂消毒剂与苯酚同属于酚类消毒剂,但使用推荐浓度对SVA杀灭作用远远不及苯酚溶液。
NaOH价格低廉、消毒作用强。养殖场在实际生产过程中,通常用2.0%~5.0%的NaOH溶液,对空舍、车辆及人员鞋底进行消毒。依据本研究结果,用0.5%的NaOH溶液作用10 min即可有效杀灭SVA,远低于通常使用浓度,为猪场对SVA病的预防提供了重要的理论依据。0.2%浓度柠檬酸溶液对口蹄疫病毒具有良好的消毒效果,但0.2%、2.0%和5.0%三种浓度柠檬酸溶液对SVA均无明显杀灭作用。研究结果提示,SVA与口蹄疫在发病临床症状极为相似,但病原理化特性差异较大,适合口蹄疫病毒的消毒剂或消毒方法可能并不完全适用于SVA。
百毒杀主要成分是溴化二甲基二癸基烃铵,畜舍、器具消毒推荐使用浓度为0.015%~0.05%。本研究发现,以推荐浓度对SVA进行消毒,效果极其微弱,甚至10倍推荐浓度的百毒杀对SVA作用也不显著。新洁尔灭与百毒杀同属于季铵盐类消毒剂,推荐使用浓度(1∶4稀释,苯扎溴铵含量约0.6%)对SVA杀灭效果也不理想,可见生产中不适合用百毒杀和新洁尔灭对SVA进行消毒。
84消毒液的主要成分是次氯酸钠,是一种常见的含氯消毒剂。研究发现,推荐浓度的84消毒液(有效氯含量700~100 mg/L)对SVA杀灭作用强,浓度低于1∶400以下时,对SVA杀灭效果明显降低;Azad Singh等[8]的研究发现,稀释度为1∶20的漂白粉在10 min~15 min内可杀灭物体表面99%以上的SVA,84消毒液与漂白粉都属于次氯酸盐,说明SVA对次氯酸盐较敏感,临床上可用此类消毒剂杀灭猪场圈舍地面或排泄物中的SVA。
研究发现75%酒精对SVA有一定杀灭作用,但不能瞬间杀灭病毒,作用时间需要60 min以上。酒精易挥发,通常用喷洒或涂擦的方式对物体表面消毒,喷洒或涂擦后浓度难以维持60 min,因此,在实验室内不建议使用75%酒精处理SVA。
紫外线对消毒物品损伤小,且不涉及药物残留及污染的问题,在口蹄疫生产车间常用于空气和操作台表面消毒[10]。本研究发现,SVA经生物安全柜内的紫外线照射30 min,即可被杀灭。此结果提示,在生产中,可以用紫外线照射的方式对物体表面、无菌操作室及空气消毒,以防止SVA的散播。

