经口入路低温等离子切除早期声门型喉癌的中长期随访结果
曾 进 谢华顺 李丽娟 杜 晨 闫 燕 刘仲奇 王 丽
(北京大学第三医院耳鼻咽喉科,北京 100191)
喉癌是头颈部常见的恶性肿瘤之一,鳞癌是最主要的病理类型。喉癌分为声门型、声门上型、声门下型和跨声门型,其中以声门型喉癌最常见。传统经颈部入路手术,患者需要进行气管切开,恢复时间较长,给患者身心带来比较严重的创伤[1]。近年来,经口入路应用低温等离子微创治疗声门型喉癌成为重要方法之一[2]。低温等离子刀是一种高速的离子体,可以通过打断组织的分子键,从而达到组织切割和消融的目的。等离子刀最大的优点是低温,工作温度40~55 ℃,对组织的损伤比较少,而且同时具有切割、止血、冲洗和吸引的功能,是近年来耳鼻喉科逐渐使用的手术器械。2011年9月~2016年1月我科对105例早期声门型喉癌行经口入路低温等离子切除手术,现将中长期随访结果报道如下。
1 临床资料与方法
1.1 一般资料
本组105例,男102例,女3例。年龄42~72岁,中位年龄58岁。主要症状为声音嘶哑102例,咽异物感3例,其他伴随症状包括咽异物感51例,咽痛37例,痰中带血18例。男性患者均有明确的吸烟史;女性患者中1例有吸烟史,2例无吸烟史,职业分别为火柴厂和皮革厂工人。70例门诊取活检,其中24例病理提示轻~中度非典型增生(图1),26例重度非典型增生,20例鳞状细胞癌(图2),活检阳性率为28.6%(20/70),考虑到临床工作中将重度非典型增生划归鳞状细胞癌诊断,阳性率为65.7%(46/70)。所有患者术前均行纤维喉镜、颈部淋巴结B超及颈部增强CT检查。喉镜主要表现为声门菜花样增生,肿瘤质地较脆,容易出血(图3、4)。颈部增强CT检查未见明显淋巴结转移,胸片、腹部B超及骨扫描检查明确无肿瘤的远处转移。根据美国癌症联合会(American Joint Committee on Cancer,AJCC)喉癌的TNM分期,T1期87例(T1a 72例,T1b 15例),T2期18例。
病例选择标准:术前活检病理诊断为鳞状细胞癌;术前活检病理诊断为非典型增生,结合患者吸烟史、内镜下病变表现及声带黏膜波减弱或消失情况,临床考虑喉癌可能性大;T1、T2期声门型喉癌。
1.2 方法
1.2.1 手术设备 可视喉镜(广州振元医药发展有限公司,批文号:粤食药监械准20162220404)或支撑喉镜;低温等离子刀头(Coblator II/7070喉刀头,北京杰西慧中科技有限公司,批文号:京械注准20172251018),以及电刀。
1.2.2 手术方法
气管插管全身麻醉。取仰卧位或去枕过伸位,用牙垫保护好牙齿。支撑喉镜或可视喉镜经口暴露口腔、口咽及会厌,最后暴露喉腔术区。
对于门诊病理结果提示为非典型增生患者(轻~重度),术中送冰冻病理明确有无癌变。明确诊断后将等离子射频消融功率调至5挡,止血功率调至3~5挡,术者左手持吸引器或抓钳,右手持等离子射频刀头进行切除。T1a期病变切除一侧声带,向前达前联合,向后达声带凸表面,向下至声门下0.5 cm处,向外侧至喉室。T1b期病变切除范围为双侧声带切除,重点处理前联合处肿瘤病变。切除前联合肿瘤时,需要向上调整支撑喉镜角度,保证前联合处于开放状态。调整等离子刀头弯度,逐层切除,直至暴露甲状软骨板内侧面软骨膜(术中可见白色解剖标志及骨性碰触感)。T2期切除范围在病变边缘3 mm以上。切除边缘也可以根据组织颜色、质地和出血情况加以判断。一般来说,正常组织在烧灼以后呈灰褐色,质地较韧,一般不容易出血渗血;肿瘤或靠近肿瘤组织边缘,质地较脆,易出血,组织弹性较差。
术中止血方法:对于潜在的固定易出血区域,等离子刀在消融以后,维持刀头位置不变,在原位换为止血档进行止血,即同一位置进行消融、止血操作;如遇创面小的渗血点,单独使用等离子刀止血功能进行烧灼止血,一般3~5 s可起效;如遇小血管活动性出血,等离子刀止血效果欠佳,换用长电刀进行止血。
在拟行手术切除范围边缘取前、后、外、下四点切缘病理,作为手术切除范围。切除后可疑创面取活检,送冰冻病理,保证彻底切除肿瘤病变。
术后不需要做气管切开,患者清醒后即可拔出气管插管,转入病房后给与抗生素及雾化吸入治疗1~3 d,术后声音休息2周。
1.2.3 其他治疗 出现以下几种情况需要进行术后放疗:术后复发,二次微创手术切除;中低分化鳞状细胞癌;切缘提示有肿瘤细胞;前联合病变;术前可疑有N1病变,经过头颈部恶性肿瘤多学科诊治团队会诊以及患者本人意见,术后放疗控制可疑转移灶。术后放疗剂量一般控制在55~60 Gy。
1.3 随访
电话及门诊复查随访。严格要求术后1周,1、3、6、9、12个月进行复查,1年后复查间隔时间定为6个月,部分外地患者9~12个月。纤维喉镜检查第1年每3个月复查1次,第2~5年每6个月复查1次,5年以后每年复查1次。如果出现肉芽肿性增生,门诊取活检明确诊断。颈部超声为6个月复查1次。胸部CT为每年复查1次。
复发:喉内出现新生物,术后病理提示为鳞状细胞癌。转移:颈部淋巴结清扫手术切除病变组织或超声引导下细针穿刺,结果提示为鳞状细胞癌。
1.4 统计学处理
采用SPSS22.0统计软件绘制Kaplan-Meier曲线。
2 结果
均未进行前置气管切开手术,均在内镜下行低温等离子肿瘤切除手术,未发生气道爆燃或气道黏膜灼伤等医疗不良事件。术中出血量(手术记录单)中位数为7 ml(1~20 ml)。术后未出现呼吸困难及二次出血,均未输血治疗。术后第2天均可经口进食水。2例术后发热及肺部感染,抗生素治疗5~7 d后复查胸片,肺部感染控制后出院。6例术后出现声带粘连,主要表现为声音嘶哑,无明显喉梗阻症状,不影响患者生活质量。2例术后出现颈前皮下气肿,3 cm×3 cm以内,术后3 d皮下气肿逐步消退。术后病理均为喉部鳞状细胞癌(图5),其中高分化71例(67.6%),中高分化14例(13.3%),中分化11例(10.5%),中低分化6例(5.7%),低分化3例(2.9%);切缘均为阴性。术后住院1~4 d,平均2.1 d。
98例术后中位随访时间61.8月(14~100个月),其中64例随访>5年,见图6、7。18例进行术后放疗,放疗剂量为55~60 Gy,其中2例出现肿瘤复发,后行全喉切除手术,1例死亡。11例发生喉腔局部肿瘤复发(术后15~32个月复发,中位复发时间20个月),1、2、3年累积复发率分别为0%、9.2%、11.2%(图8)。5例发生颈部淋巴结转移(术后17~29个月转移,中位转移时间23个月),1、2、3年累积转移率分别为0%、3.1%、5.1%(图9)。喉内局部复发病变全部进行二次手术切除,其中3例行颈部入路部分喉或全喉切除手术。4例第1次手术治疗后1~3年颈部淋巴结转移,其中3例初诊时为T1 病变,1例为T2病变,初次手术后均未行术后放疗,颈部淋巴结均出现在Ⅲ、Ⅳ区,与颈总动脉或颈外动脉粘连较为紧密;1例术后进行放疗,放疗后发生颈部淋巴结转移。17例死亡,其中10例死于喉癌复发与转移,5例死于肺癌(考虑为多重癌),2例死于心脑血管疾病。98例Kaplan-Meier生存曲线见图10,1、3、5年累积生存率分别为100.0%、91.4%、83.8%。
3 讨论
声门型喉癌的主要症状为声音嘶哑,由于纤维喉镜技术的普遍应用,在确诊时大多数为早期病变。因为喉解剖结构的保护作用和声门区淋巴分布较少,所以声门型喉癌较少发生颈部淋巴结转移[3]。目前,治疗声门型喉癌的主要方法包括放疗,开放手术和激光手术。放疗对于患者声音质量的保护作用比较明显,治疗周期较长,部分患者放疗反应较重,少数患者甚至会引发呼吸困难。传统开放手术包括喉裂开声带部分切除或部分喉切除,由于短时间内影响呼吸、吞咽和发声功能,患者需要接受气管切开术,术后恢复时间大约2周,给患者带来比较明显的身体及心理打击。CO2激光手术是近些年来比较流行的微创手术方式,优点包括精准切除,患者不需要进行气管切开手术,术后恢复时间短,已经成为声门型喉癌的重要治疗方法之一。CO2激光也有一定的局限性:激光设备较为昂贵,临床推广受到限制;直线切割对于靠近前联合部位的病变很难做到彻底切除;激光切割时温度较高,遇到氧气容易引发气道爆燃或灼伤,需要使用混合空气对患者进行辅助呼吸;另外,激光切割时容易导致烟雾形成,一方面遮挡视线,另外一方面容易导致肿瘤细胞种植[4~7]。低温等离子是一种新的手术设备,优点在于将切割、凝血、创面冲洗和吸引4个功能集成为一体,方便在咽喉腔的狭窄空间内进行操作,但是喉癌治疗的长期临床效果尚缺乏长期的随访研究。
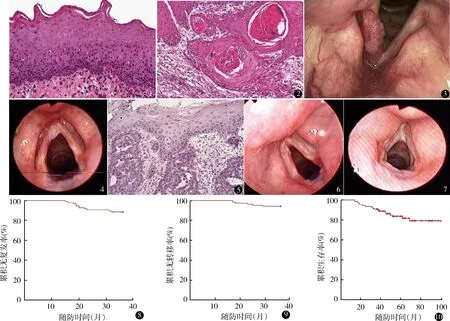
图1 上皮细胞呈轻度异型性,主要位于上皮层下1/3,未累及基底膜,诊断为轻度非典型增生(HE染色 ×200) 图2 细胞呈明显异型性,细胞核深染,可见较多核分裂像和角化珠形成(HE染色 ×100) 图3 喉镜下见右侧声带外生型新生物,表面欠光滑,向前接近前联合,向后至声带突,外侧紧邻喉室,声门下未见肿瘤累及,双侧声带运动好 图4 喉镜下见左侧声带前部靠近前联合处新生物,表面欠光滑呈细颗粒样,声门下未见肿瘤累及,双侧声带运动好,声带闭合有隙 图5 明显细胞异型性,细胞核深染,可见核分裂像,没有明显的角化物或者角化珠形成,诊断为喉非角化型鳞状细胞癌(HE染色 ×100) 图6 术后随访3年,喉镜下见双侧声带黏膜光滑,运动好,声带闭合无隙,肿瘤无复发及转移 图7 术后随访5年,喉镜下见双侧声带黏膜光滑,前联合可见白色瘢痕粘连 图8 98例复发情况Kaplan-Meier曲线 图9 98例转移情况Kaplan-Meier曲线 图10 98例Kaplan-Meier生存曲线
本组门诊活检阳性率不高,主要原因是患者在局麻条件下行纤维喉镜取活检术,声带随呼吸运动而摆动,检查者难以在正常组织和病变组织交界处准确取材,且喉镜钳容量小,导致取材部位较为表浅,一部分病例可能无法显示上皮层基底膜是否被破坏。临床上将重度非典型增生纳入鳞状细胞癌诊断,需要术中冰冻病理及术后石蜡病理明确诊断。对于轻~中度非典型增生,临床上还可以借助频闪喉镜观察声带黏膜波减弱或消失,以及窄带成像判断其良恶性倾向[1]。
与激光手术相比,等离子刀头工作温度较低,对组织的热损伤较小。因为同时具有切割和凝血功能,术者可以在可能出血较多的部位进行预凝血,即切割后不挪动刀头,原位置进行凝血操作,大大减少术腔出血风险[8,9]。由于低温无碳化的切割消融和生理盐水持续冲洗,使术野很清晰,便于术者观察组织层次。如果是较大血管出血,可以使用电极、电凝进行止血。由于不需要进行气管切开,术后住院1~2 d即可出院,缩短患者住院时间,减少住院费用。等离子刀头切割精细程度较差,容易切除过多正常组织,在手术过程中对安全缘的判断不如激光精确。
本组2例术后出现肺部感染,术后抗生素治疗后痊愈。2例均>70岁,术前胸片未见明显异常,我们推测肺部感染与患者长期吸烟,全麻插管以及少量等离子刀头冲洗的生理盐水进入肺部有关。因此,对于高龄患者,术中要维持气管插管套囊内压力,保证套囊与气管壁之间无缝隙。另外,可以在喉腔内放置1根负压吸引管,及时吸除冲洗的生理盐水,最大限度降低肺部感染的发生率。声带粘连是术后常见的并发症,特别是双侧声带病变或者靠近前联合病变时术后容易出现瘢痕[9,10]。皮下气肿发生率比较低,本组2例均为处理前联合甲状软骨板后出现,可能与前联合部位操作较多,切除深度较大有关。与激光手术相比,等离子手术没有气道爆燃的风险,不需要在术中使用混合空气,便于控制高龄患者或肺功能较差患者的术中血氧饱和度[8]。
98例中位随访时间61.8月,其中11例发生喉腔局部肿瘤复发,5例发生颈部淋巴结转移,与目前的文献[8]报道基本一致。喉腔内复发主要与切缘阳性、术前T分期、病变部位以及术后是否戒烟有密切关系[7,11]。本组11例喉腔局部复发中,6例术后持续吸烟,5例肿瘤累及前联合处导致手术安全缘不能达到3 mm。18例术后放疗,其中2例肿瘤复发,后行全喉切除手术,1例死亡。早期声门型喉癌病变累及前联合或声带活动减弱者,术后可以进行预防性放疗,在一定程度上降低肿瘤复发几率。因此,术后戒烟、累及前联合早期肿瘤选择开放手术或术后放疗,是降低喉腔局部复发率的重要方法。目前认为声门型喉癌术前无颈部淋巴结转移证据,不推荐进行颈部淋巴结清扫手术[1],但是患者在复查时,除进行纤维喉镜检查,还需要进行规律的颈部超声检查,以便早期发现转移灶。因为喉癌患者大多数有吸烟史,因此,需要每年进行肺部CT检查,以便肺癌的早期筛查。本组5年累积生存率83.8%,传统切除手术5年生存率81%[12],可见,经口入路低温等离子切除治疗早期声门型喉癌中长期临床效果与传统手术疗效相当。
综上所述,低温等离子刀具有切割、凝血、创面冲洗和吸引的功能,便于在咽喉腔进行手术操作,可根据手术需要弯曲成不同角度,在内镜引导下可以切除某些直视下不容易观察的区域,特别是前联合部位的肿瘤;等离子刀头可进行“接触式切割”,可以使术者保持对切除精度的合理把控。因此,经口入路低温等离子切除术为早期声门型喉癌的治疗提供一种新的可靠的方法[13]。

