一级亲属伴有代谢异常疾病的PCOS患者易感基因研究
林 琳,李明明,肖 兵,穆巴热科·阿迪力,肖金宝
(1.新疆医科大学第一附属医院妇科,乌鲁木齐 830011;2.新疆乌鲁木齐市经济技术开发区(头屯河区)第一人民医院妇产科,乌鲁木齐 830023)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是伴有生育障碍并以肥胖、排卵障碍、月经及内分泌紊乱为主要临床表现的一类综合征,是一种内分泌代谢疾病,发病率占全球育龄期女性的5%~11%[1-3]。根据调查,PCOS患者在中国不孕人群中所占比例高达约70%~76%,是无排卵性不孕症的主要病因之一[4]。PCOS不仅影响患者的生育能力,其伴随的脂类代谢异常、2型糖尿病、高雄激素血症等临床症状威胁着女性生命健康[2-3]。PCOS的发病机制较为复杂,通常与环境、遗传及激素等因素有关。遗传学因素在PCOS的发生中起着十分重要的作用[2]。因此,研究PCOS的遗传学病因有助于进一步了解PCOS的发病机制。本研究以一级亲属患有代谢性疾病的PCOS患者和健康对照组作为研究对象,用基因单核苷酸多态性(single nucleotide polymorphism,SNP)芯片技术检测基因组SNP位点基因多态性,旨在高通量水平筛选PCOS易感基因,探讨其基因多态性与PCOS之间的相关性。
1 材料与方法
1.1 研究对象 根据2018年多囊卵巢综合征中国治疗指南,收集2018年1月至2019年12月就诊于新疆医科大学第一附属医院的289例PCOS患者,以及年龄、体重相匹配的289例健康妇女为对照。PCOS诊断标准:月经稀发、闭经或不规则阴道出血,同时符合以下2项中的1项:(1)高雄激素临床表现或高雄激素血症;(2)超声影像显示为卵巢多囊样表现,并排除其他引起高雄激素与排卵异常的疾病。健康对照组纳入标准:年龄、体重相配,月经规律,一级亲属患有代谢性疾病(如高血压、糖尿病、冠心病等)的健康育龄期女性。选取其中随访的病史中一级亲属患有代谢异常性疾病的35例PCOS患者和41例健康人群作为研究对象。本研究获得医院伦理委员会批准,入选患者均签署知情同意书。
1.2 一般资料收集 收集PCOS患者及健康对照组的相关临床资料,包括年龄、体重、身高、空腹血糖、空腹胰岛素、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、卵泡刺激素(FSH)、雄激素(T)、黄体生成素(LH)、抗苗勒氏管激素(AMH),计算体质量指数(body mass index,BMI)、胰岛素抵抗指数(homeostasismodel assessment insulin resistance index,HOMA-IR)。
1.3 仪器及试剂
1.3.1 实验仪器 全自动核酸提取仪(康为CWE9600),NanoDrop 2000紫外分光光度仪(美国NanoDrop公司),BIO-RAD电泳仪(美国BIO-RAD公司),Newbio Gi-1凝胶成像仪。
1.3.2 实验试剂 康为世纪血片DNA提取试剂盒(康为世纪,CW2557S),BeadChip Array Infinium Asian Screening Array-24 V1.0(美国illumina,20022508)。
1.4 实验方法
1.4.1 基因组DNA提取及质检 使用康为世纪血片DNA提取试剂盒磁珠法提取基因组DNA,NanoDrop 2000紫外分光光度仪进行DNA浓度测定,凝胶电泳法观察DNA纯度和完整性。
1.4.2 芯片检测 illumina芯片操作流程用BeadChip Array Infinium Asian Screening Array-24 V1.0检测样本基因型。
1.4.3 候选易感基因和SNP位点的确定 差异位点进行annovar注释,找出差异位点所在基因和对应的rs号。用DAVID(the Database for Annotation,Visualization and Integrated Discovery)在线软件对差异SNP位点注释到的基因进行KEGG pathway富集分析。根据富集倍数,P值及富集到的基因数,再结合参考文献选择Rap1信号通路,用STRING软件对富集到Rap1信号通路的基因进行蛋白互作网络(protein protein interaction network,PPI network)分析,筛选关键节点基因(至少与4个蛋白有相互作用),用dbSNP数据库查询关键节点基因上的差异SNP位点相关信息及MAF值,MAF值在0.15~0.4之间的SNP位点为候选易感SNP位点,其中剔除基因分型数据缺失的SNP位点和位于基因间区域的SNP位点。
1.5 统计学处理 采用SPSS20.0软件,符合正态分布的资料采用t检验,不符合正态分布的用非参数秩和检验,芯片SNP位点差异筛选用卡方检验。用SNPStats在线分析软件进行Hardy-Weinberg平衡检验及SNP位点logistic回归分析。用卡方检验分析SNP位点不同等位基因在PCOS组与正常对照组中的分布及优势比估计。
2 结 果
2.1 PCOS组与对照组的临床资料 PCOS组的空腹胰岛素水平、胰岛素抵抗指数、高密度脂蛋白水平、雄激素水平、黄体生成素水平、抗苗勒氏管激素水平高于对照组(P<0.05),PCOS组的平均年龄及低密度脂蛋白水平低于对照组(P<0.01),见表1。

表1 PCOS组与对照组的临床资料(均值±标准差)
2.2 芯片检测结果及PCOS组与健康对照组差异SNP位点的筛选 对76例样本进行SNP芯片检测,总检测位点637326个,其中PCOS患者和健康对照组比较,有差异的SNP位点1141个(P≤0.001),其中有差异的SNP位点最多的染色体为1号染色体(chr1),总共有114个差异SNP位点,占总差异SNP位点10%,差异SNP位点最少的为21号染色体(chr21),总共有13个差异SNP位点,占总差异SNP位点的1.14%。差异位点进行annovar注释,总注释到1195个基因。
2.3 差异SNP位点注释到的基因KEGG pathway富集分析及PPI分析 DAVID在线软件对差异SNP位点注释到的1195个基因进行KEGG pathway富集分析,结果总富集到23个信号通路,富集到的基因数(Count)前10的(P≤0.05)信号通路分别是癌症信号通路(Pathways in cancer),神经活性配体-受体交互作用信号通路(Neuroactive ligand-receptor interaction),cAMP信号通路,钙离子信号通路,Rap1信号通路等(图1)。用string在线软件对Rap1信号通路中的19个基因进行PPI分析,筛选出来8个关键节点基因(至少与4个蛋白有相互作用),分别是INSR、GNAO1、PIK3CD、FGF13,KDR、VEGFC、PLCB4、ANGPT1等(图2)。对这8个基因上的差异SNP位点进行筛选,最后确定的易感基因GNAO1、PIK3CD、FGF13。易感基因GNAO1上的SNP位点rs2587885;PIK3CD上的SNP位点rs6541017,FGF13上的SNP位点rs527687、rs683357和rs7060413,见表2。
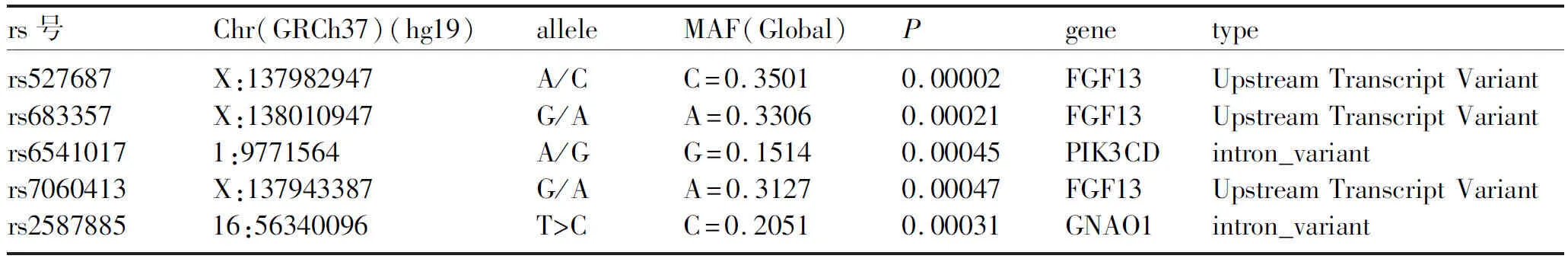
表2 易感基因及差异SNP位点信息

图1 差异SNP位点注释到的基因KEGG分析TOP10信号通路纵坐标为信号通路名称,横坐标为富集倍数(红色),基因数量(count,蓝色)及-log P值(绿色)

图2 RAP1信号通路基因PPI分析
2.4 SNP位点不同等位基因在PCOS组与正常对照组中的分布及优势比估计 分别计算5个SNP位点在76个样本中的不同基因型频率,PCOS组和对照组基因型分布Hardy-Weinberg平衡检验结果显示所有位点均符合Hardy-Weinberg平衡规律(HWp值>0.05)。见表3。5个SNP位点不同等位基因在对照组与PCOS组中的分布有统计学差异,rs527687位点A等位基因、rs683357位点G等位基因、rs6541017位点A等位基因、rs2587885位点C等位基因、rs7060413位点G等位基因在PCOS组中的频率显著低于对照组,在PCOS组中是保护因素。见表4。

表3 5个SNP位点基因型分布Hardy-Weinberg平衡检验

表4 SNP位点不同等位基因在PCOS组与正常对照组中的分布及优势比估计
2.5 各SNP位点不同基因型与PCOS的发病风险logistic回归分析 按3种遗传模型(共显性模型、显性模型、隐性模型)进行按年龄和BMI值校正后的logistic回归分析,观察不同遗传模型中不同基因型与PCOS发病风险的相关性,FGF13基因rs527687位点在共显性模型、显性模型、隐性模型下不同基因型分布差异有统计学意义(P<0.05)。见表5。该位点在共显性模型、显性模型、隐性模型下均与PCOS发生有关。在共显性模型中相对于AA基因型,CA基因型和CC基因型是PCOS的危险因素。在显性模型中,C/A-C/C基因型是PCOS的危险因素。在隐性模型中CC基因型是PCOS的危险因素。

表5 各SNP位点logistic回归分析(按年龄和BMI值校正)
FGF13基因rs683357位点在共显性模型、显性模型、隐性模型下不同基因型分布差异有统计学意义(P<0.05)。该位点在共显性模型、显性模型下均与PCOS的发生有关。在共显性模型中相对于GG基因型,GA基因型是PCOS的危险因素。在显性模型中相对于GG基因型,A/G-A/A基因型是PCOS的危险因素。FGF13基因rs7060413位点在共显性模型、显性模型、隐性模型下不同基因型分布差异有统计学意义(P<0.05)。该位点在显性模型中与PCOS的发病有关,A/G-A/A基因型是PCOS危险因素。PIK3CD基因rs6541017位点在共显性模型、显性模型、隐性模型下不同基因型分布差异有统计学意义(P<0.05)。该位点在在显性模型中跟PCOS的发病有关联性,在显性模型中GA-GG基因型是PCOS危险因素。GNAO1基因rs2587885位点在显性模型不同基因型分布差异有统计学意义(P<0.05)。该位点在在显性模型模型中与PCOS的发生有关,T/C-T/T基因型是PCOS危险因素。
3 讨 论
PCOS的发病机制较为复杂,通常与环境、遗传及激素等因素有关。PCOS存在家族聚集现象,遗传学因素在PCOS的发生中起着十分重要的作用[2]。因此,研究PCOS的遗传学病因有助于进一步了解PCOS的发病机制。本研究结果发现,一级亲属患有代谢性疾病的健康人群平均年龄较PCOS组高。
选取一级亲属有代谢性疾病的PCOS患者和健康对照组作为研究对象,用美国illumina Infinium Asian Screening Array SNP芯片检测患者和对照组基因组基因多态性。总检测到的SNP位点637326个,其中PCOS患者和健康组比较有差异的SNP位点1141个,差异SNP位点集中富集到1号染色体上,这表明位于1号染色体上的基因单核苷酸多态性与PCOS的相关性可能高于其他染色体基因。随后筛选PCOS相关的易感基因和SNP位点,先对差异位点进行annovar注释,总注释到1195个基因。下一步用DAVID在线软件对差异SNP位点注释到的1195个基因进行KEGG pathway富集分析,富集到的基因数(Count)前5的信号通路分别是癌症信号通路(pathways in cancer),神经活性配体-受体交互作用信号通路(neuroactive ligand-receptor interaction),cAMP信号通路(cAMP signaling pathway),钙离子信号通路(calcium signaling pathway),Rap1信号通路等。PCOS患者MⅠ期和MⅡ期卵丘细胞转录组学研究中差异表达基因KEGG pathway分析结果显示,PCOS患者MⅠ期和MⅡ期卵丘细胞差异表达基因也注释到神经活性配体-受体交互作用信号通路和钙离子信号通路[14-15]。另外一项关于PCOS的表达谱数据二次分析的研究报道,与对照组比较,在PCOS中差异表达基因富集到神经活性配体-受体交互作用信号通路和cAMP信号通路[16]。通过查询参考文献发现Rap1信号通路中有注释到跟PCOS相关的INSR、FGF13[6]、VEGFC[11]等基因。Li等[5]通过PCOS动物模型研究PCOS相关性miRNA时也发现PCOS差异表达miRNA靶基因也注释到Rap1信号通路。这表明神经活性配体-受体交互作用信号通路、cAMP信号通路、钙离子信号通路、Rap1信号通路基因在表达水平和单核苷酸多态性方面都与PCOS有一定的相关性,有望成为PCOS诊治靶点。通过查询KEGG数据库发现,Rap1信号通路(Entry ID:map04015)与cAMP信号通路和钙离子信号通路具有相互调控关系,cAMP信号通路(Entry ID:map04015)和钙离子信号通路都参与调控Rap1信号通路的激活。因此本研究中先选择偏下游的Rap1信号通路进行进一步分析。
本研究用string在线软件对富集到Rap1信号通路的FGFR2、PRKCZ、MAGI3、PARD3、ADCY2、GNAO1、PIK3CD、GRIN2A、FGF13、APBB1IP、KDR、DOCK4、VEGFC、PLCB4、P2RY1、RAPGEF4、ANGPT1、INSR、F2R等基因进行PPI分析,筛选出来8个关键节点基因INSR、GNAO1、PIK3CD、FGF13、KDR、VEGFC、PLCB4、ANGPT1。用dbSNP数据库查询这8个基因上的差异SNP位点基因组位置、MAF值、突变类型等相关信息,为排除假阳性,选出频率较小的等位基因MAF值在0.15~0.4之间的SNP位点为候选易感SNP位点,其中剔除基因分型数据缺失的SNP位点和位于基因间区域的SNP位点。最后确定的易感基因GNAO1、PIK3CD、FGF13,易感基因GNAO1上的SNP位点rs2587885,PIK3CD上的SNP位点rs6541017,FGF13上的SNP位点rs527687、rs683357和rs7060413为易感SNP位点。
成纤维细胞生长因子13(fibroblast growth factors 13,FGF13)属于纤维细胞生长因子(FGF)家族,该家族由18种分泌蛋白和4种细胞内蛋白(FGF11-14)组成,参与调节卵巢功能和卵泡发育。如FGF2促进颗粒细胞增殖并影响卵巢甾体生成。此外,FGF18参与卵巢颗粒细胞的凋亡。FGF13在小鼠卵巢的表达早在1997年就有报道,在牛窦卵泡的黄体、膜和颗粒细胞中也检测到FGF13的mRNA表达。此外,在牛卵巢腔卵泡发育过程中,卵巢膜细胞中FGF13 mRNA表达上调。Liu等[6]研究发现,FGF13可能参与了PCOS的病理生理过程。但是目前没有FGF13基因多态性与PCOS的相关性研究。本研究结果显示,FGF13基因SNP位点rs527687、rs683357和rs7060413基因多态性与PCOS相关。
磷脂酰肌醇-4,5-二磷酸3激酶催化亚基delta(PIK3CD)属于磷酸肌醇3激酶(PI3Ks)家族基因,磷脂酰肌醇3-激酶(PI3Ks)蛋白家族参与细胞增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节。PCOS是一种复杂的内分泌疾病,其与内分泌紊乱、雄激素过多、不孕、IR、肥胖和糖代谢紊乱有关。随着对PCOS的研究越来越多,学者们开始关注PCOS与PI3K-Akt信号通路的关系,发现PI3K-Akt信号通路与胰岛素抵抗、雄激素分泌、肥胖、卵泡发育等都相关[10]。张慧英等[9]研究表明,PCOS患者子宫内膜中PI3K/Akt通路过度激活,可能与PCOS患者子宫内膜增生和癌变有关。胰岛素抵抗和肥胖可能是PCOS子宫内膜PI3K/Akt通路过度激活的高危因素。Zhao等[8]研究发现,荷芪散通过PI3K/Akt通路达到治疗PCOS的作用。这表明PI3K/Akt通路在PCOS发生发展中起重要作用。本研究发现,PIK3CD基因多态性位点rs6541017在隐性遗传模型中G/A-G/G基因型相对于AA基因型,是PCOS的危险因素,可能与PCOS的发病风险有关。
GNAO1基因编码的蛋白代表氧化石墨烯异三聚体g蛋白信号转导复合物的亚基。该基因的缺陷是早期发作癫痫性脑病的原因之一。虽然目前尚无文献报道GNAO1基因与PCOS有关,但是通过signor2.0数据库查询得知,GNAO1上调TAOK1表达水平,而TAOK1通过PI3K-Akt信号通路和MAPK信号通路调控细胞凋亡和炎症因子释放[12]。相关研究报道,在运动障碍疾病中GNAO1通过参与PI3K信号通路的激活而发挥作用[13]。这表明,GNAO1可能是PCOS易感基因之一。本研究结果显示,GNAO1多态性位点rs2587885在显性模型中T/C-T/T基因型在PCOS中是危险因素,与PCOS发病风险有关。
综上所述,单核苷酸多态性与一级亲属有代谢性疾病的PCOS具有相关性的基因主要富集到神经活性配体-受体交互作用信号通路、cAMP信号通路、钙离子信号通路、Rap1信号通路,其中Rap1信号通路中的GNAO1、PIK3CD、FGF13基因可能是一级亲属有代谢性疾病的PCOS患者易感基因,rs2587885,rs6541017,rs527687、rs683357和rs7060413为一级亲属有代谢性疾病的PCOS患者易感SNP位点。本研究在基因单核苷酸多态性水平进一步明确PCOS相关的信号通路,易感基因和易感SNP位点,但其具体作用机制需进一步深入研究。

