Excel 在化学动力学教学中的应用
鲍 霞,汪雪梅,张晓艳
(淮南师范学院 化学与材料工程学院,安徽 淮南 232038)
化学动力学是研究化学反应速率和反应机理的化学分支学科,通过化学动力学的研究,可以知道如何控制反应条件,提高主反应的速率,增加产品产量,抑制副反应的速率,减少原料消耗,减少副产物,提高纯度,提高产品质量,所以,化学动力学的研究有理论与实践上的重大意义[1]。 化学动力学涉及到的公式多、形式复杂,无论是计算速率常数,还是确定反应级数,都涉及到复杂运算,手工计算工作量大,很多数据计算采取近似处理,结果不够准确, 学生对这些近似处理方法的理解停留在表面,对所学内容理解不够深刻。 计算机技术的进步使很多计算简化,而把数据转化为图像,给学生形象化展示数据变化规律,更有助于加深学生对知识的理解。 因此,引入计算软件到化学动力学的课堂教学中就有着重要的意义。 目前,在解决化学动力学计算方面涌现出了很多新方法。 利用DynaFit、Tenua、Materials Studio、Visual Basic 和 Matlab 等软件进行计算[2-6],可以解决复杂的动力学计算,但需要学生具有一定的编程能力,具有较高的计算机应用水平。 Excel 是office 软件的一个重要组成部分, 它拥有丰富的数据处理函数和绘制图表功能,运算快速准确,广泛应用于管理、统计分析、金融、工程计算等众多领域。 Excel 无需编程,界面友好,计算过程简单, 能够直观地展示计算过程和方法,在教学举例中具有很好的适用性[8-9]。本文就 Excel在化学动力学计算方面的应用进行实例探讨。
1 快速求反应的活化能和指前因子
《无机化学》在讨论温度对反应速度的影响时,有个经典例题,根据一组数据(5 个不同温度时的反应速率常数),求反应的活化能Ea、指前因子A及566K 时反应速率常数k。 目前的教材和相关习题在处理这类问题时,一般用计算法,取两组数据进行计算,教材[10]例 4-2 取 576K 和 781K 的 2 组数据进行计算,得到活化能Ea=168.3kJ/mol,进而得指前因子 A=2.4×1011mol-1·dm3·s-1,再将 566K 代入求得此时反应速率常数 k=7.1×10-5mol-1·dm3·s-1。此种方法,事实上只用了2 个温度的数据,没有考虑其他数据,误差较大;如果取不同的温度进行计算,结果也不相同。传统手工作图,虽然将所有实验数据都纳入考查范围,但不宜求得斜率和截距。
利用Excel, 可以轻松求得上述数据, 方便快捷, 结果准确。 根据阿伦尼乌斯公式对数形式可知 lnk 与 1/T 有线性关系,直线的斜率为,截距为lnA。 具体操作如下:
第1 步:我们将实验数据输入A2:B6 单元格。
第 2 步:在 C 列求出 1/T ,D 列求出 lnk(见图1)。
第3 步:利用SLOPE 函 数 求 出 直 线 斜率。SLOPE 函数:返回根据 known_y's 和 known_x's 中的数据点拟合的线性回归直线的斜率。 语法:SLOPE(known_y's,known_x's)。 此例 Known_y's 为 lnk,也就是 D2:D6 单元格的数据;Known_x's 为 1/T ,也就是C2:C6 单元格的数据。
第4 步: 利用INTERCEPT 函数求出直线截距。 INTERCEPT 函数:返回函数图形与Y 轴交点到原点距离。 语法:INTERCEPT (known_y's,known_x's),函数参数和前面函数一致。此例参数为(D2:D6,C2:C6)。
第6 步:求出任意温度的反应速率常数。 已知直线斜率和截距,根据公式(1),可得k=e^(G1/G6+G2),G1/G6 为斜率/温度 T。
第7 步:G2 为直线截距。将需要求的温度数据填入G6 单元格,在G7 单元格中建立公式【=e^(G1/G6+G2)】,随即就可求出相应温度的反应速率常数k。
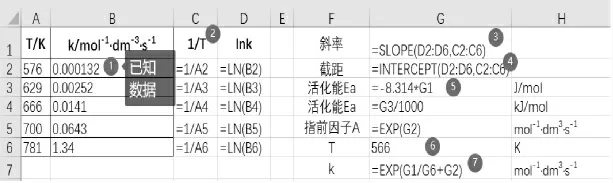
图1 求算活化能和指前因子数据输入
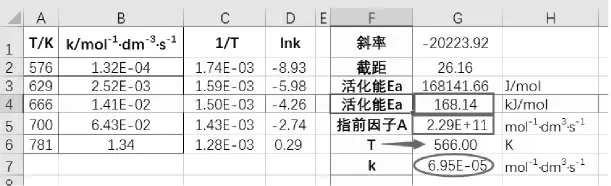
图2 求算活化能和指前因子数据输出
如果用在学生实验,可以轻松考查不同学生做出的数据,还可利用CORREL 函数,给出数据的相关系数[=CORREL(D2:D6,C2:C6)],本例相关系数为-0.999 95,其绝对值非常接近1,相关性很好。
2 求解反应速率方程和反应级数
反应速率方程是化学动力学部分的重要内容,反应aA+bB=gG+hH 某一时刻的瞬时速率r 与反应物浓度之间符合如下关系式:r=kc(A)mc(B)n,此式称为反应的速率方程, 式中k 称为反应速率常数,该反应的反应级数为:m+n。
教材根据下表实验数据 (B3:D8), 建立反应2NO+2H2=2H2O+N2的速率方程, 根据公式r=kc(A)mc(B)n,上述反应的速率方程可以表示为:

在教学中,我们经常是通过改变其中一种反应组分浓度,固定其他反应物浓度,通过观察或单变量作图,求出某反应组分的级数;接着再改变另一种反应组分浓度,固定其他组分,求出这种反应组分的级数。 操作复杂,计算繁琐。
将上述速率方程(2)两边取对数得lgr = m lgc

利用Excel 的数据分析工具中的多元回归,可轻松求出各个不同反应物对反应瞬时速率的影响,给出速率方程。 操作如下:
第1 步:输入原始数据。 将数据输入Excel 的B、C、D 列。
第2 步:计算对数值。 再将B3:D8 区域数据取对数放到F3:H8 区域(见图3)。
第3 步:调用分析数据库。
①点击左上角的选项按钮,然后点击“Excel 选项”,在“Excel 选项”界面中,选择左侧的“加载项”,然后点击“转到”按钮。②勾选“分析数据库”。③选择Excel 主界面上方的“数据”选项,然后点击“数据分析”。④在分析数据库中选择“回归”分析选项,然后点击“确定”按钮(见图4)。⑤设置参数。输入:Y 值输入区域:$H$3:$H$8,X 值输入区域:$F$3:$G$8;置信度:可选择默认的95%;输出选项:可选择新工作表,为了便于对照比较,选择本表的空白区域,左上角起始单元格为A10 单元格,设置输出区域:$A$10(见图5)。⑥点击确定后,结果输出。⑦关于 lgr 与 lgc(NO)、lgc(H2)的多元回归分析完成(见图6)。

图3 求解反应速率方程数据输入

图4 调用数据分析工具
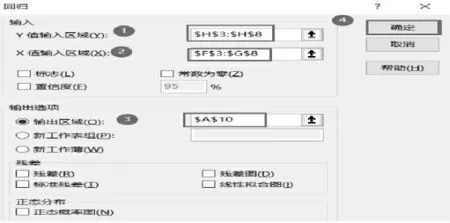
图5 回归分析参数设置

图6 回归分析结果输出
图6 中最后部分是“回归参数表”:B26:B28 为线性方程的截距和x1、x2的系数, 据此可得出估算的回归方程为:y=2.034 7x1+0.960 1x2+4.912 0
对应方程lgr=mlgc(NO)+nlgc(H2) +lgk 可知:m=2.034 7≈2,n=0.960 1≈1,lgk=4.91 20
由于 lgk=4.912 0, 所以,k=10b=8.17×104dm6·mol-2·s-1
重要的是图6 中的E26-E28, P-value 为回归系数t 统计量的P 值。通过观察发现本例中的此数值, 即t 统计量的P 值均远小于显著性水平0.05,因此,均与y 显著相关。
通过上述计算, 可得该反应的速率方程为:r=kc(NO)2c(H2)= 8.17×104*c(NO)2c(H2)
此反应对反应物NO 为2 级反应,对反应物H2为1 级反应,反应总级数为3。
3 考查温度对反应速率常数的影响
第1 步:在A1 到A3 单元格分别输入“活化能Ea”、活化能数值(本例输入 168.3)、“kJ/mol”。
第2 步:在A4 到A6 单元格分别输入“指前因子 A”、指前因子数值(本例输入 2.40E+11)、“mol-1·dm3·s-1”。
第 3 步:在 B1 单元格输入“T (K)”,B2 单元格输入起始温度(本例输入500),在B3 单元格输入公式“=B2+10”(根据不同情况,可以输入不同温度间隔,本例相邻温度相差为10K,k2=k1+10),利用填充柄,向下输入到需要的数值,本例填充到B32(800K)。
第 4 步:在 C1 单元格输入“lgk”,C2 单元格输入公式 “=-A$2*1000/(2.303*8.314*B2)+LOG10(A$5)”, 注意公式中A2 和A5 单元格引用要用绝对引用,利用填充柄,向下输入到需要的数值。
第5 步:计算反应速率常数k,在D1 单元格输入“k”,在 D2 单元格输入公式“=10^C2”,利用填充柄,向下输入到需要的数值。
第6 步: 计算相邻单元格反应速率常数比值,在 E2 单元格输入“k2/k1”,在 E2 单元格输入公式“=D3/D2”(见图7 和图8)。

图7 温度对反应速率常数的影响数据输入
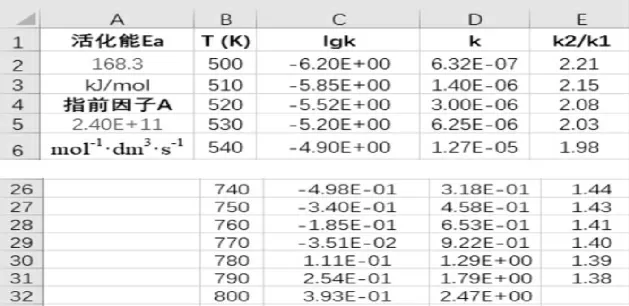
图8 温度对反应速率常数的影响数据输出
第 7 步:选中 B、D、E 列,选择“插入”功能区中的“散点图”。
第8 步:设置坐标轴格式,横坐标刻度最小值500,最大值 800。
第9 步:用鼠标右键点选系列2(k2/k1)数据线,在弹出的选项卡里选择“设置数据系列格式”,选择“系列选项”中的系列绘制在“次坐标轴”。
教材中只利用数据计算2 个温度区间的速率常数值,虽然得出结论:对于同一反应,在低温区段升高10K 时,速率常数k 增大的倍数较大;而在高温区段,速率常数k 增大的倍数较小。 学生对速率常数变化规律没有深刻认识,我们用Excel 计算可以轻松得到一系列温度对应的速率常数k 值,可清晰看出,随着温度升高,k2/k1的值是逐渐减低的,我们还可以将数据用双Y 图显示出来, 从图示可看出,虽然低温段升高10K,速率常数变化值(k2/k1)较大, 但速率常数的绝对数值却很小, 温度在700K以上,反应速率常数才迅速增加(见图9)。

图9 温度对反应速率常数的影响
4 结语
将 Excel 软件应用于化学动力学教学中,不需要编程,计算简便、快速、准确,使学生摆脱繁琐的手工计算,提高了学生解决复杂问题的能力,增强了学生的计算机应用能力, 提升了学生学习兴趣,加深了对知识的理解。

