山莨菪碱对小鼠流感病毒性肺损伤的保护作用及机制研究*
唐 虹,杨 洋,刘 晓
(四川省绵阳市中心医院儿科,绵阳 621000)
流感是一种在全球流行的具有高度传染性的急性呼吸道疾病,其发病率和死亡率较高[1-2]。流感病毒极易发生变异,以至于人类机体很难对其产生免疫力[3]。由于西药的大量使用,流感病毒也容易产生耐药性[4]。因此,寻找新的高效药物对流感的治疗具有重要意义。山莨菪碱常用来治疗小儿肺炎,并且其效果也得到临床上的肯定[5]。但是山莨菪碱对流感病毒引起的肺炎损伤是否具有保护作用尚且未知。本研究以流感病毒甲型鼠肺适应株(FM1)滴鼻感染小鼠建立病毒性肺炎模型,探讨山莨菪碱对小鼠肺组织中氧化应激及炎性损伤的影响,揭示其作用机制与Toll样受体3(Toll-like receptors,TLR3)/TRIF3 信号通路的关系,为山莨菪碱用于治疗流感肺损伤提供实验依据。
1 材料与方法
1.1 实验动物 60 只SPF 级BALB/C 裸鼠,体重18~20 g,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2016-0002。动物实验和处置遵守实验动物管理和伦理委员会章程。
1.2 药物与主要试剂 山莨菪碱(货号:83377-50-8)购自上海科顺生物科技有限公司;FM1流感病毒(血凝滴度1∶128)由中国中医药研究院馈赠;达菲(货号:B1354)购自瑞士巴塞尔豪夫迈罗氏公司;实时荧光定量PCR(qPCR)所需试剂均购自美国Thermo Fisher 公司;引物均由上海生工设计合成;酶联免疫吸附测定(ELISA)试验试剂盒购自美国RD 公司。
1.3 动物分组及流感病毒性肺损伤模型的建立 将60只BALB/c小鼠随机分为6组,每组10只,分别为对照组、模型组、达菲组、山莨菪碱低剂量组、山莨菪碱中剂量组、山莨菪碱高剂量组。除对照组外,其他5组均建立流感病毒性肺损伤模型:小鼠在乙醚浅度麻醉下,从鼻腔滴入FM1流感病毒液(0.05 mL/g)[6]。对照组同法滴入无菌生理盐水。
1.4 给药方法 各组小鼠分别灌胃给药,2次/d,达菲剂量为27.5 mg/kg,山莨菪碱高、中、低剂量分别为3 mg/kg、1.5 mg/kg、0.75 mg/kg。对照组和模型组给予等量生理盐水。给药第7 天感染小鼠,感染后连续给药7 d。
1.5 小鼠肺指数 末次给药2 h后,称体重,处死小鼠,迅速摘取肺脏,去除气管、肺门淋巴结等组织,以生理盐水洗涤2次,用滤纸吸干肺脏表面水分,称肺重,计算肺指数。肺指数=肺重(g)/体重(g)×100%。
1.6 小鼠肺组织病理检查 取部分肺组织,于4%多聚甲醛中固定24 h,石蜡包埋,5 μm厚连续切片,行苏木精-伊红(HE)染色,封片,显微镜下观察各组小鼠肺组织病理损伤情况。
1.7 小鼠肺组织氧化应激及炎症因子水平检测 取部分肺组织,制成组织匀浆,离心,取上清分装,于-20 ℃冰箱中保存待测。采用ELISA 法检测各组小鼠肺组织中超氧化物歧化酶(SOD)、丙二醛(MDA)、肿瘤坏死因子(TNF)-α 和白细胞介素(IL)-6的水平。检测过程严格按照试剂盒说明书要求进行操作。
1.8 qPCR 法检测小鼠肺组织TNF-α、IL-6、TLR3、TRIT mRNA 表达及病毒载量 充分研磨肺组织,Trizol 法提取总RNA,使用微量核酸蛋白测定仪检测RNA 浓度和纯度,将RNA 逆转录为cDNA,按照qPCR试剂盒说明书要求配制反应体系,以GAPDH为内参进行PCR 扩增。引物序列如下:TNF-α 上游:5’-ATGTGGCAAGAGATGGGGAA-3’,下游:5’-CTCACACCCCACATCTGTCT-3’;IL-6 上游:5’-CTCATTCTGTCTCGAGCCCA-3’,下游:5’-CTGTGAAGTCTCCTCTCCGG-3’;TLR3 上 游:5’-TCTTCCCTGGAACACCTGAA-3’,下游:5’-AGATTACTGCAGCCCACCTT-3’;TRIT 上游:5’-CAGGAAGAAGAGGGCCAGAT-3’,下游:5’-TTCAACAAAGATAGCGCCCG-3’;GAPDH上游:5’-AACGGATTTGGTCGTATTG-3’,下游:5’-GGAAGATGGTGATGGGATT-3’。采用2-△△Ct法计算目的基因相对表达量,实验重复3次。
采用qPCR 法检测病毒载量,提取上述基因的DNA,以DNA为模板进行扩增,扩增1 kb片段后制备反应体系30 μL,按照Real Master Mix SYBR Green(北京天根生物科技有限公司)说明书进行操作,取ABI 专用光学八连管,反应体系:DNA 2 μL,上、下游引物各2 μL、2×SuperReal PreMix 13.5 μL、RNase-free ddH2O 补足至30 μL;反应条件:95 ℃4 min,95 ℃30 s,59 ℃30 s,68 ℃35 s,72 ℃30 s,共40 次循环,应用ABI 7500 型荧光定量PCR 仪进行PCR扩增,读取数据[7]。
1.9 Western blotting 法检测小鼠肺组织中干扰素调节因子3(IRF3)蛋白表达 将肺组织充分研磨,加入RIPA 裂解液,于冰上裂解30 min,12 000 r/min离心10 min;取上清置于EP管,加入5×SDS上样缓冲液,煮沸10 min;电泳后将蛋白转移至PVDF 膜,5%脱脂奶粉封闭2 h;洗膜,加入IRF3一抗(1∶1 000,美国Santa Cruz 公司),4 ℃冰箱过夜孵育;洗膜,加二抗(1∶2 000,美国Santa Cruz 公司),室温下孵育2 h;ECL发光、显色,凝胶成像仪拍照,应用Image J软件分析条带灰度值。以目的蛋白条带灰度值与内参蛋白条带灰度值的比值为目的蛋白相对表达量。
1.10 统计学方法 采用SPSS 21.0软件进行分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 6组小鼠肺组织病理改变 对照组肺泡结构清晰,未见明显的病理损伤现象;模型组肺泡出现病变,肺泡可见大量的炎性细胞浸润,血管出现明显的充血现象,肺组织结构破坏;与模型组比较,达菲组肺泡内炎性细胞和血管充血明显减少,肺组织损伤得到显著改善,组织结构与对照组相近;与模型组比较,山莨菪碱低、中、高剂量组肺泡炎性细胞浸润逐渐减少,血管充血逐渐减轻,肺组织损伤逐渐改善;山莨菪碱高剂量组肺组织结构与达菲组相近,见图1。
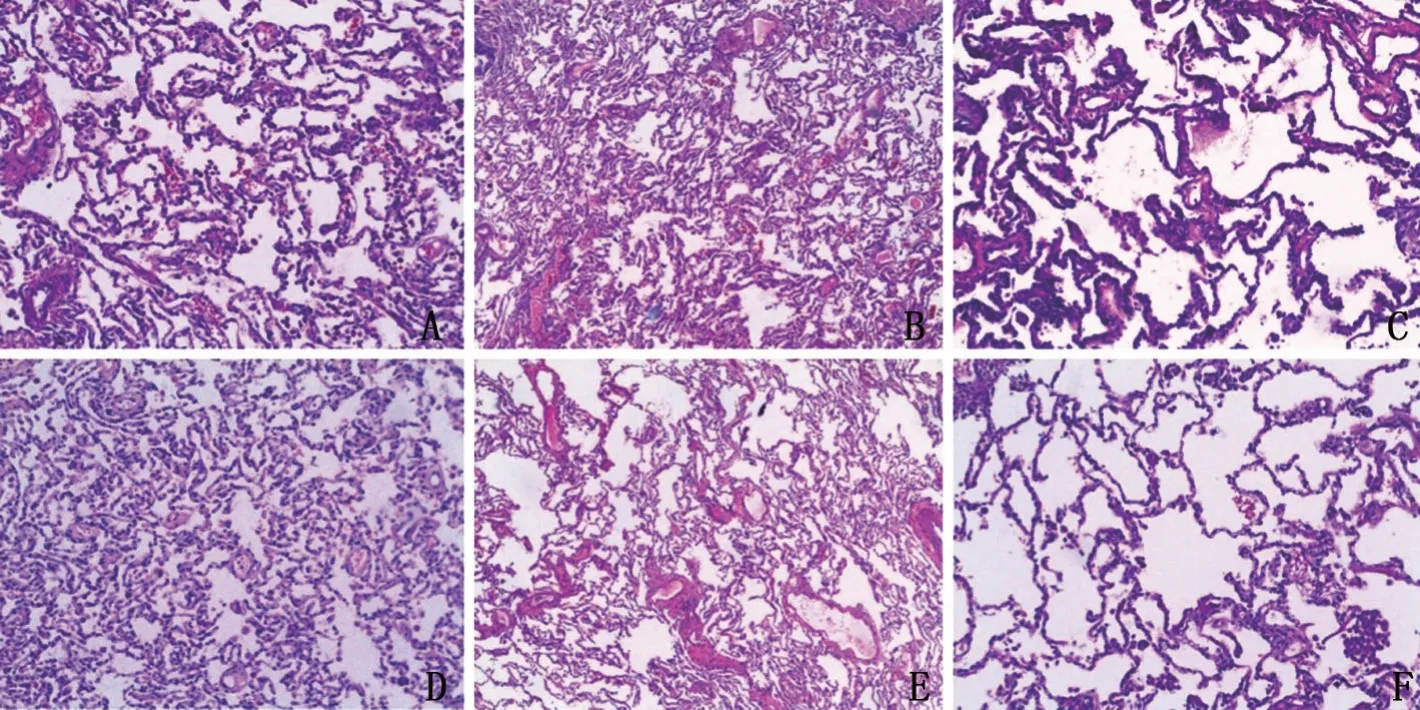
图1 小鼠肺组织HE染色图(×200)
2.2 6组小鼠肺指数和肺组织病毒载量比较 与对照组比较,模型组肺指数升高(P<0.05);与模型组比较,山莨菪碱低、中、高剂量组和达菲组肺指数和病毒载量显著降低(P<0.05);与达菲组比较,山莨菪碱低、中剂量组肺指数和病毒载量显著升高(P<0.05),山莨菪碱高剂量组与达菲组比较,差异无统计学意义(P>0.05);山莨菪碱降低小鼠肺指数和病毒载量的作用呈剂量依赖性(P<0.05),见图2。
2.3 6组小鼠肺组织SOD和MDA水平比较 与对照组比较,模型组肺组织SOD活性显著降低,MDA水平显著升高(均P<0.05);与模型组比较,山莨菪碱低、中、高剂量组和达菲组肺组织SOD 活性显著升高,MDA水平显著降低(均P<0.05);与达菲组比较,山莨菪碱低、中剂量组肺组织SOD 活性显著降低,MDA水平显著升高(均P<0.05),山莨菪碱高剂量组与达菲组比较,差异无统计学意义(P>0.05);山莨菪碱对肺组织SOD和MDA的作用呈剂量依赖性(P<0.05),见图3。

图3 山莨菪碱对肺炎小鼠肺组织中SOD活性及MDA水平的影响
2.5 山莨菪碱对肺炎小鼠肺组织炎性因子TNF-α及IL-6水平的影响 与对照组比较,模型组小鼠的肺组织TNF-α、IL-6 水平显著升高(P<0.05);与模型组比较,山莨菪碱低、中、高剂量组和达菲组肺组织TNF-α、IL-6 水平显著降低(P<0.05);与达菲组比较,山莨菪碱低、中剂量组肺组织TNF-α、IL-6 水平显著升高(P<0.05),山莨菪碱高剂量组与达菲组比较,差异无统计学意义(P>0.05);山莨菪碱对小鼠肺组织炎性因子TNF-α、IL-6 的抑制作用呈剂量依赖性(P<0.05),见图4。
2.4 6组小鼠肺组织TNF-α、IL-6、TLR3 及TRIT mRNA相对表达量比较 与对照组比较,模型组肺组织TNF-α、IL-6、TLR3和TRIT mRNA相对表达量均显著升高(P<0.05);与模型组比较,山莨菪碱低、中、高剂量组和达菲组TNF-α、IL-6、TLR3 和TRIT mRNA相对表达量均显著降低(P<0.05);与达菲组比较,山莨菪碱低、中剂量组TNF-α、IL-6、TLR3 和TRIT mRNA 相对表达量均显著升高(均P<0.05),山莨菪碱高剂量组与达菲组比较,差异无统计学意义(P>0.05);山莨菪碱对小鼠肺组织TNF-α、IL-6、TLR3 及TRIT mRNA 表达的抑制作用呈剂量依赖性(P<0.05),见图5、图6。
2.7 6组小鼠肺组织IRF3 蛋白表达量比较 与对照组比较,模型组肺组织IRF3蛋白表达量显著升高(P<0.05);与模型组比较,山莨菪碱低、中、高剂量组和达菲组肺组织IRF3 蛋白表达量显著降低(P<0.05);与达菲组比较,山莨菪碱低、中剂量组肺组织IRF3 蛋白表达量显著升高(P<0.05),山莨菪碱高剂量组与达菲组比较,差异无统计学意义(P>0.05);山莨菪碱对小鼠肺组织IRF3 蛋白表达的抑制作用呈剂量依赖性(P<0.05),见图7。
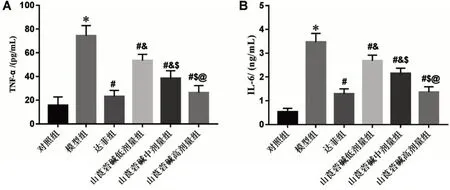
图4 山莨菪碱对肺炎小鼠肺组织炎性因子TNF-α及IL-6水平的影响
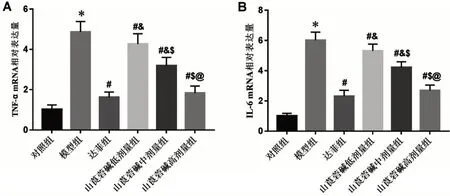
图5 山莨菪碱对肺炎小鼠肺组织TNF-α mRNA、IL-6 mRNA表达的影响
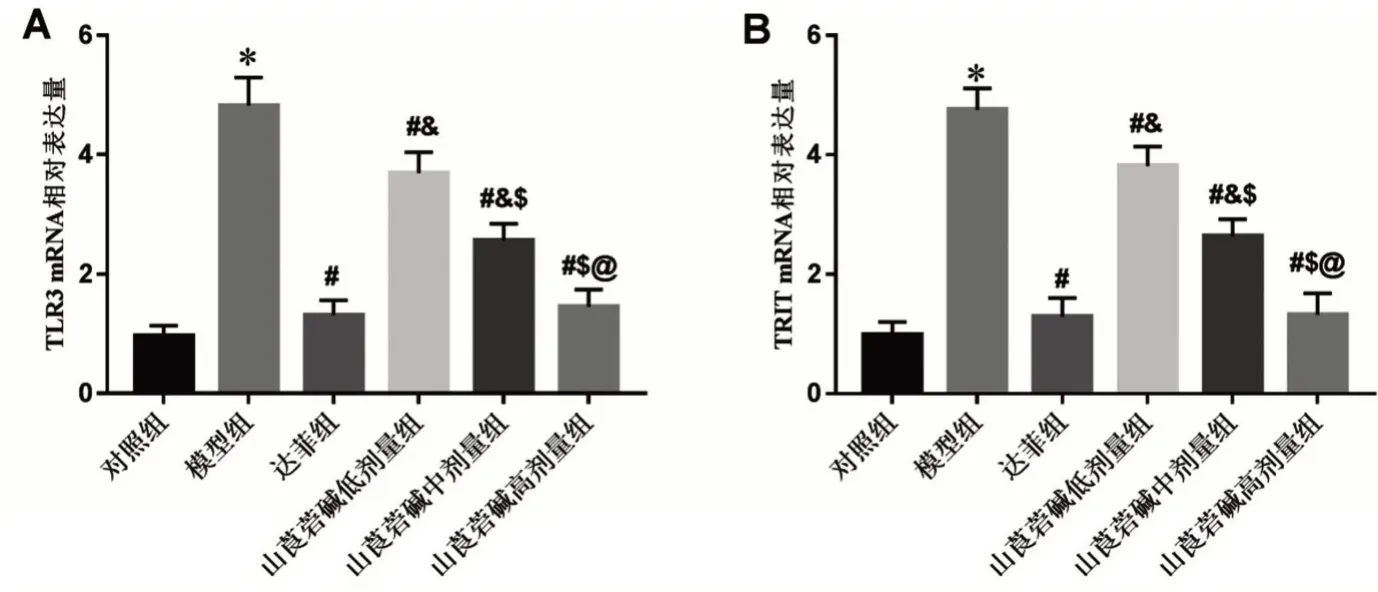
图6 山莨菪碱对肺炎小鼠肺组织TLR3 mRNA、TRIT mRNA表达的影响
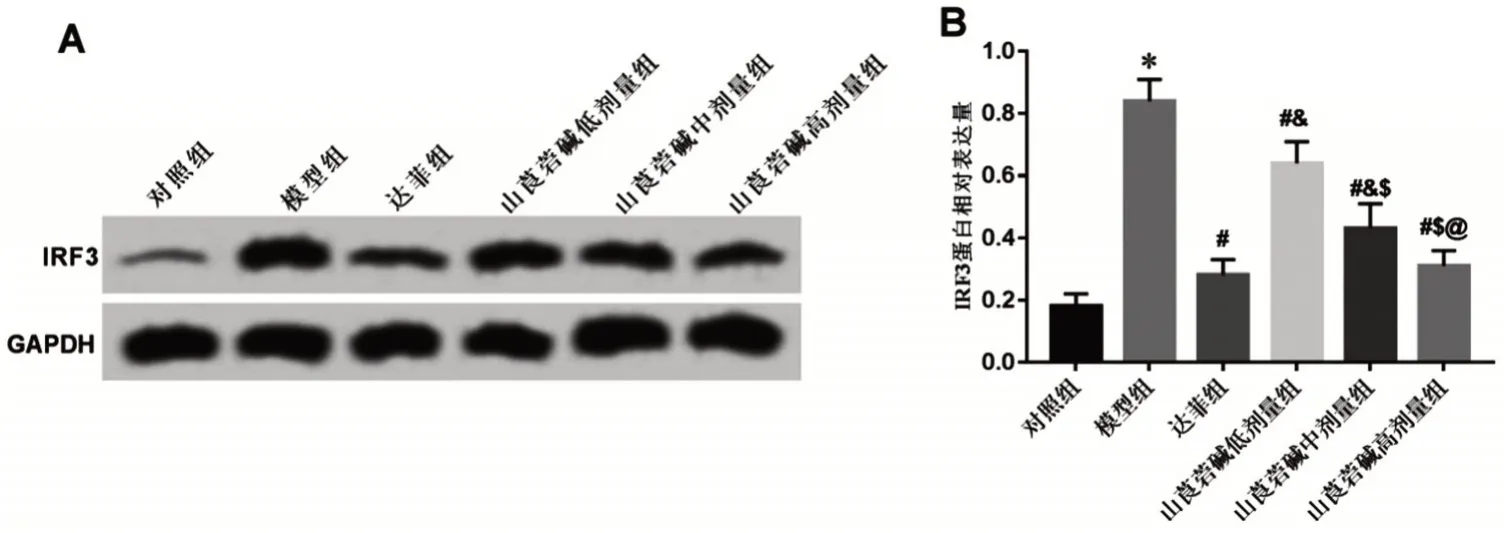
图7 山莨菪碱对肺炎小鼠肺组织IRF3蛋白表达的影响
3 讨论
山莨菪碱是一种从茄科植物山莨菪中提取的生物碱,其为非亚型选择性毒蕈碱,可作为烟碱型胆碱能受体拮抗剂[8]。山莨菪碱与阿托品和东莨菪碱有类似的药理作用,其效力低于阿托品和东莨菪碱,且毒性较低[9-10]。夏锡仪等[11]、Zheng等[12]研究指出,山莨菪碱在急性肺损伤中可发挥保护作用。胡乔华等[13]发现,山莨菪碱可改善脓毒性休克大鼠急性肺损伤。杜宁等[14]在开胸术后急性肺损伤患者中发现,山莨菪碱可升高患者血中TNF-α、IL-6、IL-10、超敏C 反应蛋白(hs-CRP)和降钙素原(PCT)水平,抑制体内炎症反应从而减轻肺损伤。以上研究结果均提示山莨菪碱对于肺损伤具有保护作用。
SOD 是生物体内清除超氧阴离子自由基的一种重要酶,其能有效地使机体抗御氧自由基的毒性。MDA 是衡量体内自由基代谢水平和反映机体受氧化损伤程度的敏感指标。本研究中,山莨菪碱能够提高流感病毒性肺损伤小鼠肺组织中的SOD活性,降低MDA 含量,且呈剂量依赖性(P<0.05)。提示山莨菪碱具有一定的抗氧化能力,其肺损伤保护作用可能与抗氧化特性有关。TNF-α、IL-6、IL-8等细胞因子作为重要的炎症介质参与机体的炎症反应。本研究发现,山莨菪碱低、中、高剂量组肺组织TNF-α、IL-6表达显著降低(P<0.05)。提示山莨菪碱能够明显抑制流感病毒诱导的肺损伤小鼠肺组织内炎症反应,减轻肺组织炎症损伤程度,这与HE染色结果相一致。
TLR属于天然免疫的蛋白质分子,其可通过识别病原体等而发挥抗病毒的作用,其中TLR3/TRIF信号通路在机体免疫系统等多种相关疾病中可发挥重要作用,TLR3 可招募TRIF 而促进下游炎性因子表达,进而引起机体炎症反应[15]。TLR3/TRIF 信号通路活化可促进IRF3的表达,进而促使炎症因子分泌,并可参与机体抗病毒免疫应答等多种病理过程[16]。研究表明,脂多糖诱导的急性肺损伤中IRF3的表达水平升高,IRF3高表达可增加IL-6和IL-8等炎症因子的分泌量进而加重急性肺损伤[17]。朱珊等[18]通过呼吸机诱导肺损伤模型,qPCR、ELISA 实验发现,损伤肺组织中TLR3、TLR4 的表达异常升高,提示TLR3、TLR4 的表达与肺组织的损伤密切相关。此外,王丽等[19]研究发现,在流感病毒诱导的肺损伤小鼠中,TLR3、TLR4 的表达上调,同时NFκB 和TNF-α 表达量升高。本研究发 现,TLR3、TRIT、IRF3的表达在流感病毒诱导的肺损伤小鼠中明显升高,山莨菪碱能够明显降低小鼠肺组织中TLR3、TRIT、IRF3的表达,且呈剂量依赖性,说明山莨菪碱可能通过抑制TLR3/TRIF信号通路的激活,从而发挥病毒性肺损伤的保护作用。
综上所述,山莨菪碱对流感病毒致肺损伤小鼠具有保护作用,可减轻肺组织损伤程度,其作用机制可能与抗氧化应激、减轻炎症反应、抑制TLR3/TRIF信号通路有关。

