一例双侧肾透明细胞癌患者与家系成员VHL基因的胚系突变分析
施爱军,吴剑秋,尹 娜,吴晓柳,康 铮(.南通市如东县中医院检验科,江苏如东 6400;.江苏省肿瘤医院&江苏省肿瘤防治研究所&南京医科大学附属肿瘤医院,南京 0009)
肾透明细胞癌是肾细胞癌的主要病理类型,约占肾细胞癌的80%,也是家族性肾细胞癌的主要病理类型[1-2]。肾细胞癌的发生涉及到了很多基因,其中,VHL(von Hippel-Lindau,VHL)基因的研究是近年来学者们研究的一个热点。VHL基因是一个典型的抑癌基因,其编码蛋白产物pVHL是泛素连接酶的组成成分之一,后者在细胞的增殖、凋亡和癌细胞的浸润、转移中起到了巨大的作用[3]。在肾细胞癌组织中普遍存在着VHL基因的体系突变,常见的突变形式包括点突变、杂合性缺失(loss of heterozygosity,LOH)及甲基化[4];VHL基因的胚系突变则常发生于家族性、遗传性肾细胞癌和肿瘤易感综合征家系中[5]。本文对一例家族性双侧透明肾细胞癌患者家系的VHL基因的胚系突变进行分析,结合其临床特点探讨可能的分子遗传学发病机制。
1 材料与方法
1.1 研究对象
1.1.1 患者家系调查:经患者及其家族成员的同意,我们调查了其家系(见图1)。患者Ⅲ2(30岁)与其兄Ⅲ1(34岁)皆患有肾肿瘤,其父Ⅱ2 因肝硬化于42岁死亡。
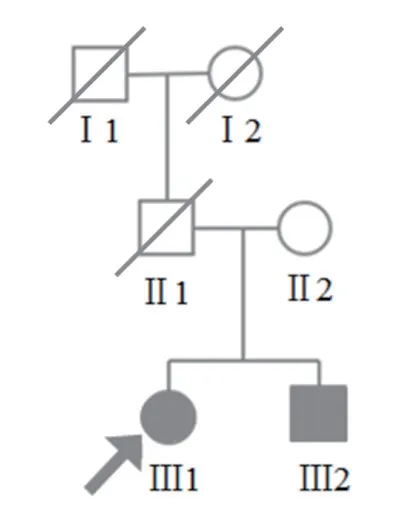
图1 患者家系图(箭头所指为先征者)
1.1.2 患者临床资料:患者,女,30岁,因双肾占位入我院。患者BMI 达46.9,属重度肥胖,并发脂肪肝。其兄亦有重度肥胖及单侧肾肿瘤史。CT 检查发现患者双肾占位,两侧附件区出现囊肿。行左肾部分切除术,好转出院。术后病理诊断为左肾透明细胞癌Ⅰ~Ⅱ级。左肾术后三个月再次入院进行右肾根治性切除术,术后病理显示右肾透明细胞癌Ⅲ级,伴大面积坏死。右肾术后三个月第一次随访CT 检查,新见多发肺转移,术后9个月第二次随访CT 检查,发现双侧肺、双侧肾上腺出现多发性转移同时伴有髂骨、右侧股骨头、L3 椎体骨转移。
1.2 仪器与试剂 淋巴细胞分离液(lympholyte-H,Cedarlane 公司),外周血白细胞基因组DNA和RNA 提取试剂盒(QIAamp DNA/RNA Blood Midi Kit,QIAGEN 公司),逆转录试剂盒(Vazyme HiScript®ⅡReverse Transcriptase,Vazyme Biotech公司),PCR 试剂盒(TaKaRa LA Taq® with GC Buf fer,TaKaRa 公司)。
1.3 方法
1.3.1 外周血白细胞基因组DNA 和RNA 提取:收集先证者、其家系成员以及正常对照者外周血标本,分离白细胞,采用QIAamp DNA/RNA Blood Midi Kit,按照试剂盒说明书步骤分别提取VHL 综合征家系成员及正常对照者的外周血白细胞基因组DNA 和RNA。
1.3.2 PCR-DNA 测序检测 VHL基因碱基突变、微小插入和缺失:PCR 扩增VHL基因三个外显子,引物序列参考文献[6]。PCR 反应体系:25μl,内含50~100ng 基因组DNA,0.2 mmol/L dNTP,上下游引物各 0.5μmol/L,Taq HS DNA 聚合酶2U。PCR条件:94℃预变性5 min,94℃ 20 s,58~62℃40 s,72℃ 20 s,35个循环,72℃延伸7min。2g/dl琼脂糖凝胶电泳检测PCR 产物,对PCR 产物进行DNA 片断纯化回收,送交公司测序后进行序列分析。
1.3.3 荧光实时定量PCR检测VHL基因外显子拷贝数变异:使用TaKaRa SYBR Premix EX Taq™ 试剂盒进行实时定量PCR检测,引物序列参考文献[5]。PCR反应体系和条件参考文献[7],50μl体系:含引物200nmol/L,基因组20ng,SYBR Premix EX Taq™5μl;PCR反应条件:95℃ 1 min,94℃ 5s/60℃20s,45个循环,每个样品做3个平行管,每次实验至少重复3次。
进行数据分析采用ΔΔCt法。Ct是指达到荧光检出界限阈值时的循环数。计算公式:ΔΔCt=(Ct相对拷贝数设定正常人的值为1,患者2−ΔΔCt>1.25时,判断基因拷贝数增加,而<0.75时判断基因拷贝数减少。
1.3.4 RT-PCR 扩增测序验证外显子单拷贝缺失:使用Vazyme HiScript®ⅡReverse Transcriptase 试剂盒对患者及其家系的RNA 样本进行反转录,以反转录所得cDNA 作为模板进行PCR,分别在exon1 和exon3 区域设计上下游引物,上游引物序列CTGCCCCGTATGGCTCAACTTC,下游引物序列CTGACCTGTAGCAGTCCAGCG,扩增长度为298bp。使用TaKaRa LA Taq® with GC Buf fer 试剂盒进行扩增反应,RT-PCR 反应体系和条件参考文献[8],50μl 反应体系包括上下游引物各500nmol/L,TaKaRa La Taq 0.5μl,cDNA40ng,dNTP Mixture 8μl,Buf fer Ⅱ25μl;反应条件:94℃预变性 5 min,94℃ 20s,62℃ 30s,72℃ 20s,35个循环,72℃延伸7min。1.5g/dl 琼脂糖凝胶电泳检测RT-PCR 产物长度。对RT-PCR 产物进行DNA片断的纯化回收、测序(南京思普金生物科技有限公司)。
2 结果
2.1 PCR-DNA 测序分析结果 运用PCR-DNA 测序技术检测VHL基因的点突变,检测家系中先证者和其他患者的VHL基因编码区是否存在点突变。发现在该家系成员中均没有发现VHL基因编码区的点突变。
2.2 VHL基因外显子拷贝数的定量分析结果 采用ΔΔCt法进行数据分析,相比于正常对照该患者与其兄VHL基因外显子2 相对拷贝数在0.62 左右,小于0.75。
2.3 RT-PCR 产物电泳和测序结果 见图2。以逆转录所得cDNA 作为模板进行RT-PCR 扩增,正常人产物片段长度应为298bp,已知VHL基因exon2长度为123bp,图2中所示患者的cDNA 产物琼脂糖凝胶电泳出现两条区带,且两条带间距符合VHL基因exon2 杂合性缺失。将RT-PCR 产物直接测序显示由于exon2的杂合性缺失,测序图在异常剪接起始位点处开始同时出现exon2 和exon3 序列信号。序列解读的结果显示缺失片段为123bp的exon2,见图3。
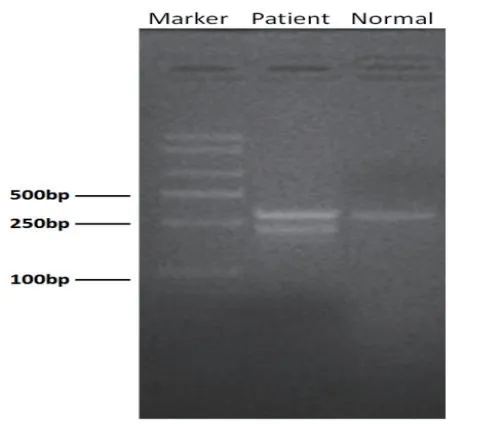
图2 RT-PCR 产物琼脂糖凝胶电泳
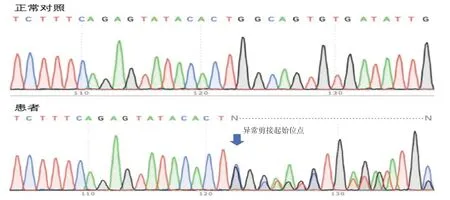
图3 外显子2 杂合性缺失的cDNA 测序图
3 讨论
VHL为抑癌基因,定位于3p25-26,全长45kb,含有3个外显子,所编码的蛋白含有213个氨基酸(pVHL213)。pVHL213 可以与缺氧诱导因子(hypoxia-inducible factor,HIF)的α亚基结合,使HIF泛素化后导致其降解,从而抑制HIF的下游产物如血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、转化生长因子(transforming growth factor-α,TGF-α)等分子的表达[9]。当pVHL213 不能正常合成时可引起HIF的积累,从而激活下游信号通路导致多种肿瘤的发生。
本文所研究的患者为双侧肾透明细胞癌,病程发展较快,随访发现多部位的转移灶,同时多处出现骨转移。相对于散发型肾细胞癌,家族型VHL相关肾癌起病较早,且易产生新病灶和多发性转移,预后较差[9]。患者与其兄肾癌发病年龄均低于35岁,符合家族性肾癌早发的临床特点,另外患者双侧、多灶性肾肿瘤,皆提示了其基因变异的可能性。本研究对患者外周血VHL基因三个外显子进行扩增后测序表明这个家系中不存在点突变、采用实时定量PCR 技术检测3个外显子的拷贝数变化,发现患者与其兄外显子2的拷贝数明显低于正常对照且外显子2 处出现套峰,缺失片段为123bp。研究结果表明该患者VHL基因存在第2 外显子单拷贝缺失的病理性胚系突变,该突变基因编码的蛋白仅仅含有172个氨基酸(pVHL172)。
已有文献表明pVHL172 可以上调促癌基因的表达[10],正常的pVHL213 能够通过上调纤连蛋白和胶原蛋白的表达而降低肿瘤细胞的侵袭转移能力[11-12],而pVHL172 则可以通过TGF-β 信号通路上调基质金属蛋白酶13(matrix metalloproteinase,MMP13),促进肿瘤细胞的侵袭转移[13]。该机制可能是导致该先证者发生多器官转移的原因之一。
本研究中该家系患者与其患病兄长均属于重度肥胖,患者亦被诊断为脂肪肝,其父42岁死于脂肪肝导致的肝硬化。此或与其家系VHL基因的突变导致pVHL213 不能正常合成,体内HIF的分解减少,引起下游HIF的积累有关。已有研究显示HIF 可通过促进磷酸脱氢酶(phosphate dehydrogenase,PDH)的失活,抑制丙酮酸进入三羧酸循环(tricarboxylic acid cycle,TCA),进而影响正常脂质代谢[14]。VIRTUE 等[15]人的动物实验亦发现HIF 复合物的积累可促进实验动物肥胖、脂肪肝和2型糖尿病的发生发展。
综上所述,家族性肾细胞癌家系中VHL基因的胚系突变筛查可作为一种有效的手段预测患者的预后,并可用于临床的诊断。

