液相芯片技术快速检测2型糖尿病患者相关降糖药物基因多态性的方法学建立
邓任堂,许红丽,孔桂兴,赖丽莎,揭育帮,陈梅莲,付文金(.广东省东莞市厚街医院检验科,广东东莞 53945;.湖南省武冈市人民医院检验科,湖南邵阳 4400)
2型糖尿病(type 2 diabetes mellitus,T2DM)是严重影响人类身心健康的重大疾病之一。对于确诊患者,最有效的治疗方法就是药物降糖治疗。然而,不同的T2DM患者在使用降糖药治疗过程中,在药代动力学、疗效以及不良反应中存在显著的个体差异,这是药物基因组学导致的,其中磺脲类受体1(sulfonylurea receptor 1,ABCC8)[1],转录因子7 类似物2(transcription factor 7~like 2,TCF7L2)[2-3],胰岛素受体底物1(insulin receptor substrate~1,IRS1)[4-5],过氧化物酶体增殖物激活受体γ(peroxidase proliferation of activated receptor~γ2,PPARγ2)[6],有机阳离子转运蛋白与多药和有毒化合物排出家族(organic cation transporters and multidrug and toxin extrusion proteins,SLC47A1,SLC22A1)[7],有机阴离子转运蛋白家族成员1B1(Organic Anion Transporters 1B1,SLCO1B1)[8-10]等有重要临床意义。但目前常用检测单核苷酸多态性(Single nucleotide polymorphism,SNP)的方法并不能很好地满足临床需求。液相芯片技术作为新一代高通量检测技术,特别适用于SNPs检测,在临床各方面发挥越来越重要的作用。本研究旨以液相芯片技术,通过多重PCR 联合等位基因特异性引物延伸(allele specific primer extension,ASPE),建立一次性检测上述7个目标基因型的方法,以期为临床选择适宜降糖药,减少不良反应,提高药效提供实验室支持。
1 材料与方法
1.1 研究对象 115例患者为2019年1~12月我院新诊2型糖尿病患者,均符合WHO 颁布的糖尿病诊断标准,其中男性63例,女性52例,年龄52~76岁,中位年龄65岁。所有患者均签署知情同意书,并通过东莞市厚街医院伦理委员会批准,厚街伦理编号:[2019]伦审第(023)号。
1.2 试剂和仪器 多重PCR 试剂盒TaqTMHot Start Version(日 本TaKaRa 公司),DNA提取试剂盒TIANamp Genomic DNA Kit(北京天根生化科技有限公司),核酸外酶I~虾碱性磷酸酶(ExoSAP~I),PlatinumTM GenoType Tsp DNA聚合酶、链霉亲和素-澡红蛋白(SA~PE),Biotin~dCTP,dNTPs等(美国赛默飞世尔科技公司),偶合Anti-Tag 序列微球(美国Luminex 公司),LifeECO 基因扩增仪(中国透景生命科技有限公司),蛋白核酸分析仪(英国豪沃生物科技有限公司),DYY-6C型电泳仪(北京六一生物有限公司)。
1.3 方法
1.3.1 标本采集与DNA 提取:采用EDTA-K2抗凝管采集患者空腹外周血2ml,按照试剂盒说明书提取DNA,使用蛋白核酸分析仪调整样本DNA浓度至25~30 ng/μl。
1.3.2 引物设计及合成:参照课题组之前做法[11],根据7个目的基因的rs号,在Genbank 中查找其靶位点附近碱基序列,以PrimerPlex 软件设计特异性的ASPE 引物,Primer6.0 软件设计含检测位点的PCR 引物。委托上海生工生物技术有限公司合成所有引物。引物及微球信息见表1。
1.3.3 多重PCR系统:反应总体系共50μl,其中含DNA样本2μl,5 U/μl TaqTMHot Star DNA 聚合酶 0.25μl,10xTaqTMHot Star DNA 聚合酶缓冲液5μl,10mmol/L dNTP 4μl,上下游混合引物8μl,超纯水30.75μl。混合物先3 000×g 离心10s,94℃预变性30s 后,94℃30s,57℃30s,72℃30s,5个循环;接着94℃ 30s,55℃30s,72℃30s,30个循环;最后72℃10 min 终止延伸。同时以超纯水作空白对照。
1.3.4 PCR 产物纯化:取PCR 扩增产物5μl 与ExoSAP-IT 2.5μl 混合,37℃孵育30min,80℃反应20 min。
1.3.5 ASPE 反应:反应总体系20μl,含纯化PCR 扩增产物2μl,TAG-ASPE 引物混合液1μl,400μmol/L Biotin-dCTP 0.3μl,300μmol/L dATP/dGTP/dTTP 混合液1μl,10×TaqTMHot Star DNA聚合酶缓冲液2μl,5U/μl TaqTMHot Start DNA聚合酶0.12μl,100μmol/L dCTP 0.4μl,超纯水13.18μl。混合物先3 000×g 离心10s,接着94℃30s,55℃30s,74℃1min,40个循环。
1.3.6 杂交反应:以1.5×四甲基氯化氨(tetramethylammonium chloride,TMAC)杂交缓冲液混合14种MagPlex-TAG 微球,并稀释至每种微球约50个/μl。取上述混合液25μl 与ASPE 反应产物2μl 混合,先96℃90s,37℃45min,然后加入100μl 含7.5μg/ml SA-PE的1×TMAC杂交缓冲液,经37℃孵育20 min 后,以Luminex 200检测荧光信号。
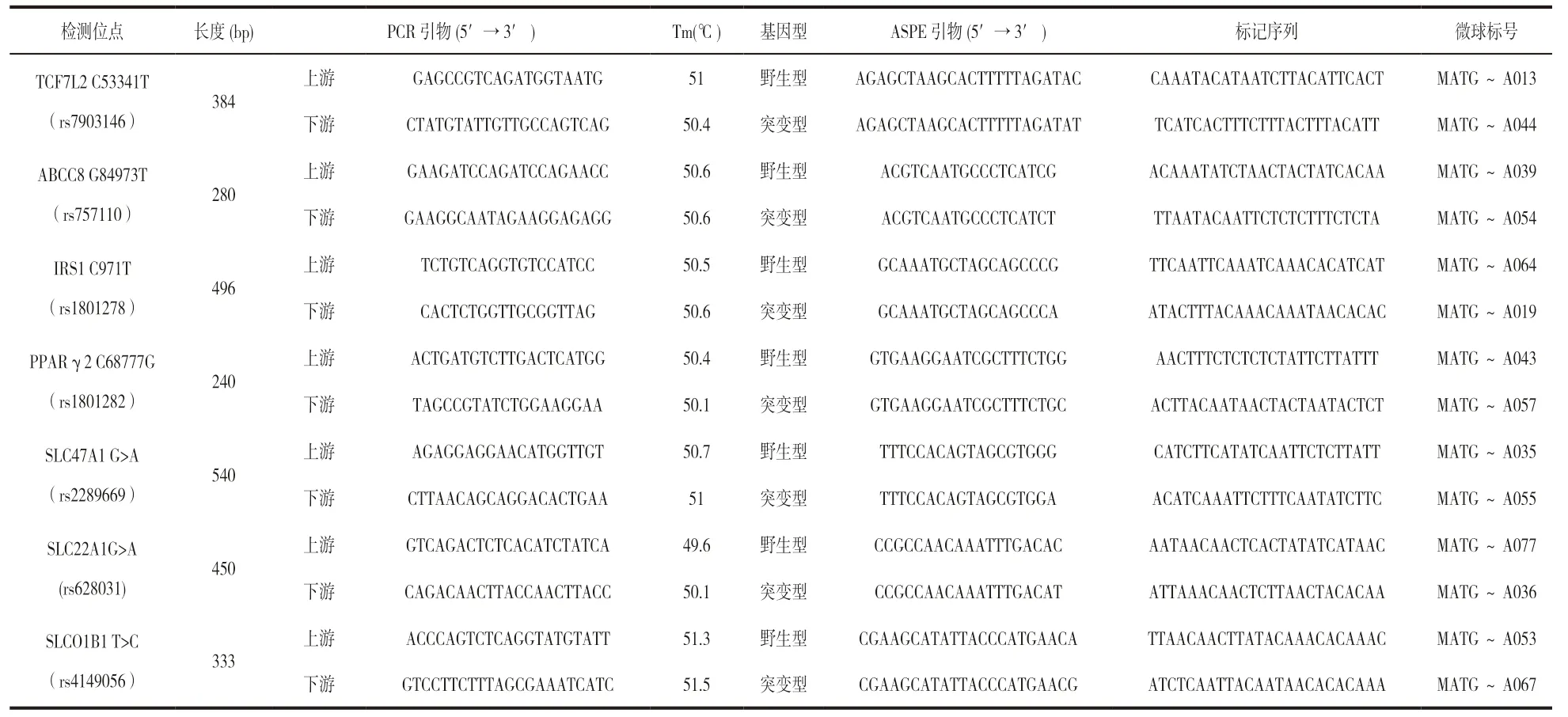
表1 7个目的基因的相关引物及微球信息
1.3.7 结果判读与基因分型:Luminex 200检测系统可直接输出MFI 和MFI 比率。MFI 比率=MFI目标碱基/(MFI野生型+MFI突变型)。MFI 比率>0.75或<0.25 判为野生型或突变纯合子,而0.25~0.75则判为杂合子。
1.3.8 多重PCR 及ASPE 反应条件优化:多重PCR优化:依引物Tm值选择50~60℃梯度退火温度,分别检测100,50,25,12.5 和6ng DNA浓度样本,根据扩增产物电泳结果对7 对引物间的比例、循环次数、退火时间及Mg2+/dNTP/Taq浓度等进行调整。ASPE 反应条件优化:根据MFI 和MFI 比率结果,调整ASPE 反应体系中退火温度及Biotion-dCTP,dCTP浓度等。
1.3.9 方法学性能评价:①重复性实验:参照李婧婵等[12]方法,用五份代表性样本进行批内和批间重复性实验。②最低检测限:参照PICKERING 等[13]方法,以DNA浓度200 ng为基础,倍比稀释至0.75ng,对各浓度样本重复检测三次,以三次均能清晰分辨基因型所对应的浓度为最低检测限。③特异性试验:参照李婧婵等[12]方法,不同的单个靶位点PCR 扩增产物分别与另外的ASPE 引物进行混合,检测信号的特异性。④准确性实验:选择25份样本,分别用本实验建立的方法和Sanger 测序法进行检测,两者结果对比分析。
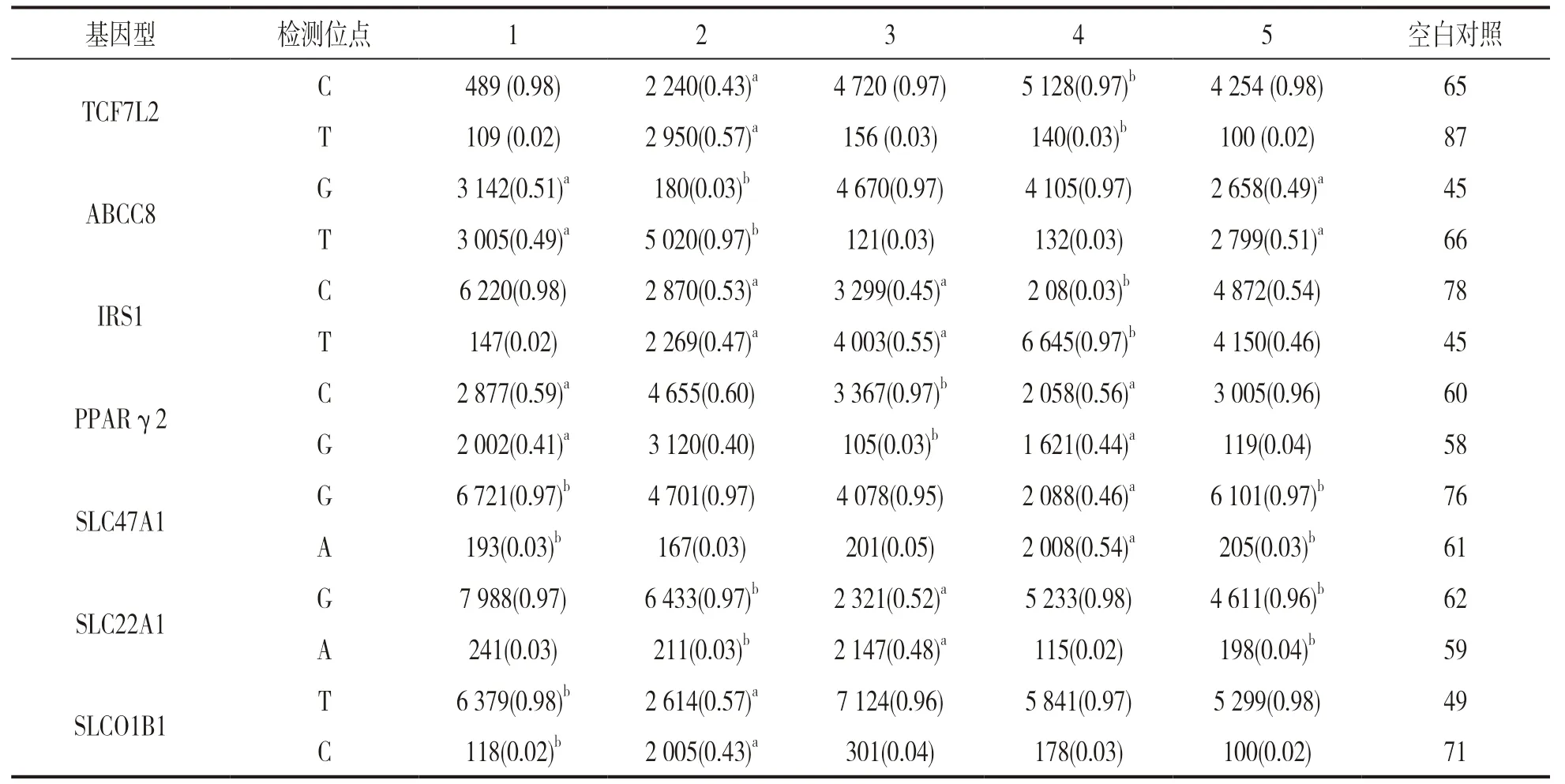
表2 5份标本等位基因MFI 及MFI 比率 [n(%)]
1.4 统计学分析 采用SPSS 17.0 软件进行分析,计量资料用均数±标准差(±s)表示,两组间比较采用非配对t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 方法学建立 7个目标基因经PCR 扩增,产物电泳成像后清楚可见七条目标条带,无非特异性条带;经优化ASPE 杂交条件,选择退火温度55℃,Biotion-dCTP浓度与dCTP浓度的比值为3∶1,37℃孵育45 min时检测效果最佳。
2.2 方法学性能评价 采用本实验方法检测倍比稀释标本,最低检测限可达0.75ng,以DNA浓度为50ng时分辨率最高。表2反映5份样本MFI 及MFI比率结果。从重复性实验结果来看,MFI 批内批间CV偏高,分别达26.3%和33.7%;但纯合子MFI比率批内批间CV在0.9%~3.3%和2.1%~4.6%;杂合子MFI 比率批内批间CV在2.9%~7.3%和5.2%~11.2%。结果见表3。特异性试验结果显示不含靶位点时MFI值均小于250,含靶位点MFI值可高达1 000以上。以本实验方法检测25份样本,与测序结果完全一致,准确度达100%。
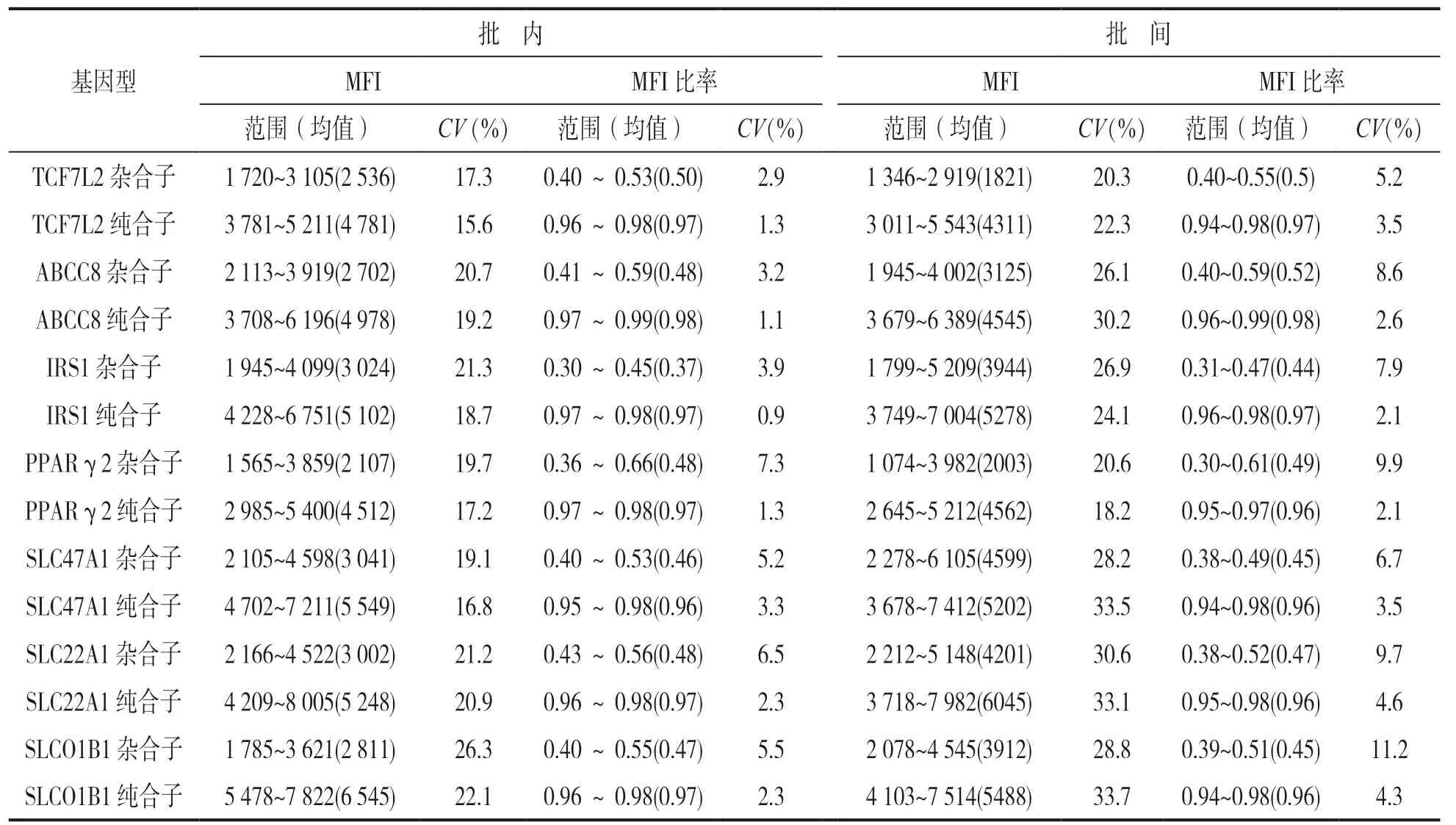
表3 5份标本相关基因型批内批间MFI,MFI 比率及CV值
3 讨论
2型糖尿病是全球性的公共卫生问题。我国糖尿病患者已超过1亿,是糖尿病第一大国。对于确诊T2DM患者,最有效的治疗方法就是药物降糖治疗。临床常用口服降糖药物主要包括磺脲类、双胍类、噻唑烷二酮类、氯苯茴酸类和α 葡萄糖苷酶抑制剂类。研究已证实药物基因组学可导致不同患者使用降糖药治疗时,在药代动力学、疗效以及不良反应中存在显著的个体差异。相关研究已筛选出几十个与药物治疗反应相关的基因位点,其中ABCC8,TCF7L2,IRS1,PPARγ2,SLC47A1,SLC22A1 和SLCO1B1 等有重要临床意义。
目前,检测基因多肽性的方法主要有:固相芯片法、PCR 法、测序法等,但这些方法通量低,成本高,耗时长、敏感度和特异度低,操作复杂,或需特殊仪器,从而限制其应用[14]。液相芯片技术为新一代高通量检测技术,操作简便、灵敏度高、重复性好,特别适用于SNPs检测,在临床各个领域应用越来越多。本研究以 Luminex 200为平台,成功建立了高效便捷检测2型糖尿病降糖药相关药物基因型的方法,本方法灵敏度、重复性、特异性及准确性均较理想,有望为临床选择适宜口服降糖药,减少不良反应,提高药效提供实验室支持。
影响Luminex 液相芯片方法学建立的因素较多,关键在于多重PCR 反应体系,ASPE 杂交条件等。(1)在构建多重PCR 反应体系时,为保证扩增的特异性,要重点关注两个指标:①各引物间Tm 差值。为避免各目的基因之间发生非特异性扩增,在设计PCR 引物时尽可能的减少各引物间Tm差值。本试验中各引物间Tm 差值小于2℃;②退火温度,退火温度决定PCR 特异性,退火温度高特异性强,退火温度低则非特异性产物增加,合理的退火温度从55℃~70℃。本试验从50℃开始探索,直到将前5个PCR 循环退火温度设为57℃时,取得较好效果。(2)在摸索ASPE 杂交条件时,首先,要避免ASPE 引物之间发生交叉延伸,这可通过调整多重PCR 延伸温度得以解决。其次,ASPE 反应体系中Biotion-dCTP浓度与dCTP浓度比值至关重要。我们在上一课题中已发现,该比值过高会影响ASPE 引物有效延伸,过低则荧光信号弱,维持在3:1 可取得较好效果[11,15]。
方法学评价结果表明:本方法灵敏度高,最低检测限达0.75ng;特异度强,设计的ASPE 引物探针与其他位点均无交叉反应;准确性高,25份样本检测结果与测序结果完全一致,基本可满足临床需求。
本研究也有一定的局限性,本次研究只收集了115份临床标本进行实验,属小标本研究事件,同时MFI的批内批间CV值达26.3%和33.7%,课题组将继续收集临床标本,对系统参数进行调整优化,以解决CV值偏高的问题,进一步在大样本层面验证,以期临床应用。
综上所述,本研究成功建立了液相芯片检测系统,可高效便捷检测7个2型糖尿病降糖药相关药物基因型,满足临床的需求,有望为临床选择适宜降糖药,减少不良反应,提高药效提供实验室支持。

