Beagle犬药物诱导急性肾损伤模型的研究
白玉杰,霍桂桃,杨艳伟,孙立,苗玉发,周晓冰,李波
急性肾损伤(acute kidney injury,AKI)是一种临床常见的危重病症,轻者肾脏结构受损,重者肾脏功能紊乱,甚至导致患者死亡。据估计,药物性急性肾损伤占所有 AKI 病例的 25%,在老年患者中甚至高达 60%[1]。由于传统肾损伤标志物血清尿素氮(BUN)和肌酐(CRE),在肾功能显著丧失之前无法充分显示肾毒性,导致药物肾毒性在药物开发过程中经常被低估,因此,寻找新型的肾毒性生物标志物是预防药物性肾损伤的有效策略[2]。但由于不同毒性机制药物会影响肾脏的不同部位,而不同病因、不同损伤部位甚至不同病变时期,各生物标志物的表现又不完全相同,理想的肾毒性生物标志物要求既能快速灵敏地反映早期轻微肾损伤,又能识别肾损伤的具体部位(如肾小球或肾小管)[2-4]。因此,建立不同类型的 AKI 动物模型,对于筛选灵敏特异的肾毒性生物标志物具有重要意义。
目前,新型肾毒性生物标志物的研究主要集中在 AKI 病人和啮齿类动物模型上[3-4],而犬作为药物安全性评价常用的动物种属,尚缺乏新的肾毒性生物标志物的研究数据。因此为拓宽这些潜在的标志物在非啮齿类动物上的适用性,建立可靠的大型动物——犬的药物肾损伤模型,并以此开展犬肾毒性生物标志物的相关研究迫在眉睫。本研究选用肾小管损伤阳性药物顺铂建立 Beagle 犬急性肾损伤模型,确定不出现严重毒性反应同时又能造成适度肾脏损伤的适宜剂量及给药方案,同时开展新的生物标志物的初步研究,为探索灵敏、特异的 Beagle犬新型肾毒性生物标志物提供试验依据。
1 材料和方法
1.1 材料
1.1.1 试验动物与饲养条件 雄性 5~6月龄Beagle 犬,普通级,购自北京玛斯生物技术有限公司,合格证号 SCXK(京)2011-0003。Beagle 犬单笼饲养,笼具每日清洗,动物定量喂食,自由饮水,采尿期间禁食禁水;温度:15~25 ℃,日温差≤ 4 ℃,湿度:40%~70%,换气次数 8~10 次/h,每天光照时间 12 h。
1.1.2 主要试剂和仪器 注射用顺铂冻干粉针剂(批号:4060221)购自齐鲁制药有限公司;犬Clusterin ELISA 试剂盒(批号:E15-066)购自捷克 Biovender 公司;白蛋白(Albumin)检测试剂盒(批号:607 850-01)购自美国 Roche 公司;CRE、BUN 生化检测试剂全部购自日本 Wako 公司;MINI AM4290 尿分析仪购自日本京都第一科学株式会社;7180 型全自动生化分析仪购自日本日立公司;全波长酶标仪 SpectraMax Plus 购自美国Molecular Devices 公司;Luminex 200TM液相芯片悬浮系统购自美国 Luminex 公司。
1.2 方法
1.2.1 试验设计 Beagle 犬经过 2 周检疫驯化合格后,参照相关文献[3-4],设定给药剂量、给药途径、解剖时间点,设定 3、4 和 5 mg/kg 三个给药剂量,顺铂冻干粉用 0.9% 氯化钠注射液配制成1 mg/ml 顺铂注射液。给药方式为微量注射泵单次静脉注射,每个剂量 1 只动物,观察 16 d,试验期间每日观察动物临床症状,给药前、给药后每隔一天或两天收集动物 16 h 过夜尿液(固定于下午5 点至次日上午 9 点收集)。收集完尿液后采集犬前肢内侧静脉血液,静置 30~60 min 待血液凝固,4 ℃,3000 r/min 离心 10 min,分离血清用于BUN、CRE 测定。在各组动物观察最后一天进行解剖,对动物进行大体病理学检查,收集动物的肾脏于 10% 福尔马林固定液中保存,用于组织病理学检查。
1.2.2 血清和尿液生物标志物检测 采用全自动生化分析仪对动物血清中 BUN 和 CRE 以及尿液中 CRE 和 Albumin 的浓度进行测定;此外,按照试剂盒说明书,使用酶联免疫方法(ELISA)测定动物尿液中丛生蛋白(Clusterin)浓度;并按照产品说明书,使用 Luminex 方法测定尿液中骨桥蛋白(OPN)和单核细胞趋化蛋白-1(MCP-1)浓度。对超过检测限的样本,改变稀释浓度后重新检测。
1.2.3 组织病理学检查 将肾脏固定后经修块取材,依次进行脱水、包埋、切片以及苏木精-伊红(HE)染色,最后镜检。肾脏组织病理学评分分级标准参照文献[5],包括无(-)、极轻度(+)、轻度(++)、中度(+++)、重度(++++)和极重度(+++++)。
1.2.4 试验数据处理和分析 尿液生物标志物检测结果数据均使用同时期尿 CRE 数据进行标准化,并采用 GraphPad Prism 5 制作数据图例。
2 结果
2.1 给药后动物临床症状
给药剂量为 3 mg/kg 时,动物仅在给药第1 天发生轻度呕吐,食欲下降,随后恢复正常;而 4 和5 mg/kg 给药剂量时,动物自给药第1 天就开始发生严重呕吐、食欲下降、腹泻、脱水、体重下降、活动量减少等临床症状,4 mg/kg 动物在第6 天濒临死亡,进行解剖,而 5 mg/kg 动物在给药第10 天死亡。
2.2 肾脏组织病理学检查结果
组织病理学分析结果发现,给药剂量为 3 mg/kg动物的肾脏出现轻度肾小管变性、坏死和肾小管变性、再生,间质、炎性细胞浸润和肾小管蛋白管型(图1A),而在给药剂量为 4 mg/kg 和 5 mg/kg动物死亡解剖的组织病理学检查发现,这 2 只动物肾脏发生了中度肾小管变性、坏死或再生以及轻度的间质、炎性细胞浸润和肾小管蛋白管型(图1B)。
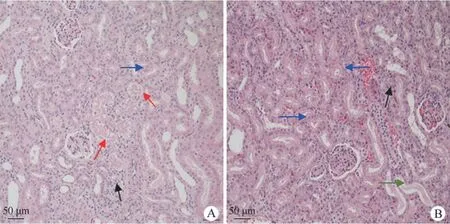
图1 Beagle 犬单次静脉注射不同剂量顺铂后肾脏组织病理学检查结果(A:3 mg/kg 给药剂量;B:5 mg/kg 给药剂量;红色箭头:指向肾小管上皮细胞变性、坏死部位;蓝色箭头:指向肾小管变性、再生部位;黑色箭头:指向间质、炎性细胞浸润部位;绿色箭头:指向肾小管蛋白管型部位)Figure 1 The results of histopathological examination for kidney in Beagle dogs after a single intravenous injection of different doses of cisplatin (A:The result from the animal with a dose of 3 mg/kg; B:The result from the animal with a dose of 5 mg/kg; Red arrow:points to the area of renal tubular epithelial cell deformation and necrosis; Blue arrow:points to the area of renal tubular deformation and regeneration; Black arrow:points to the interstitial and inflammatory cell infiltration area; Green arrow:points to the tubular protein cast)
2.3 血清肾损伤生物标志物的变化
传统血清肾损伤生物标志物分析结果显示,给药剂量为 3 mg/kg 的动物体内血清 BUN 和 CRE浓度,与给药前相比,只是略有轻微的升高,基本处于正常范围(图2);而 4 和 5 mg/kg 给药剂量的动物体内血清 BUN 和 CRE 发生了明显升高,与给药前相比,在第6 天,4 和 5 mg/kg 动物体内的 BUN 浓度分别升高了 12.5 和 15.8 倍,而CRE 升高了 7.9 倍和 6.1 倍(图2)。
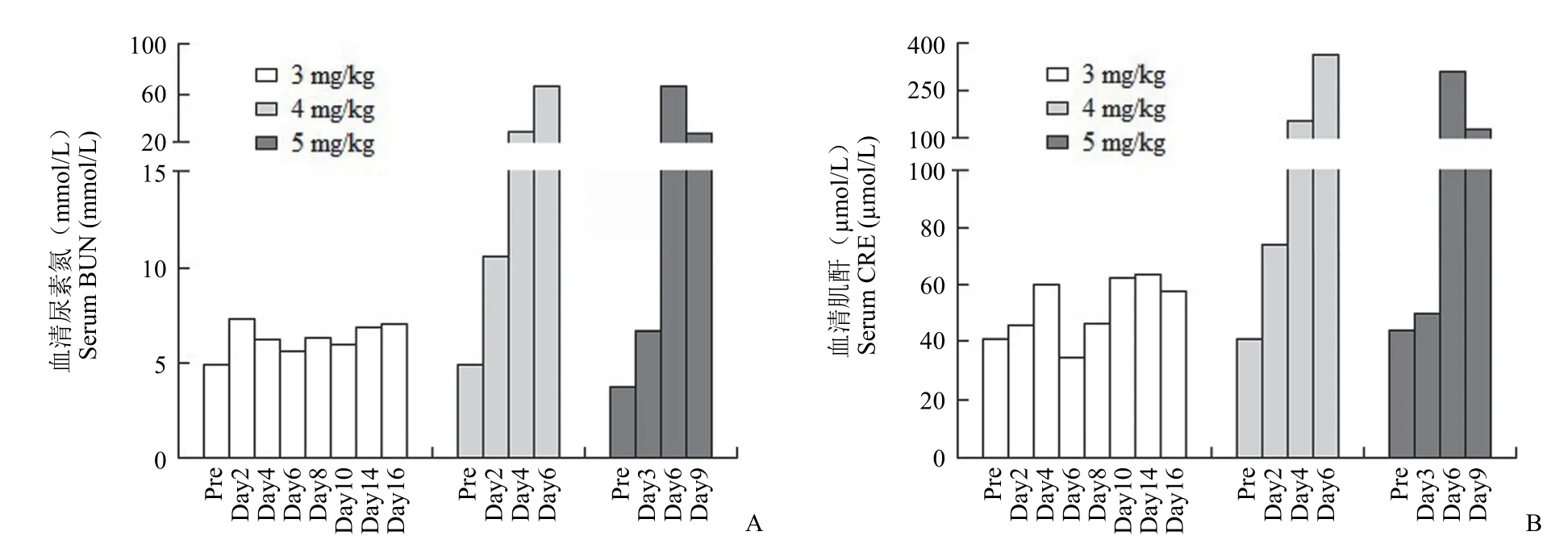
图2 Beagle 犬单次静脉注射不同剂量的顺铂后血清尿素氮(A)和肌酐(B)水平的变化Figure 2 Changes of serum BUN (A) and CRE (B) levels in Beagle dogs after a single intravenous injection of different doses of cisplatin
2.4 尿液生物标志物的变化
为了进一步评价 Beagle 犬急性肾损伤模型,对出现轻度肾损伤动物尿液中的生物标志物进行检测分析,结果显示给药剂量为 3 mg/kg 时,动物尿液中丛生蛋白在第2 天出现升高,并持续上升,给药第16 天与给药前相比升高了 80.3 倍;第4 天尿液中出现少量的白蛋白,在第8 天达到顶峰,随后逐渐下降(图3)。
而 Luminex 方法分析结果也发现其他两种新型生物标志物 OPN、MCP-1 在给药后也发生了明显的升高,给药第6 天,动物尿液中 OPN 浓度增加,并持续增长,第10 天 OPN 浓度为给药前6.5 倍。而 MCP-1 浓度从给药第6 天持续增长,到第16 天,增加倍数为给药前的 11.5 倍(图3)。
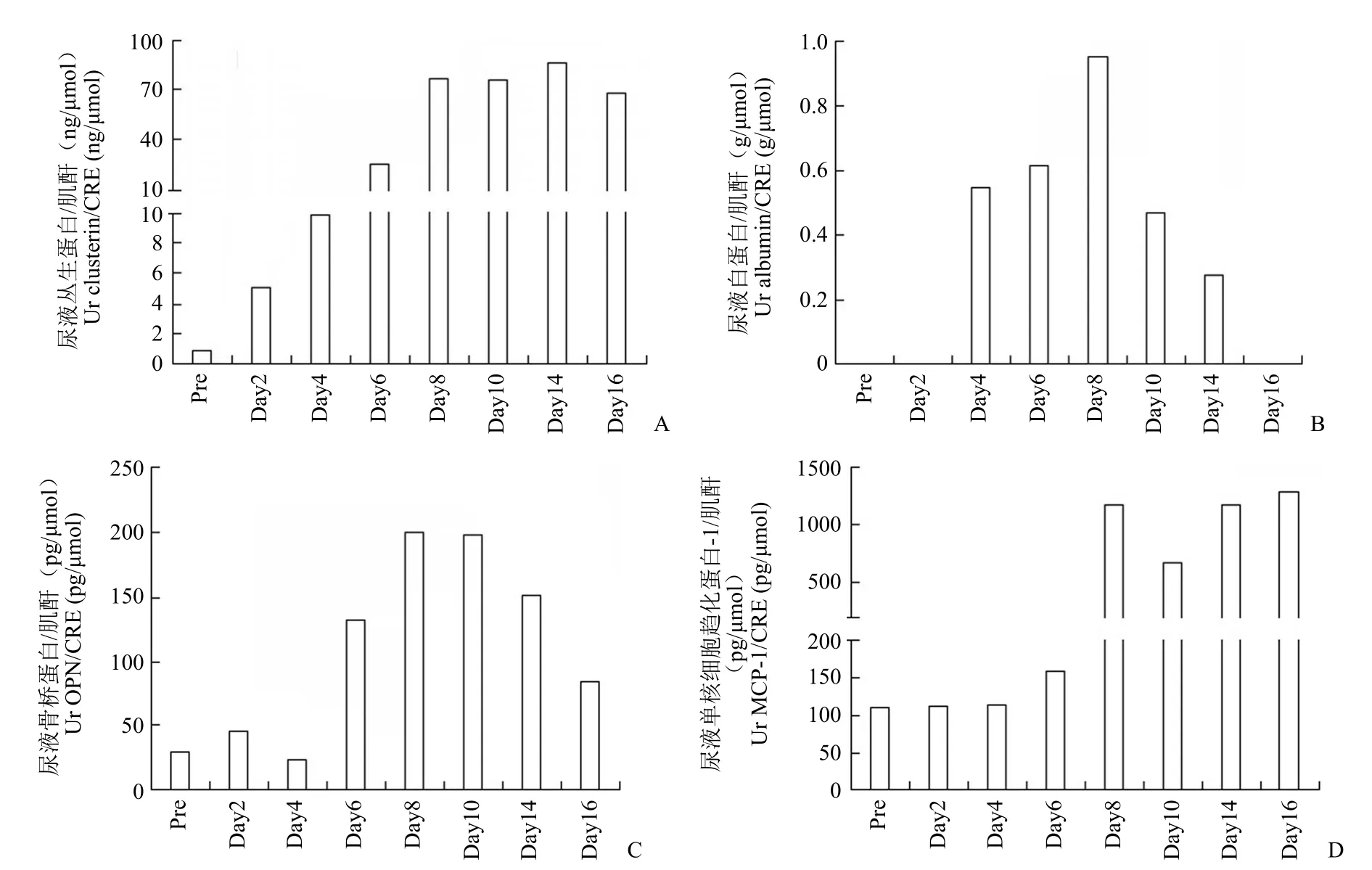
图3 Beagle 犬单次静脉注射 3 mg/kg 顺铂后尿液中生物标志物水平的变化(A:丛生蛋白;B:白蛋白;C:骨桥蛋白;D:单核细胞趋化蛋白-1)Figure 3 Changes of urine biomarker levels in Beagle dogs after a single intravenous injection of 3 mg/kg cisplatin (A:Clusterin;B:Albumin; C:OPN; D:MCP-1)
3 讨论
在大鼠 AKI 动物模型制备中,庆大霉素和顺铂为最常用的急性肾小管损伤模型的阳性药物,前期试验中通过连续 9 天给 Beagle 犬肌肉注射80 mg/kg 庆大霉素,成功建立了犬急性肾损伤模型[6]。尽管两者均可引起肾小管损伤,但顺铂不同于庆大霉素的是单剂量静脉注射就可引起典型肾脏病变,其肾毒性的机制主要通过下调肾脏转运蛋白介导的摄取以及基底膜外侧有机阳离子和阴离子转运蛋白,导致肾脏中顺铂的浓度远高于血清,尤其是在近端小管中[7-8]。顺铂在近端小管上皮细胞中积累后形成铂络合物,铂络合物与 DNA 相互作用,引起 DNA 单链和双链断裂,导致毛细血管扩张性共济失调症突变蛋白激酶活化,磷酸化并激活p53 蛋白,造成肾小管上皮细胞凋亡和坏死并伴有明显的炎症[9]。
有文献报道 Beagle 犬单次静脉注射 5 mg/kg顺铂可引起急性肾衰竭[10]。本研究中,我们选用的3、4 和 5 mg/kg 给药剂量下,动物肾脏均出现肾小管损伤病变,但发现动物在接受 4、5 mg/kg 给药剂量后,临床症状严重,且给药后 6~10 天死亡,表明给药剂量过大。而在 3 mg/kg 给药剂量下,传统的肾毒性标志物 BUN、CRE 升高幅度轻微,肾脏病变损伤程度为轻度,更适宜用于评估早期、灵敏的肾脏损伤标志物,因此建议 3 mg/kg 顺铂为Beagle 犬急性肾损伤模型的最佳给药剂量。
与以前发表结果相类似,传统血清肾损伤生物标志物 BUN 和 CRE 浓度,仅在肾损伤较为严重的 4 和 5 mg/kg 给药剂量动物的体内出现明显升高,而在 3 mg/kg 给药剂量动物体内仅略有轻微的升高,进一步表明在非啮齿类急性肾损伤模型中BUN 和 CRE 用于诊断肾损伤的不足[6]。
目前在大鼠动物模型中已批准丛生蛋白、白蛋白和肾损伤因子-1(Kim-1)等 8 种肾毒性生物标志物可以用于药物临床前安全性评价[11]。为了进一步评估新的肾毒性生物标志物在 Beagle 犬急性肾损伤模型中的变化,我们也测定了 3 mg/kg 顺铂给药剂量下动物尿液中丛生蛋白和白蛋白的浓度,发现这两个生物标志物在药物诱导肾损伤早期就出现明显改变,并且持续增长。在庆大霉素诱导犬急性肾损伤模型中也证实丛生蛋白浓度在发生肾损伤时显著性升高[6],进一步支持丛生蛋白可作为在犬动物模型中进行药物临床前的肾小管毒性安全性评价候选生物标志物。近些年,一些新的生物标志物不断被报道,例如 OPN 和 MCP-1,在啮齿类肾损伤动物模型和药物肾损伤病人的尿液中浓度显著升高[12-13]。本研究结果也发现 Beagle 犬在接受 3 mg/kg 顺铂给药后,动物尿液中 OPN 和MCP-1 明显增加,这些结果不仅进一步支持本研究所用建模的药物浓度的合理性,而且获得了两个生物标志物的动态变化数据,为后续研究提供了研究方向。
尽管本研究采用动物数量较少,且大动物之间可能存在个体差异,但整体肾损伤传统或四种新型标志物试验结果与动物的肾脏病理学检查结果一致。这些结果也表明 Beagle 犬单次静脉注射3 mg/kg 顺铂可成功建立急性肾小管损伤模型。事实上,基于本研究结果给药剂量为 3 mg/kg 顺铂建立急性肾小管损伤模型的其他新型肾毒性生物标志物及病理学结果也进一步证实其建模给药剂量的合理性(结果另文发表),这些研究结果为后续在非啮齿类动物中发现早期、灵敏、特异的药物临床前肾毒性生物标志物研究奠定基础。

