miR-20a靶向TLR4通路对巨噬细胞抗结核分枝杆菌感染作用的影响
王 玲,孟伟民
(1青海省第四人民医院呼吸五科,西宁 810000;2青海省第四人民医院重症医学科)
结核病是人类三大传染性疾病之一,结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)是引起结核病的病原菌,可侵犯全身各器官,以肺结核最为常见[1]。巨噬细胞是人体免疫细胞,是Mtb侵入机体的主要靶细胞,在Mtb感染宿主时,其可以通过吞噬作用、自噬、凋亡等机制对细胞内Mtb进行清除[2]。Toll样受体(Toll-like receptors,TLRs)在免疫反应和免疫逃逸中有重要作用,广泛分布于人体各种细胞表面[3]。机体在感染Mtb之后,巨噬细胞和树突细胞上的TLRs能够特异性识别Mtb上的病原体相关模式分子(pathogen associated molecular pattern,PAMP),促进细胞因子的合成与释放,诱导机体产生获得性免疫反应[4]。TLR4能够通过激活髓样分化因子88(myeloid differentiation factor 8,MyD88)依赖性通路和MyD88非依赖通路在Mtb感染巨噬细胞中发挥作用[5]。miRNA与细胞分化、细胞增殖、细胞凋亡等过程有关,多个研究表明miRNA通过调控TLR4通路调节巨噬细胞抗Mtb感染过程[6-8]。TLR4是miR-20a的一个下游靶基因[9],对miR-20a靶向调节TLR4信号通路在巨噬细胞抗Mtb感染的作用还不清楚。因此本研究通过检测巨噬细胞感染Mtb后miR-20a的表达,分析miR-20a靶向TLR4通路在巨噬细胞抗Mtb过程中的作用。
1 材料与方法
1.1 药品与试剂
THP-1人单核细胞株(SCSP-567),购自于中国科学院细胞库;H37Ra Mtb菌种,购自于美国BD公司;佛波酯(Phorbol 12-myristate 13-acetate,PMA)(货号:P8139)购自于美国Sigma公司;Lipofectamine 3000试剂盒(货号:L3000008),购自美国Invitrogen公司;RNAiso plus、PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR Premix Ex TaqTM Ⅱ(货号:9108Q、RR037、RR820Q),购自日本TAKARA公司;胎牛血清、青霉素-链霉素、RPMI-1640培养基、消化胰酶(货号:10099,15070063,61870036,25200056)购自美国Gibco公司;双荧光素酶报告基因检测试剂盒(货号:KFS303),购自北京百奥莱博科技有限公司;Bcl-2、Bim、TLR4、MyD88、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、p-MAPK、β-actin单抗(货号:4223,2933,14358,4283,4696,4370,8457),购自美国Cell Signaling Technology公司;Annexin Ⅴ-FITC细胞凋亡双染试剂盒、辣根过氧化物酶标记二抗、蛋白提取试剂盒、BCA蛋白定量试剂盒(货号:A0208、P0033、P0012、C1062),购自南通碧云天生物技术公司;mi20a、U6、miR-20a mimics、miR-20a mimics-negative control,生工生物工程(上海)股份有限公司合成;实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)仪,购自美国ABI公司;Nanodrop 2000、酶标仪、蛋白凝胶成像仪,购自美国Thermo Fisher公司;流式细胞仪,购自美国贝克曼库尔特公司。
1.2 实验方法
1.2.1 人源性单核细胞株THP-1培养 取1 ml冻存THP-1细胞37 ℃水浴中快速解冻,转移至离心管中,并加入9 ml RPMI-1640培养基,吸打混匀,1 000 r/min离心5 min,弃上清,转移至含有10%胎牛血清、100 U/ml青霉素-链霉素的RPMI-1640培养基中,37 ℃、5%CO2培养箱中培养传代。
1.2.2 THP-1源性巨噬细胞培养 将1.2.1中对数期细胞接种至6孔板中,并调节细胞浓度为6×105个/孔,100 ng/ml PMA处理THP-1单核细胞24 h,37 ℃、5%CO2培养箱中培养,细胞形态由单个圆形悬浮细胞转变为贴壁、形态不规则的贴壁细胞,THP-1单核细胞分化为巨噬细胞THP-1。
1.2.3 Mtb感染巨噬细胞THP-1 感染前1 d,将1.2.2中巨噬细胞THP-1接种至24孔板,调整细胞浓度为2×105个/孔。细胞分为未感染组(n=3)和感染组(n=3),按照感染复数MOI=10的H37Ra Mtb感染巨噬细胞THP-1,培养4 h,弃上清,每孔加入1 ml新鲜RPMI-1640培养基,继续培养,分别在感染0,6,12,24 h后,检测各组miR-20a的表达。
1.2.4 细胞转染及分组 取1.2.3中生长至对数期的感染组巨噬细胞THP-1,0.25%胰蛋白酶消化,接种至6孔板中,调整细胞浓度为6×105个/孔,细胞融合度达到80%时,更换为无血清RPMI-1640培养基。利用Lipofectamine 3000进行转染,操作严格按照试剂说明书。转染后用无血清RPMI-1640培养基继续培养24 h,并分为感染组(只含有THP-1细胞),阴性转染组(转染浓度为100 nmol/L的miR-20a mimics-NC),miR-20a mimics组(转染浓度为100 nmol/L的miR-20a mimics序列);另外选取未感染巨噬细胞THP-1作为未感染组。
1.2.5 CCK-8法检测细胞活力 取1.2.4中各组对数期细胞,调整细胞浓度为1×105个/ml,每孔100 μl加至96孔板中,每组设置6个重复,设置空白组仅添加细胞培养液,37 ℃、5%CO2培养箱中分别培养48 h后,加入10 μl CCK-8试剂,37 ℃避光培养2 h,弃上清,酶标仪450 nm波长处检测每孔吸光度OD值,计算细胞活力(%)=[(实验组OD值-空白组OD值)/(未感染组OD值-空白组OD值)]×100%。
1.2.6 流式细胞术检测细胞凋亡率 取1.2.4中各组对数期细胞,培养48 h后,调整细胞浓度为5×105个/ml,每组设置3个重复,吸取200 μl细胞悬液至离心管中,预冷PBS清洗细胞2次,加入5 μl FITC-Annexin Ⅴ,轻混均匀,遮光孵育15 min;加入PI染液,轻混均匀,流式细胞仪观察细胞凋亡情况。
1.2.7 实时荧光定量聚合酶链反应(quantitative real-time PCR,qRT-PCR)检测细胞中miR-20a的表达 按照RNAiso Plus说明书对1.2.3中不同时间MOI=10细胞及1.2.4各组细胞中RNA进行提取,分光光度计测定RNA浓度,按照试剂盒说明书对RNA进行反转录cDNA,之后进行qRT-PCR反应,反应条件为预变性95 ℃ 30 s,变性95 ℃ 30 s,退火60 ℃ 45 s,延伸72 ℃ 30 s,共计40个循环。以U6作为内参基因,采用2-ΔΔCt方法计算各组巨噬细胞THP-1中miR-20a相对表达量。引物设计见表1。
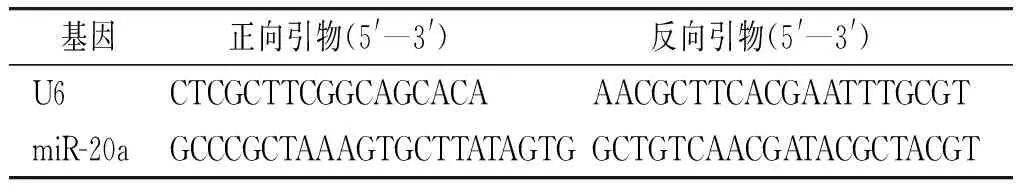
表1 引物序列
1.2.8 载体构建 Starbase数据库显示人TLR4基因3′UTR含与miR-20a的结合位点,对含结合位点TLR4区域进行扩增,连接到PGEM-T载体上,测序筛选;酶切并连至pGL4荧光素酶报告载体,构建pGL4-TLR4-3′UTR-WT质粒;以此质粒对模板进行定点缺失(Del:chr9 120477327-120477332位点)突变,测序确定突变成功,构建pGL4-TLR4-3′UTR-Del质粒。
1.2.9 双荧光素酶报告系统分析 测序验证成功的重组质粒pGL4-TLR4-3′UTR-WT、pGL4-TLR4-3′UTR-Del和miR-20a mimics-NC、miR-20a mimics分别共转染至巨噬细胞THP-1中,每组设置3个重复,转染6 h后,更换培养基。质粒共转染36 h后,弃去培养基,PBS洗涤细胞;每孔加入50 μl的1×PLB,震荡使细胞全部裂解;不透光96孔酶标板中每孔加上述上清液10 μl,加入100 μl双荧光素酶反应试剂Ⅱ,检测荧光素酶反应强度,记为A;测定结束后加100 μl Stop&Glo,检测内参海肾荧光素酶反应强度,记为B。A/B数值为荧光素酶相对活性。
1.2.10 蛋白免疫印迹(Western blot,WB)法检测蛋白表达 取1.2.4中各组细胞,培养48 h后调整浓度为5×105个/ml,每孔100 μl加至96孔板中,弃上清,PBS洗涤2次,重悬细胞,每组设置3个重复,蛋白提取试剂盒提取细胞总蛋白,BCA试剂盒测定总蛋白浓度,蛋白样品进行SDS-PAGE凝胶电泳,电泳结束后将蛋白转移至PVDF膜上,5%脱脂奶粉遮光封闭2 h;分别加入一抗稀释液(Bcl-2、Bim、TLR4、MyD88、p-MAPK、MAPK、β-actin),均为1 ∶1 000稀释,4 ℃孵育过夜,TBST洗膜3次,加入辣根过氧化物酶标记二抗稀释液(1 ∶2 000),室温孵育1 h,TBST洗膜3次。蛋白凝胶成像仪分析蛋白表达水平。
1.3 统计学方法
2 结果
2.1 Mtb感染巨噬细胞THP-1后miR-20a的表达
与未感染组比较,Mtb感染组巨噬细胞THP-1中miR-20a表达显著降低,且随着感染时间的增加,miR-20a表达显著下降,差异有统计学意义(P<0.05,见表2)。

表2 Mtb感染巨噬细胞THP-1后miR-20a的表达
2.2 转染效果检测
与未感染组比较,感染组miR-20a表达显著降低;与感染组和阴性转染组比较,miR-20a mimics组细胞miR-20a表达显著升高,差异有统计学意义(P<0.05,见图1)。
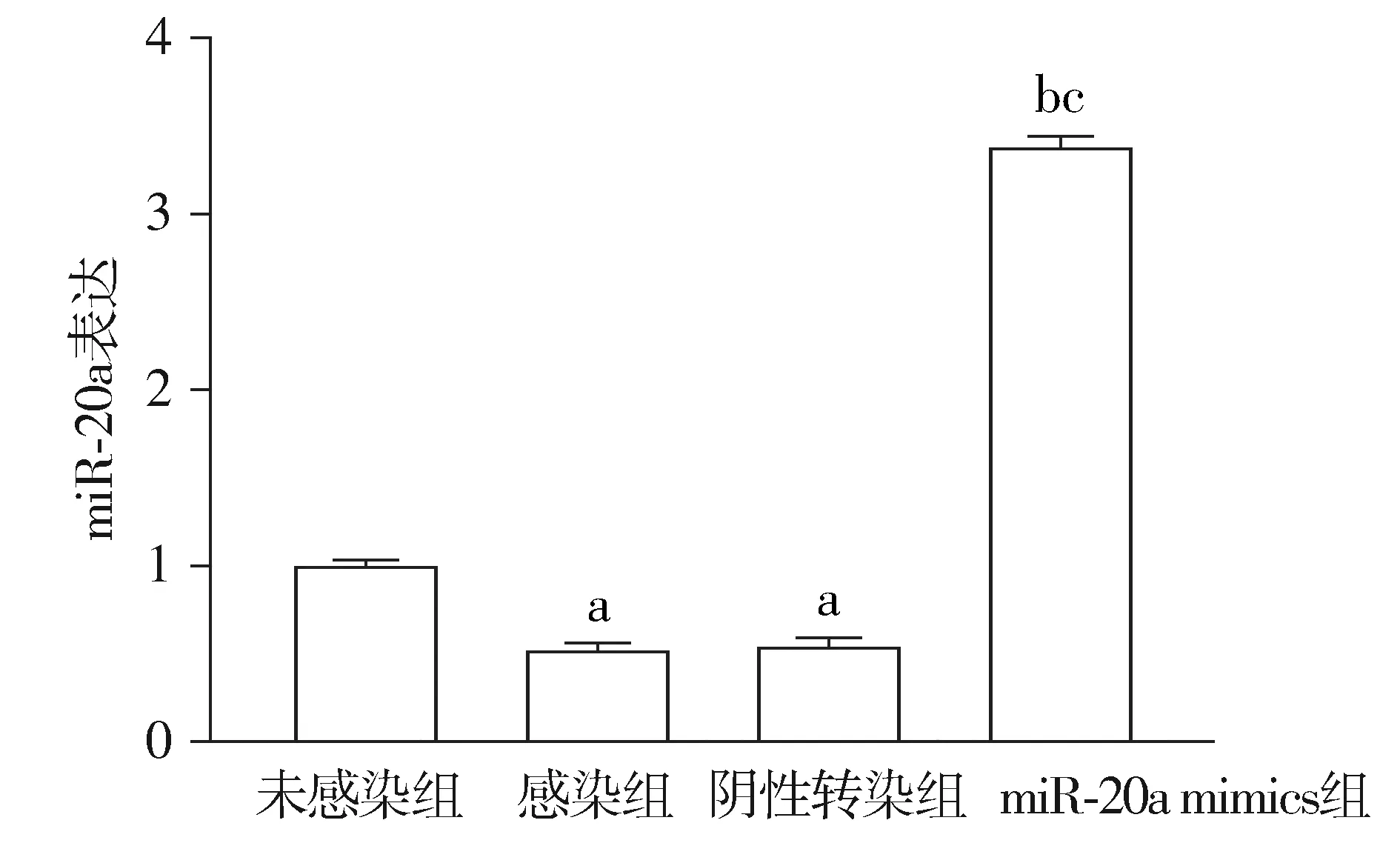
与未感染组比较,aP<0.05;与感染组比较,bP<0.05;与阴性转染组比较,cP<0.05图1 转染miR-20a mimics后巨噬细胞THP-1中miR-20a表达Figure 1 Expression of miR-20a in macrophages THP-1 after transfection with miR-20a mimics
2.3 miR-20a对巨噬细胞活力的影响
与未感染组比较,感染组细胞活力显著降低(P<0.05);与感染组和阴性转染组比较,miR-20a mimics组细胞活力显著升高,差异有统计学意义(P<0.05,见图2)。
2.4 miR-20a对巨噬细胞凋亡的影响
与未感染组比较,感染组细胞凋亡率显著升高(P<0.05);与感染组和阴性转染组比较,miR-20a mimics组细胞凋亡率显著降低,差异有统计学意义(P<0.05,见图3,4)。
2.5 miR-20a对巨噬细胞Bcl-2、Bim蛋白表达的影响
与未感染组比较,感染组细胞蛋白Bcl-2表达显著降低,Bim蛋白表达显著升高(P<0.05);与感染组和阴性转染组比较,miR-20a mimics组细胞蛋白Bcl-2表达显著升高,Bim蛋白表达显著降低,差异均有统计学意义(P<0.05,见表3,图5)。

与未感染组比较,aP<0.05;与感染组比较,bP<0.05;与阴性转染组比较,cP<0.05图2 miR-20a对巨噬细胞活力的影响Figure 2 The effect of miR-20a on cell viability of macrophages

与未感染组比较,aP<0.05;与感染组比较,bP<0.05;与阴性转染组比较,cP<0.05图3 miR-20a对巨噬细胞凋亡的影响Figure 3 The effect of miR-20a on apoptosis of macrophages

图4 流式细胞术检测miR-20a对巨噬细胞凋亡的影响Figure 4 The effect of miR-20a on apoptosis of macrophages by flow cytometry
表3 miR-20a对巨噬细胞中Bcl-2、Bim蛋白表达的影响

图5 miR-20a对巨噬细胞Bcl-2、Bim蛋白表达的影响Figure 5 Effect of miR-20a on Bcl-2, Bim protein expression in macrophages
2.6 miR-20a靶向调控TLR4基因的关系验证
Starbase(http://starbase.sysu.edu.cn/index.php)数据库预测结果表明,TLR4基因3′UTR区有miR-20a结合位点,位于chr9 120477327-120477332区域(见图6A)。荧光素酶报告基因结果表明,与NC-pGL4-TLR4-3′UTR-WT组比较,mimics-pGL4-TLR4-3′UTR-WT组荧光素酶活性显著降低,差异有统计学意义(P<0.05);mimics-p-GL4-TLR4-3′UTR-Del组荧光素酶活性无显著性变化,差异无统计学意义(P>0.05,见图6B)。
2.7 miR-20a对巨噬细胞TLR4通路蛋白表达的影响
与未感染组比较,感染组TLR4、MyD88、p-MAPK/MAPK水平显著升高(P<0.05);与感染组和阴性转染组比较,miR-20a mimics组巨噬细胞TLR4、MyD88、p-MAPK/MAPK水平显著降低,差异有统计学意义(P<0.05,见图7,表4)。

图6 双荧光素酶报告实验验证TLR4是miR-20a的靶基因Figure 6 Verification of target relationship between miR-20a and TLR4 by double luciferase reporter gene experiment

图7 miR-20a对巨噬细胞TLR4通路蛋白表达的影响Figure 7 Effect of miR-20a on TLR4 pathway protein expression in macrophages
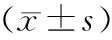
表4 miR-20a对巨噬细胞TLR4通路蛋白表达的影响
3 讨论
巨噬细胞是机体抵御细菌入侵的第一道防线,其可通过病原体的PAMP识别入侵病原体,从而启动抗感染的先天免疫反应[10]。细胞凋亡是程序性细胞死亡的过程,在传染性疾病中,病原体诱导的宿主细胞凋亡或抑制宿主细胞凋亡在疾病进展中有重要作用[11]。巨噬细胞凋亡是机体抵御Mtb感染的一种防御机制,能够抑制Mtb的生长,进而限制Mtb在体内的传播[12],另一方面,Mtb又能够通过抑制巨噬细胞的凋亡,保护宿主细胞,从而为其在胞内生长提供有利的环境[13]。本研究结果表明Mtb感染后,巨噬细胞THP-1活性显著低于未感染组,细胞凋亡率显著高于未感染组,WB实验进一步证明,与未感染组比较,感染后THP-1细胞抗凋亡蛋白Bcl-2表达显著降低,凋亡蛋白Bim表达显著增加,说明Mtb感染可能会影响巨噬细胞的凋亡,影响细胞活性。
miRNA在人类传染性疾病中有重要的作用,研究表明Mtb能够通过调节miRNA的表达,影响细胞凋亡进而逃避免疫应答[14]。miR-20a属于miR-17家族成员,多个研究表明miR-17家族成员与Mtb感染有关,如Kumar等[15]研究表明Mtb感染会导致miR-17的下调及其靶标Mcl-1和STAT3的上调,与Mtb感染的巨噬细胞的自噬有关。Guo等[16]研究表明miR-20a过表达抑制了巨噬细胞的自噬促进分枝杆菌的存活。本研究结果表明,感染Mtb后,巨噬细胞THP-1中miR-20a表达显著降低,细胞凋亡率显著升高,而转染miR-20a mimics后Mtb感染的巨噬细胞THP-1凋亡率显著降低,说明miR-20a过表达能够抑制巨噬细胞的凋亡,从而加快病情进展,miR-20a表达可能在巨噬细胞抗结核分枝杆菌感染中发挥重要作用。Zhang等[17]研究表明miR-20a过表达在Mtb诱导的巨噬细胞凋亡中起负调节的作用,抑制miR-20a表达可使感染的巨噬细胞THP-1更有效清除分枝杆菌,与本研究结果一致。本研究WB实验进一步表明miR-20a mimics组Mtb感染的巨噬细胞THP-1抗凋亡蛋白Bcl-2水平显著高于感染组,而凋亡蛋白Bim水平显著低于感染组,进一步提示miR-20a过表达抑制Mtb感染的巨噬细胞的凋亡。
本研究利用Starbase数据库对miR-20a靶基因进行预测发现,TLR4是miR-20a的潜在靶基因。TLR4基因位于9q 32-33,属于Ⅰ型跨膜蛋白,由细胞外区、跨膜区及细胞内区三部分组成,广泛分布于单核细胞、巨噬细胞、树突状细胞等各种细胞表面。TLR4能够与Mtb相互作用,与Mtb感染后巨噬细胞的免疫应答有关[18,19],Wu等[10]研究表明Mtb感染后巨噬细胞THP-1中TLR4、MyD88表达显著高于未感染组。本研究结果表明,miR-20a可显著抑制野生型TLR4荧光素酶活性,TLR4基因3′UTR区与miR-20a结合位点发生突变,可恢复荧光素酶活性,表明miR-30a可靶向调控TLR4基因。Chen等[20]研究表明miR-20a过表达显著抑制人主动脉内皮细胞HAEC中TLR4和MyD88的水平,miR-20a可能通过负调控TLR4通路保护HAEC免受炎症损伤。本研究进一步表明,与未感染比较,巨噬细胞THP-1感染Mtb感染后,其TLR4、MyD88蛋白表达显著升高,而在转染miR-20a mimics之后,与感染组和阴性转染组比较,miR-20a mimics组细胞TLR4、MyD88、p-MAPK蛋白表达显著降低,进一步说明miR-20a可能通过靶向调节TLR4信号通路进而影响巨噬细胞抗Mtb感染。
综上所述,miR-20a在Mtb感染巨噬细胞THP-1中呈低表达,miR-20a过表达可能通过下调TLR4信号通路促进Mtb感染的巨噬细胞THP-1的凋亡,miR-20a低表达可能是Mtb清除的潜在机制。本研究仅测定了巨噬细胞THP-1中miR-20a、TLR4通路蛋白的表达,而对miR-20a靶向TLR-4的具体机制需进一步研究验证。

