LRP5蛋白对子宫内膜异位症异位内膜的影响及机制
闫 坤,楚光华,王欣茹,胡春艳,刘 晨,陈 巍,李 佩
(1西北妇女儿童医院妇二科,西安 710061;2西安市中心医院普外科;3陕西省第二人民医院妇产科;*通讯作者,E-mail:1913115956@qq.com)
子宫内膜异位症是一种妇科常见病,这种疾病已成为不孕不育和盆腔疼痛的最重要原因之一,影响到6%-10%的育龄妇女[1,2]。虽然子宫内膜异位症被认为是一种良性疾病,但它在临床上仍表现出组织粘连、侵袭、血管生成等恶性生物学行为[3]。关于子宫内膜异位症的病因,目前学术界已经存在诸多种见解,包括月经逆行、体腔上皮化生、遗传和环境等因素。然而,子宫内膜异位症的发病机制仍不清楚。
研究报告称[4],子宫内膜异位组织中许多基因的异常表达可能会增加子宫内膜异位症的风险。因此,检测基因表达水平的改变,将为研究子宫内膜异位症的发病机制提供新的思路。低密度脂蛋白受体相关蛋白5(low-density lipoprotein receptor-related protein 5,LRP5)在损伤的大鼠动脉内膜和外膜区域过表达,它可抑制胶原的形成并诱导细胞迁移[5]。同时,LRP5也在不同类型的恶性肿瘤和诱导肿瘤细胞迁移和侵袭中过表达[6]。最近的研究[7]表明,LRP5通过促进上皮-间充质转化、促进细胞侵袭和通过众多信号通路诱导血管生成来触发癌症转移。
此外,LRP5通过靶向Wnt/β-catenin通路增加肝细胞癌、非小细胞肺癌和卵巢上皮癌的细胞侵袭力[8,9],该通路被认为是与细胞运动和增殖能力相关的关键途径。然而,LRP5是否参与子宫内膜异位症的进展及其潜在机制仍很不清楚。本研究旨在检测LRP5在子宫内膜细胞和组织中的表达水平,进一步揭示子宫内膜异位症发生发展的机制。
1 材料和方法
1.1 材料
DMEM/F-12培养基、胎牛血清、SYBR PreMix ExTaq试剂盒和增强型化学发光试剂购于Thermo fish公司(美国);胶原酶Ⅰ、青霉素、GAPDH、细胞计数试剂盒-8(CCK-8)、RNA-IMAX购于Sigma公司(德国);70 μm细胞滤网购于BD Falcon公司(美国);链霉素购于Supelco公司(美国);细胞培养板购于NEST公司(中国);恒温细胞培养箱购于AODEMA澳德玛公司(中国);TRIzol RNA分离试剂购于Invitrogen公司(美国);PrimeScript RT试剂盒购于Takara公司(日本);酶联免疫吸附分析(ELISA)试剂盒购于上海酶联生物科技有限公司;Transwell小室购于Corning公司(美国);聚碳酸酯过滤器购于默克Millipore公司(美国)。LRP5小干扰RNA(siRNA;si-LRP5)和阴性对照siRNA(si-NC)由生工生物工程(上海)股份有限公司(中国上海)合成。LRP5抗体、β-catenin抗体、CD44抗体、CyclinD1抗体、MM7抗体、c-myc抗体、微管蛋白抗体以及抗鼠/抗兔二抗购自Cell Signaling公司(美国)。
1.2 方法
1.2.1 标本采集、制备及分组 在位子宫内膜组织和异位子宫内膜组织的标本分别取自2019年1-12月在本院接受腹腔镜卵巢子宫异位内膜囊肿切除术和行常规宫腔镜检查的20例妇女[平均年龄(31.56±4.23)岁]的卵巢囊肿和子宫内膜组织标本。根据美国生殖医学会修订的子宫内膜异位症分类[10],所有患者均被确诊为Ⅲ-Ⅳ期子宫内膜异位症。对照子宫内膜标本取自20例[平均年龄(30.62±3.72)岁]接受宫腔镜治疗子宫纵隔的妇女。此外,在手术前从子宫内膜异位症组和对照组患者采集了血清样本。
所有组织和血清标本在收集后30 min内用于细胞培养或放置在-80 ℃下保存。子宫内膜异位组织的纳入标准为:月经周期正常,子宫内膜无肿瘤、息肉,无内分泌疾病或急性炎症,在过去6个月内未接受激素治疗。所有涉及人体血液和组织样本的实验获得本院医院伦理委员会的批准,研究参与者在样本采集前签署了书面知情同意书。
为确认异位内膜组织中LPR5的mRNA和蛋白表达水平是否发生改变,将患者子宫内膜组织标本分为在位内膜组(在位组,9例)和异位内膜组(异位组,11例),取正常子宫内膜组织作为对照组(20例)。为评价LRP5在子宫内膜异位症进展中的作用,将异位子宫内膜间质细胞(ectopic endometrial stromal cells,EESC)分别转染LRP5 siRNA(si-LRP5组)和空质粒的阴性对照(si-NC组)。
1.2.2 细胞培养 将5例腹腔镜卵巢囊肿切除术后的异位内膜组织置于DMEM/F-12培养基(Gibco)中,切成小块,在37 ℃恒温水浴锅中用胶原酶Ⅰ消化1 h,然后用70 μm的滤网去除残留组织碎片和其他杂质。2 500 r/min离心8 min后,再悬浮于含10%胎牛血清(FBS;Gibco)和1%青霉素-链霉素的DMEM/F-12培养基中。随后,将细胞悬液转移到6孔板中并在37 ℃含5% CO2的恒温细胞培养箱中进行培养。
1.2.3 cDNA与RT-qPCR分析LRP5表达水平 将保存的组织样本从-80 ℃转移到4 ℃,选取直径约5 mm的组织,用TRIzol RNA分离试剂(InvitrogenTM)提取总RNA;PrimeScript RT试剂盒(Takara)用于cDNA合成。使用SYBR PreMix Ex Taq试剂盒(Thermofish)进行实时定量PCR(RT-qPCR)反应。每个组织样本重复3次实验,选择GAPDH作为内参基因。用于RT-qPCR反应的引物序列均从GeneBank中检索,并由生工生物工程(上海)股份有限公司(中国上海)合成。引物序列如下:LRP5-F,5′-AACGTGGTCATCTCCGGCCTGGTCTCT-3′;LRP5-R,5′-GGGGTCCAAGGCGATGGCCCTCGGCT-3′;GAPDH-F,5′-GCACCGTCAAGGCTGAAC-3′;GAPDH-R,5′-TGGTGAAGACGCCAGTGGA-3′。采用2-ΔΔCt方法计算目的基因的相对表达量。
1.2.4 Western blotting检测蛋白表达水平 根据文献[11]中的方法进行Western blotting实验。收集内膜组织样本或细胞,使用含有蛋白酶抑制剂的RIPA裂解液进行裂解处理,然后低温高速离心收集蛋白样品,使用BCA分析试剂盒测量蛋白浓度,总蛋白(20 μg)用10% SDS-PAGE分离,然后转移到PDVF膜上,并在室温下用5%脱脂牛奶封闭1 h;然后将膜与一抗LRP5(1 ∶1 000)、β-catenin(1 ∶5 000)、CD44(1 ∶1 000)、CyclinD1(1 ∶1 000)、MM7(1 ∶1 000)、c-myc(1 ∶1 000)和Tublin(1 ∶5 000)在4 ℃下孵育过夜。随后,将它们与抗鼠/抗兔二抗(1 ∶10 000)在室温下孵育1 h。使用增强型化学发光试剂检测结合抗体复合物,并使用ImageJ软件将微管蛋白表达归一化后,用条带密度计法测定相对蛋白表达量。每个组织或细胞样本重复3次实验。
1.2.5 酶联免疫吸附试验和siRNA转染分析LRP5的相对水平 血清中可溶性LRP5浓度用酶联免疫吸附分析法(ELISA)进行测定。将70%融合的异位子宫内膜间质细胞(EESC)接种到6孔板中,按照说明书,将siRNA与RNA-IMAX共转染到细胞中。转染72 h后,收集细胞,使用含蛋白酶抑制剂的RIPA裂解液进行裂解出来,然后低温高速离心收集蛋白样品,经BCA分析试剂盒测量蛋白浓度后,总蛋白(20 μg)用10% SDS-PAGE分离,然后转移到PDVF膜上,并在室温下用5%脱脂牛奶封闭1 h;然后将膜与方法1.2.4涉及的一抗在4 ℃下孵育过夜。随后,将它们与抗鼠/抗兔二抗(1 ∶10 000)在室温下孵育1 h。使用增强型化学发光试剂检测结合抗体复合物,并使用ImageJ软件将微管蛋白表达归一化后,用条带密度计法测定相对蛋白表达量并分析转染效率。每个细胞样本重复3次实验。
1.2.6 细胞计数试剂盒-8(CCK-8)法测定细胞增殖 为评估转染72 h后EESC的增殖能力,将细胞接种于96孔板中,每孔约4×103个细胞,然后用si-NC或si-LRP5做转染处理。按照细胞计数试剂盒-8(CCK-8)说明书方法测定,使用Varioskan Flash微板读取器(Thermo Science)分别在0,1,2,3,4 d测量450 nm处的吸光度变化。每组细胞样本进行3次重复实验。
1.2.7 Transwell和Matrigel分析细胞迁移和侵袭情况 使用Transwell小室和孔径8 mm的聚碳酸酯过滤器进行Transwell迁移和Matrigel侵入分析。将si-LRP5或si-NC转染EESC 48 h,然后分别以4×104和1×105个细胞/室悬浮于200 μl无血清DMEM/F-12培养液中进行迁移和侵袭实验。随后将悬浮细胞分别转接含或不含Matrigel涂层至顶室。同时,将含有10%胎牛血清的500 μl DMEM/F-12放入底室。在37 ℃孵育24 h(迁移)或48 h(侵袭)后,取出保留在膜表面的细胞,用0.1%结晶紫染色,在光学显微镜下观察(×200)。从每个腔室中随机选择5个视野,并使用ImageJ软件计数每个视野中的细胞数量,取平均值。每组细胞样本进行3次重复实验。
1.2.8 伤口划痕试验分析细胞愈合情况 将细胞接种于6孔板中,然后用si-LRP5或si-NC转染细胞,在培养箱中培养48 h,待EESC的细胞密度大于或等于95%,然后用200 μl无菌移液管的尖端刮擦细胞单层伤口。然后在无血清DMEM/F-12培养基中饥饿培养12 h,分别在0 h和12 h时间点于光学显微镜下(×100)采集图像。使用ImageJ软件计算细胞单层上愈合区域的大小,并使用ImageJ软件分析计算伤口面积及愈合面积(打开ImageJ软件,对划痕图片进行Process->Smooth平滑处理后,进行Process->Find Edges寻找边缘,然后进行划痕面积分析,即可计算伤口或愈合面积)。其相对伤口面积=转染后12 h的伤口面积/转染后0 h的伤口面积;其相对愈合面积=转染后12 h的愈合面积/转染后0 h的愈合面积。每组细胞样本进行3次重复实验。
1.2.9 流式细胞术和荧光激活细胞分选分析细胞周期 为进行流式细胞术分析,取对数生长期的EESC细胞,按1×105个细胞/ml以1 ml接种于100 mm培养皿内;24 h后,将si-LRP5或si-NC转染EESC并继续培养48 h。收集细胞,并用低速离心机离心(1 000 r/min,5 min);使用预冷的PBS洗涤细胞2次后,加入3.5 ml无水乙醇混匀细胞,于4 ℃固定30 min后,再次使用预冷的PBS洗涤细胞;然后加入200 μl和2 μl RNA酶于37 ℃孵育30 min,加入PI进行避光染色30 min后,进行流式细胞术分析。使用细胞周期染色试剂盒和FACS系统(美国)对转染的EESC进行荧光激活细胞分选(FACS)。每个细胞样本进行3次重复实验。
1.3 数据统计分析
采用SPSS19.00软件进行统计学检验,所有数据均以平均数±标准差表示。两组间比较进行t检验分析,多重比较采用单因素方差分析,然后进行Newman-Keuls检验,P<0.05表示差异有统计学意义。
2 结果
2.1 LRP5在子宫内膜异位组织和血清中高表达
与在位组和对照组相比,异位组患者子宫内膜异位组织中LRP5的mRNA和蛋白表达水平均显著增加(P<0.01,见图1)。ELISA法检测血清可溶性LRP5浓度,结果显示,子宫内膜异位症患者血清中LRP5浓度明显高于对照组(P<0.01,见图2)。
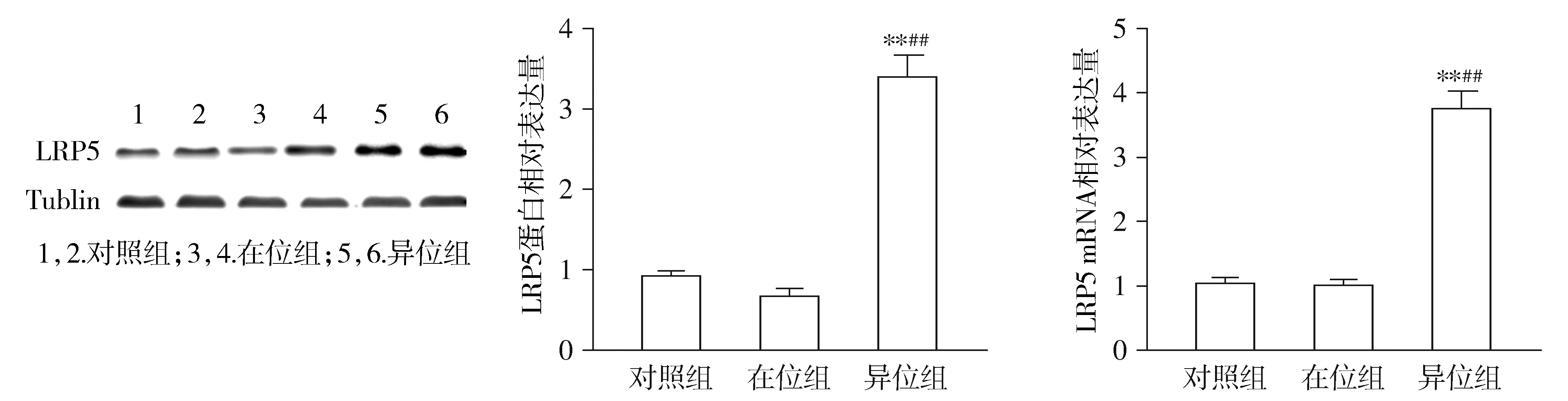
A.Western blotting检测LRP5的表达 B.RT-PCR检测LRP5 mRNA表达水平与对照组比较,**P<0.01;与在位组比较,##P<0.01图1 LRP5在各组子宫内膜中的表达Figure 1 The expression of LRP5 in endometrium
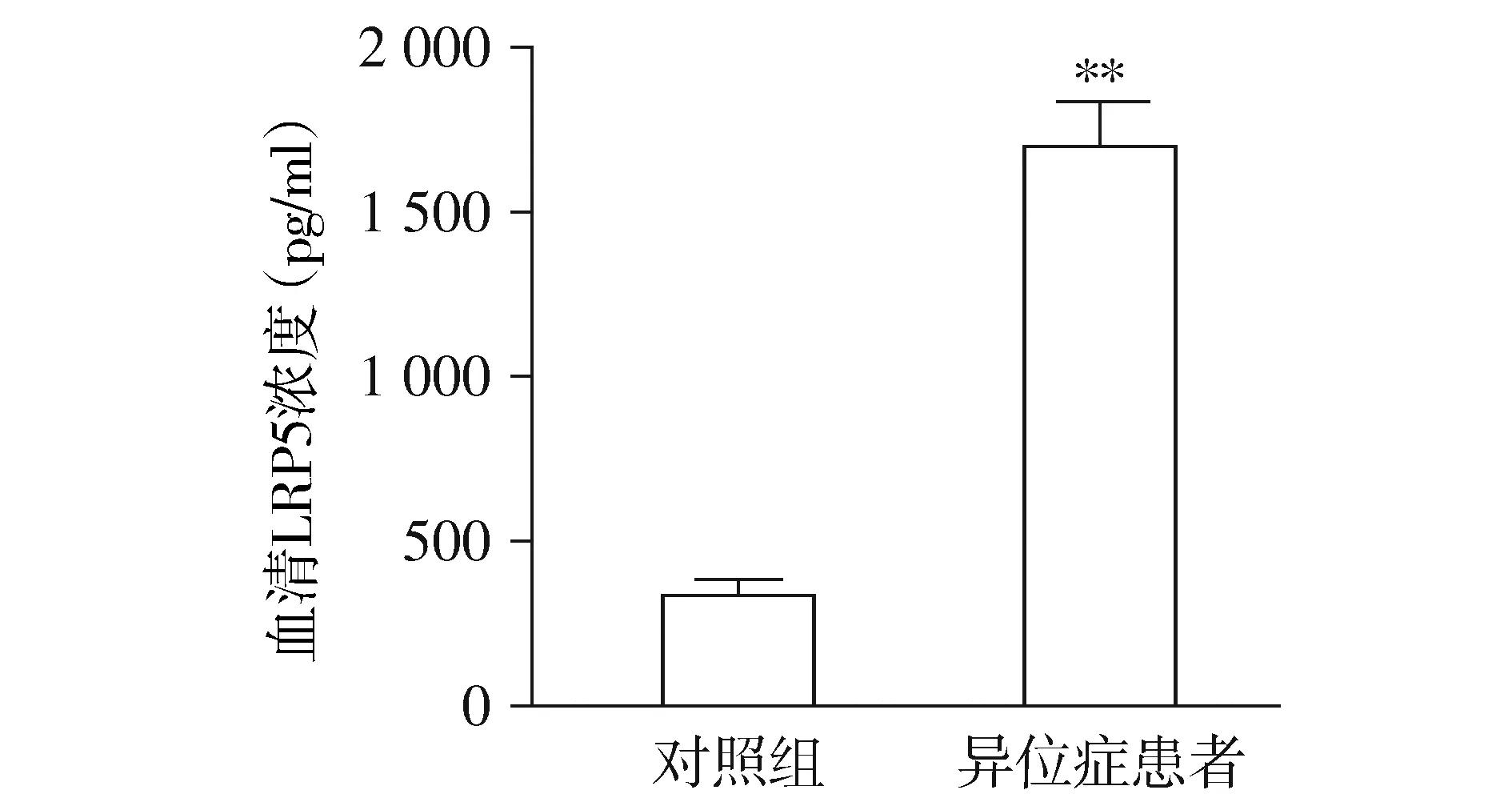
与对照组比较,**P<0.01图2 异位症患者血清中可溶性LRP5的含量变化Figure 2 Content of soluble LRP5 in serum of endometriosis by ELISA
2.2 LRP5基因敲除降低EESC体外增殖能力
CCK-8检测结果显示,从第2天起,si-LRP5组EESC的增殖能力均显著低于si-NC组(P<0.01,见图3)。
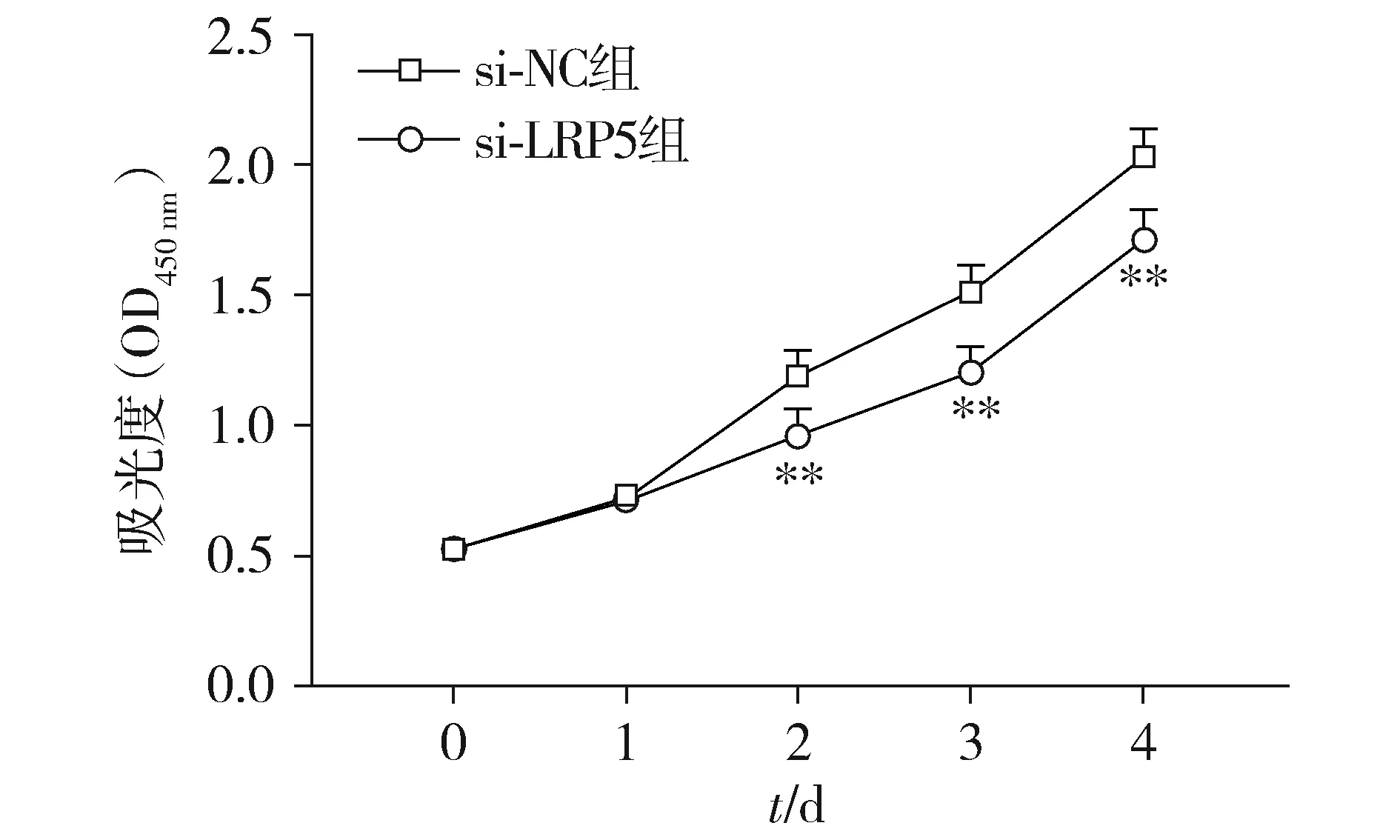
与si-NC组比较,**P<0.01图3 CCK-8检测si-NC组和si-LRP5组EESC的增殖情况Figure 3 Proliferation of EESC in si-NC group and si-LRP5 group by CCK-8
2.3 LRP5基因敲除降低EESC体外迁移和侵袭能力
Western blotting分析结果显示,si-LRP5组EESC中LRP5的表达水平相较于si-NC组明显降低(P<0.01,见图4)。伤口划痕试验以及Transwell迁移和侵袭试验结果显示,与si-NC组相比,si-LRP5组EESC的迁移和侵袭能力显著降低(P<0.01,见图4,5)。
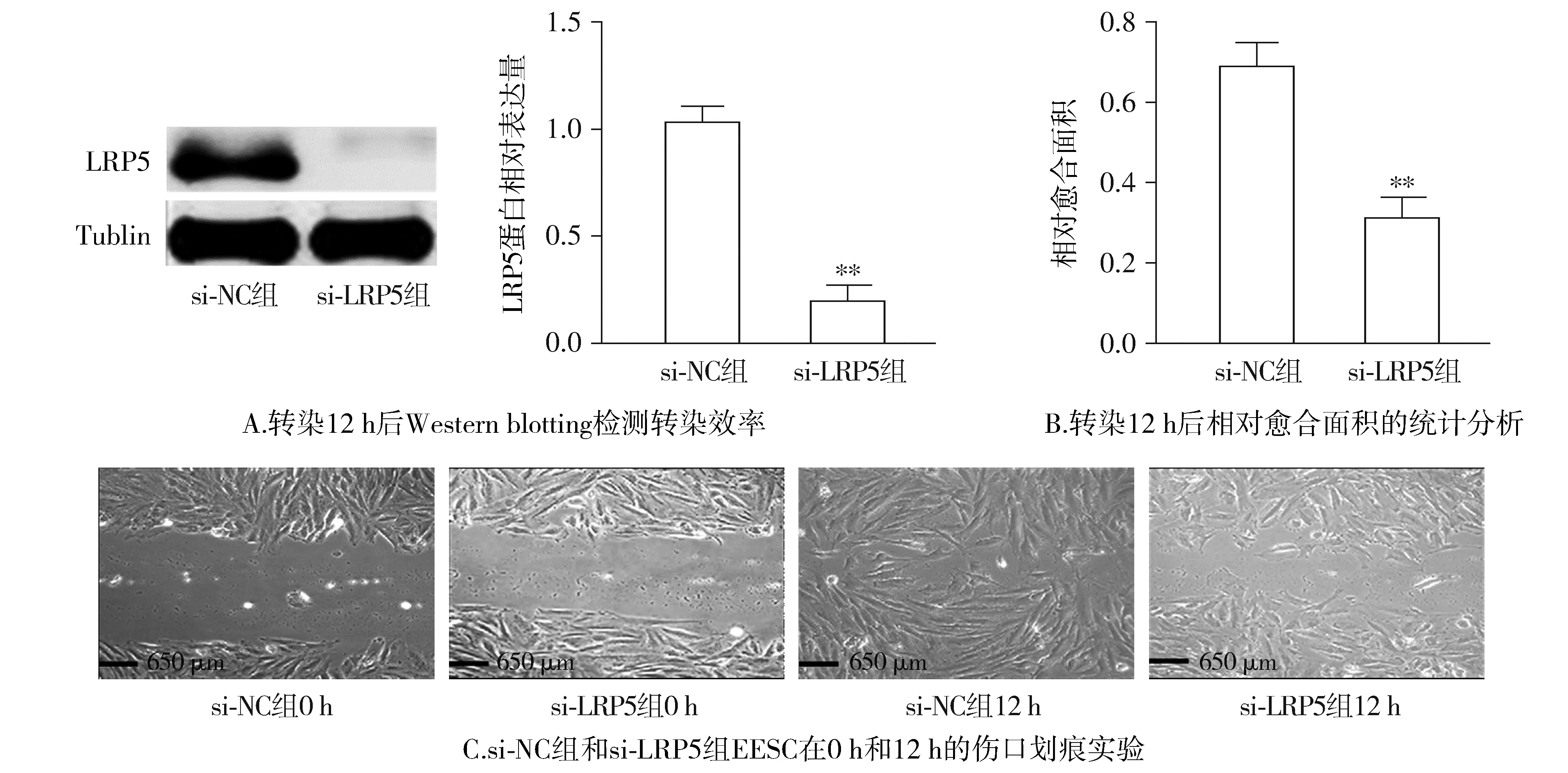
与si-NC组比较,**P<0.01图4 LRP5基因敲除后对蛋白表达及细胞迁移能力的影响Figure 4 Effect of LRP5 gene knockout on protein expression and cell migration
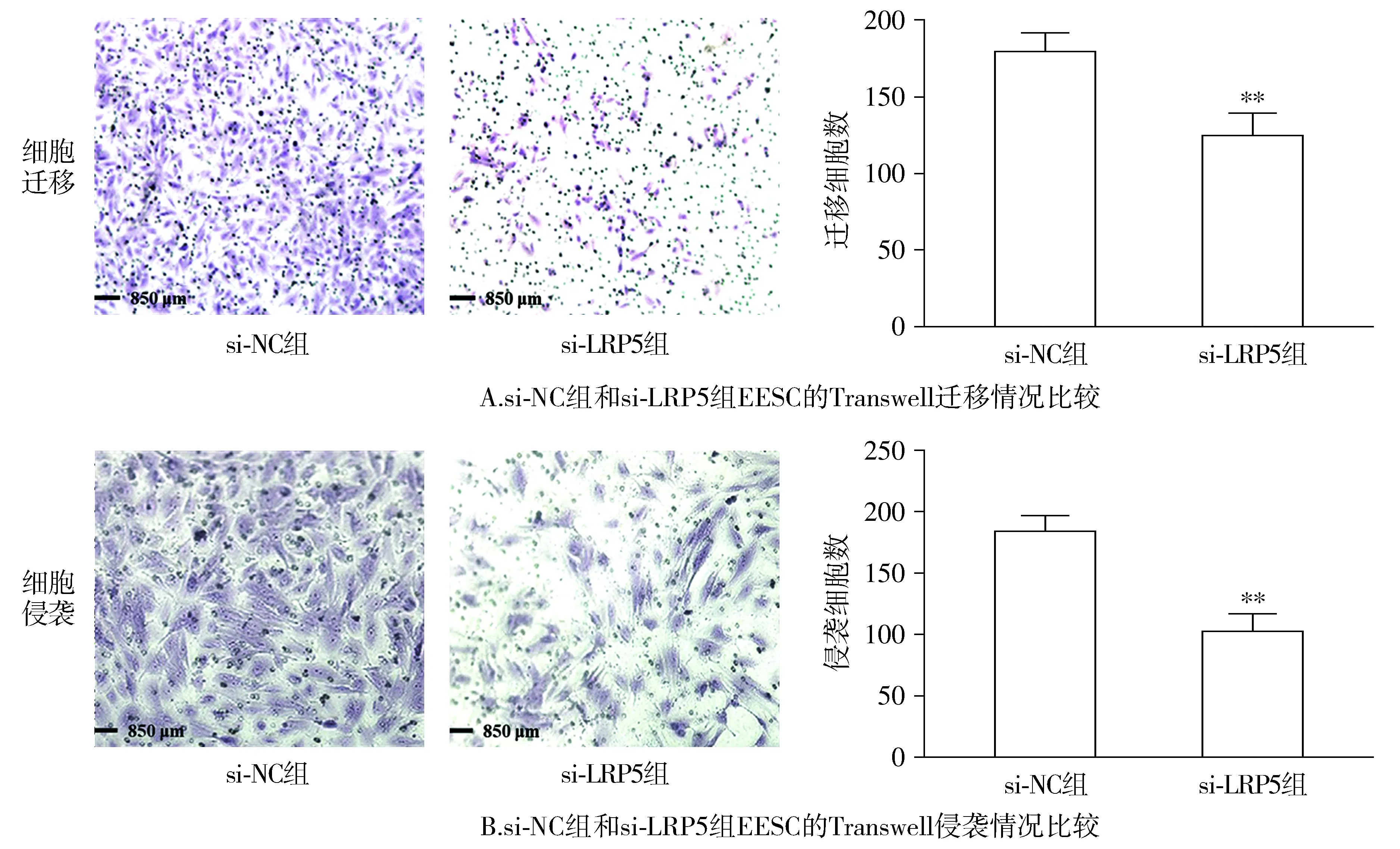
与si-NC组比较,**P<0.01图5 LRP5基因敲除对异位子宫内膜间质细胞体外迁移和侵袭能力的影响Figure 5 Effect of LRP5 gene knockout on migration and invasion of ectopic endometrial stromal cells in vitro
2.4 LRP5基因敲除降低EESC S期细胞的比例
流式细胞仪分析结果显示,与si-NC组比较,si-LRP5组EESC中G1期细胞比例较高,S期细胞比例较低(P<0.01),而G2/M期细胞变化不显著(P>0.05,见图6)。
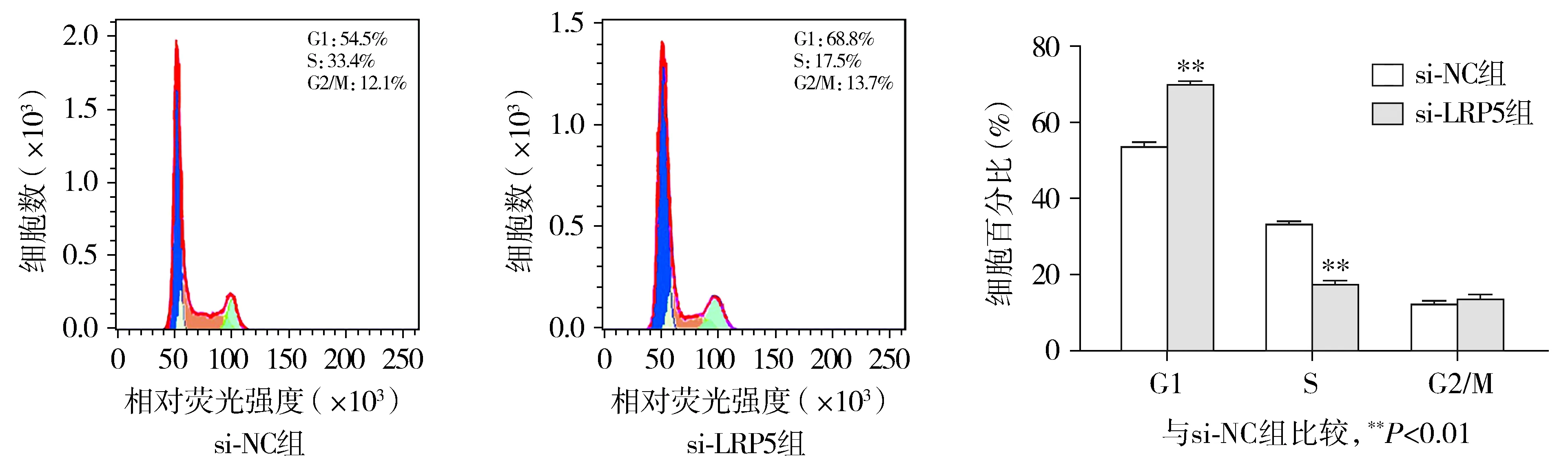
图6 si-NC组和si-LRP5组EESC在不同细胞周期时的比例Figure 6 Ratio of EESC in different cell cycles in si-NC group and si-LRP5 group
2.5 下调LRP5表达对Wnt/β-catenin通路的影响
Western blotting对Wnt/β-catenin通路蛋白β-catenin、MMP7、c-myc、CD44和CyclinD1的检测结果显示,转染72 h后,与si-NC组相比,si-LRP5组EESC中β-catenin、MMP7、c-myc、CD44和CyclinD1的蛋白表达水平均显著降低(P<0.01,见图7)。
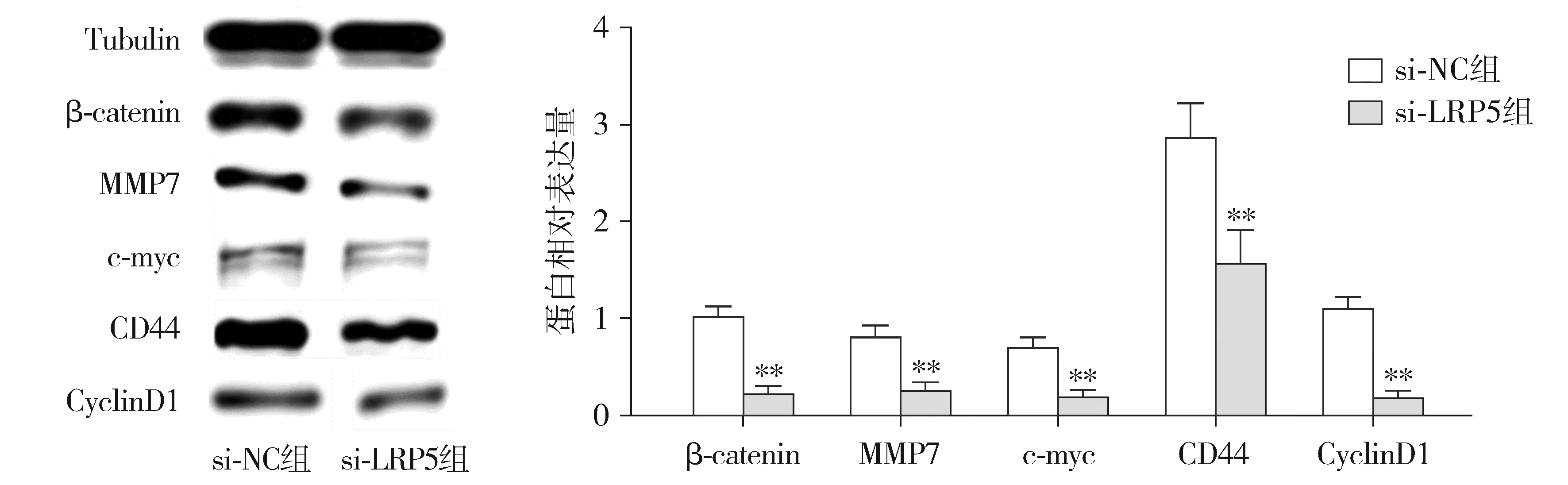
与si-NC组比较,**P<0.01图7 LRP5基因敲除对Wnt/β-catenin通路蛋白表达的影响Figure 7 Effect of LRP5 gene knockout on Wnt/β-Catenin pathway protein expression
3 讨论
虽然子宫内膜异位症通常被认为是一种良性疾病,但异位内膜细胞可以表现出恶性的生物学行为,类似于肿瘤细胞[12,13]。这些恶性行为是由一系列因素诱发,这些因素在子宫内膜异位症的发生发展中起至关重要的作用。
此前的研究表明,在子宫内膜异位组织和正常子宫内膜之间,许多基因的表达水平会发生变化,这与子宫内膜细胞的恶性行为有关[14,15]。有报道称,LRP5在骨髓瘤和卵巢癌中的表达较高,促进了细胞的增殖、迁移和侵袭[16,17]。
然而,目前对LRP5与子宫内膜异位症的病理关系知之甚少。因此,本研究通过检测子宫内膜组织中LRP5的mRNA和蛋白表达水平,探讨LRP5在异位子宫内膜间质细胞的(EESC)增殖、迁移和侵袭能力中的作用。本研究结果表明,LRP5在异位内膜组织中的表达高于正常子宫内膜组织,而在位内膜组织中的表达水平与正常子宫内膜组织相比无明显差异。此外,LRP5基因敲除还影响EESC的增殖、迁移和侵袭。综上所述,LRP5可能在子宫内膜异位症的发病中起促进作用。
Wnt途径是一条在进化上高度保守的途径,影响许多细胞过程,如增殖、分化和自我更新等[18]。最具特征性的Wnt经典途径是Wnt/β-catenin途径,该途径需要β-catenin的核转位来启动细胞内信号转导[19]。在细胞核内,β-catenin可以与转录因子结合,从而影响Wnt靶基因的水平,如CD44、c-myc、MMP7和细胞周期蛋白D1(CyclinD1)[20]。有研究报道,通过靶向c-myc和CCND1可加速肿瘤细胞增殖,导致细胞周期调节异常和细胞凋亡[21]。Alapati等[22]的研究结果表明,LRP5可通过Wnt/β-catenin途径诱导肝细胞癌的增殖、迁移和侵袭。因此,本研究重点探究了LRP5与Wnt/β-catenin通路的调控关系,结果表明与转染si-NC相比,转染si-LRP5的EESCz中β-catenin、MMP7、c-myc、CD44和CyclinD1的蛋白表达水平均显著降低。提示LRP5可能通过Wnt/β-catenin途径诱导EESC的增殖、迁移和侵袭能力。
综上所述,LRP5在子宫内膜异位组织中高表达,并通过Wnt/β-catenin途径在EESC的增殖、迁移和侵袭过程中发挥重要作用。然而,仍需要更多的研究来确定LRP5在子宫内膜异位症进展过程中的具体机制,以及它作为子宫内膜异位症生物标志物和治疗靶点的潜力。

