基于TRPV4通路探讨针刀对兔膝骨关节炎软骨细胞凋亡的影响
曾维铨,刘 晶,连晓文,林巧璇,卢莉铭,郭泽兴,杨金硕,陆润铭,修忠标,4*
(1.福建中医药大学附属康复医院,福建 福州350003;2.福建中医药大学附属人民医院,福建 福州350004;3.福建中医药大学中医学院,福建 福州350122;4.中医骨伤及运动康复教育部重点实验室,福建 福州350122)
膝骨关节炎(knee osteoarthritis,KOA)是临床常见骨关节病,有效延缓软骨退变进程是临床防治KOA亟待解决的 难题[1],调节骨骼肌功能、恢复膝关节筋骨平衡是防治KOA有效策略[2]。针刀疗法擅长松解慢性损伤肌肉、韧带粘连、瘢痕和疏通堵塞,具有良好力学调节作用[3-4],可有效缓解KOA关节疼痛和改善关节功能[5],然而针刀治疗KOA的力学调节机制尚不明确。研究表明膝关节筋骨失衡导致的异常软骨应力能活化香草素受体亚家族4(transient receptor potential vanilloid 4,TRPV4)通路,促进软骨细胞凋亡[6]。因此,本研究通过改良Videman法建立KOA兔模型,从TRPV4通路介导软骨细胞凋亡的角度入手,探讨针刀治疗KOA可能的作用及机制。
1 实验材料
1.1 实验动物 健康雄性6月龄新西兰大白兔24只,体质量(2.0±0.5)kg,订购于上海松联实验动物责任有限公司,生产许可证号:SCXK(沪)2017-0008,委托福建省中医药研究院实验动物中心代购并饲养,合格证号:SYXK(闽)2016-0005。实验动物单笼喂养,饲养房温度20~25℃,湿度30%~60%,自然光照,自由进食、饮水。本实验已通过福建省中医药研究院动物实验伦理委员会批准(批件号:FJATCMIAEC2019037),整个实验过程中对动物的各种处理均遵照中华人民共和国科技部2006年颁布的有关动物的使用及伦理学规定。
1.2 实验试剂HE染色试剂盒(北京索莱宝科技有限公司);TRPV4抗体(美国abcam公司);Caspase-3抗体(北京博奥森生物技术有限公司);二抗(武汉三鹰生物技术有限公司);RN54-EASYspin Plus骨组织RNA快速提取试剂盒(北京爱德莱生物科技有限公司);mRNA逆转录试剂盒(中国北京康为世纪有限公司);戊巴比妥钠、10%EDTA(上海国药集团化学试剂有限公司);4%多聚甲醛、10% EDTA、0.9% NaCl注射液(南京丁贝生物有限公司)。
1.3 实验仪器 一次性使用0.4 mm×40 mm无菌小针刀(江西老宗医医疗器械有限公司);光学显微镜、自动脱水机、组织包埋机、Leica 2025石蜡切片(德国Leica公司);高分子石膏(陕西安信医学技术开发有限公司);普通石膏(浦江健宇卫生材料有限公司);手术刀片及相关器械(上海医疗器械批发有限公司);一次性包埋盒、包埋模具(上海源叶生物技术有限公司);粘附载玻片、盖玻片(江苏世泰实验器材有限公司)。
2 实验方法
2.1 分组与造模 新西兰大白兔适应性饲养1周后,按照体质量进行编号,采用随机数字表法分为空白组、模型组、针刀组,每组各8只。参照本团队前期研究的改良Videman法[7],将兔子仰卧于固定架上,膝前放置石膏托,高分子石膏绷带单层螺旋缠绕,保持膝关节伸直中立位0°,踝关节背曲60°,最后使用防啃咬绷带环形缠绕高分子石膏表面。造模6周后,膝关节Lequesne MG行为学评分增高,X线和MRI影像学检测示关节间隙变窄、软骨面欠光滑,则造模成功。
2.2 干预 造模成功1周后,针刀组依据《中国经筋学》[8]膝关节经筋病灶点命名及定位,根据兔的骨度分寸,选取治疗点“鹤顶次”“髌外上”“髌内上”“髌外下”“髌内下”“阴陵上”。施术部位消毒,铺无菌洞巾,采用一次性0.4 mm×40 mm无菌小针刀进行松解,刀口线垂直皮肤进针刀,针刀抵达病变处行提插刀法松解,范围不超过0.5 cm。见图1。每7 d干预1次,共干预4次。空白组、模型组常规饲养,未做其他特殊处理。

图1 针刀组针刀治疗示意图
2.3 取材 于针刀干预结束后1周,经腹腔麻醉后耳缘静脉空气栓塞处死,迅速解剖左侧膝关节,取出兔左侧膝关节股骨髁软骨组织。
2.4 HE染色光镜观察及Mankin’s评分 兔左侧膝关节股骨髁软骨组织粗修后于4%多聚甲醛中固定24 h,10% EDTA脱钙完全后修切,常规石蜡包埋后5μm切片。常规脱蜡后,浸入苏木精液中染色20 min,10%盐酸乙醇分色3 s,PBS返蓝20 min,入伊红染料复染30 s,染色完成后用中性树胶封片。光镜下对软骨组织结构进行观察及图像采集,按照软骨部位选取1 024×768像素大小的图像,每张载玻片选择3个视野,参照Mankin’s评分[9]进行分数统计,取其平均值。分级标准:正常0~2分,轻度病变3~7分,中度病变8~11分,重度病变12~14分。2.5 Tunel染色 石蜡组织切片经脱蜡水化处理后,PBS漂洗5 min×2次;滴加蛋白酶K工作液,37℃反应30 min,PBS漂洗5 min×2次;浸入封闭液(1 mL 30%H2O2溶于9 mL甲醇)中室温封闭10 min,PBS漂洗5 min×2次;滴加TdT酶反应液,加盖玻片37℃避光湿润反应60 min,PBS漂洗5 min×3次;滴加Streptavidin-HRP工作液,加盖玻片37℃湿润避光反应30 min,PBS漂洗5 min×3次;DAB显色,双蒸水充分漂洗终止反应;苏木素复染,逐级乙醇脱水,二甲苯透明,中性树胶封片。通过光学显微镜观察,细胞核呈棕黄色为阳性着色。采用HPIAS 21000图像分析系统进行分析处理,选择细胞分布较均匀的高倍视野计数,根据公式计算细胞凋亡指数。
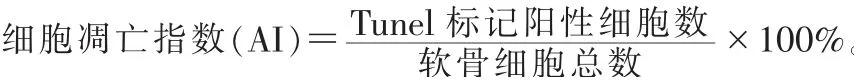
2.6 RT-PCR检测软骨组织TRPV4、Caspase-3 mRNA表达 取兔膝关节软骨置于研钵中,加入液氮快速研磨,使用骨组织RNA提取试剂盒提取总RNA,核酸紫外分光光度计测定RNA纯度和浓度。采用MMLV-PCR扩增试剂盒反转录二步法,cDNA置于-20℃保存备用。PCR反应体系中含标本体系3μL,引物体系17μL,总体系20μL。引物由上海生物工程股份有限公司设计,GAPDH正向:TGGAATCCA CTGGCGTCTTCAC,反 向:AGGATGCGTTGCTGACA ATCTTGA;TRPV4正 向:AAGTTTGGAGCGGTCTCG TT,反向:GGTAAGGGTATGGCGGAGTG;Caspase-3正向:AGCAAATCAATGGACTCTGGGAA,反向:CCC GAGGTTTGCTGCATTTAC。PCR反 应 条 件:95℃10 min,95℃15 s,72℃30 s,共40个循环,采用相对定量2-ΔΔCt法分析结果。
2.7 Western blot检测软骨组织TRPV4、Caspase-3蛋白表达 组织裂解法提取兔软骨组织总蛋白,BCA法测定蛋白含量后,SDS-PAGE凝胶电泳,NC膜转印,一抗、二抗孵育,ECL显色曝光。Gel Doc 2000凝胶成像系统成像,Quantity One软件分析蛋白条带灰度值,以GAPDH作为内参照蛋白进行校准,采用目标蛋白条带灰度值/GAPDH条带灰度值来表示目的蛋白相对表达水平。
2.8 统计学方法 采用SPSS 20.0软件进行统计分析。计量资料服从正态分布采用(±s)表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。不服从正态分布采用中位数(四分位数间距)[M(IQR)]表示,采用秩和检验进行比较。
3 结 果
3.1 3组兔实验情况 实验期间各组兔精神状态良好,体质量、进食量基本一致,实验过程中动物无死亡。
3.2 3组兔软骨组织HE染色形态学观察 空白组软骨表面光滑,层次结构清晰,细胞排列规整,潮线清晰完整;模型组软骨表面不光滑,部分缺损,细胞分布不均匀,潮线紊乱;针刀组软骨表面较光滑,层次结构较清楚,细胞排列趋于整齐,潮线较模型组完整。见图2。
3.3 3组兔软骨组织Mankin’s评分比较 见表1。

图2 3组兔软骨组织HE染色图(×100)

表1 3组兔软骨组织Mankin’s评分比较[M(IQR)]
3.4 3组兔软骨组织Tunel染色观察 空白组可见少量散在的软骨细胞凋亡;模型组可见大量的软骨细胞凋亡,呈片状分布;针刀组软骨细胞凋亡数明显少于模型组,趋于空白组。见图3。
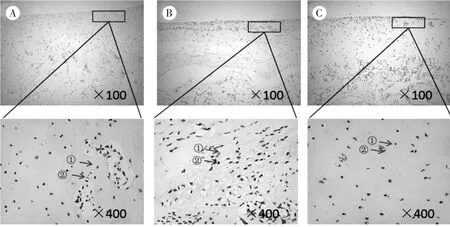
图3 3组兔软骨TUNEL染色图
表2 3组关节软骨细胞凋亡率比较(±s)
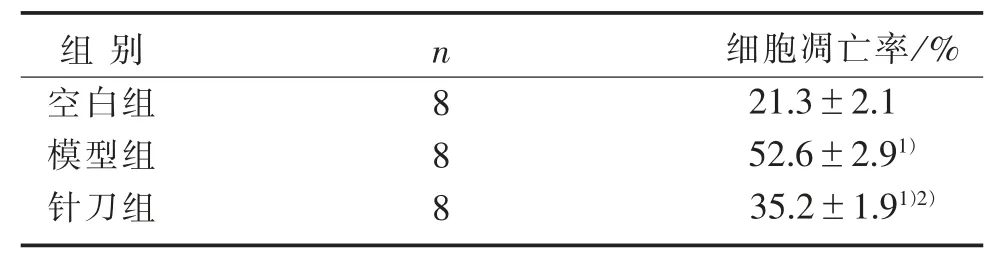
表2 3组关节软骨细胞凋亡率比较(±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05。
?
3.5 3组兔软骨细胞凋亡率比较 见表2。
3.6 3组兔软骨组 织TRPV4、Caspase-3 mRNA表达比较 见表3。
表3 3组兔软骨组织TRPV4、Caspase-3 mRNA表达比较(±s)

表3 3组兔软骨组织TRPV4、Caspase-3 mRNA表达比较(±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05。
?
3.7 3组兔软骨组织TRPV4、Caspase-3蛋白表达比较 见图4、表4。

图4 3组兔软骨组织TRPV4、Caspase-3蛋白电泳图
表4 3组兔软骨组织TRPV4、Caspase-3蛋白表达比较(±s)
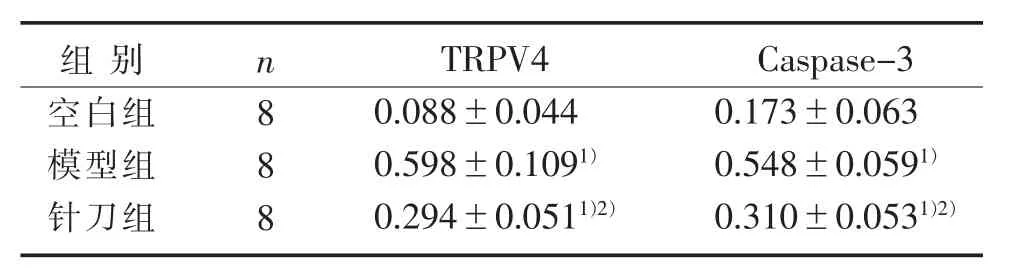
表4 3组兔软骨组织TRPV4、Caspase-3蛋白表达比较(±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05。
?
4 讨 论
KOA是生物学因素和力学因素共同作用下以关节软骨退变为主,最终导致软骨结构破坏、滑膜增厚、骨质增生及关节内炎症反应,严重影响患者的生活质量[10]。中医学经筋理论从气血和力学角度阐明KOA核心病机为“气血失和,筋骨失衡”,关键治则为“解结横络、调和气血、调衡筋骨”[11]。针刀具有“针刺”和“刀割”双重功效,擅长对病损软组织粘连、瘢痕、挛缩进行松解和疏通堵塞,主要功效为改善骨骼肌、韧带功能,调节力学平衡[12]。因此,基于经筋理论针刀循膝周经筋病灶点松解是治疗KOA有效途径[13]。研究表明,“鹤顶次”“髌外上”“髌内上”“髌外下”“髌内下”和“阴陵上”为KOA高频经筋病灶点和治疗点[14-15],基于此,本团队选取上述病灶点行针刀松解,以达到调节膝关节“气血和畅、筋骨平衡”目的,从而有效缓解KOA疼痛和功能障碍,延缓软骨退变。
研究结果显示,与空白组比较,模型组软骨表面不光滑,部分缺损,层次结构不清,细胞分布不均匀,可见细胞簇集,潮线紊乱,Mankin’s评分明显升高。经过针刀干预后,软骨形态及Mankin’s评分均明显改善,表明基于经筋理论针刀松解能够有效延缓KOA兔软骨退变。
KOA主要表现为软骨细胞凋亡显著增多,其增殖、凋亡动态平衡被打破,关节软骨细胞大量减少,最终导致关节软骨退变[16]。本研究运用Tunel染色检测软骨细胞凋亡情况,结果表明模型组软骨细胞凋亡率显著高于空白组,而针刀组软骨细胞凋亡率比模型组明显降低,这提示基于经筋理论针刀松解能够减少KOA兔软骨细胞凋亡,延缓软骨退变。
TRPV4是一种机械敏感离子通道,在软骨、骨和滑膜等多种肌肉骨骼组织中广泛表达,介导软骨细胞对机械应力的反应[17]。膝关节筋骨失衡过度机械应力可活化TRPV4,引起Ca2+大量内流,激活细胞内凋亡分子Caspase-3表达,促进软骨细胞凋亡,加剧软骨细胞退变。本研究运用RT-PCR和Western blot检测软骨TRPV4、Caspase-3分子表达,结果表明模型组软骨TRPV4、Caspase-3 mRNA和蛋白的表达较空白组显著增高,而针刀组软骨TRPV4、Caspase-3 mRNA和蛋白的表达较模型组显著降低。可见,基于经筋理论针刀松解能够抑制TRPV4信号通路,使TRPV4降低表达,进而下调下游靶点促凋亡蛋白Caspase-3表达,从而有效减少软骨细胞凋亡,延缓软骨退变。
综上所述,基于经筋理论运用针刀循膝周常见经筋病灶点松解,能有效减少KOA兔软骨细胞凋亡,延缓软骨退变,其作用机制可能与抑制TRPV4通路,下调TRPV4、Caspase-3表达有关。

