右旋糖酐酶生产菌株的分离鉴定及发酵培养基优化*
杨 齐,黄斌良,吴华德,江朝明
(广西多得乐生物科技有限公司,广西南宁 530000)
0 引言
右旋糖酐是一种大分子聚合物,主要由D-葡萄糖分子通过α-1,6-糖苷键连接形成的主链,以及α-1,2-糖苷键和α-1,4-糖苷键形成的侧链构成[1]。因其安全无毒、生物相容性好、来源丰富等特性,右旋糖酐已被广泛应用在食品、医药等多个领域[2,3]。天然的右旋糖酐分子量相对较高,必须经酸水解或酶水解形成小分子量右旋糖酐后才能加以应用。但是酸法生产的右旋糖酐含有氯离子,并且所得产物分子量不统一,不能满足临床需求,而酶法反应条件温和,所得产物分子量范围比较狭窄,并且能大大减少污染[4]。
右旋糖酐酶(E.C.3.2.1.11)是一种诱导酶,能够专一性水解右旋糖酐中的α-1,6-糖苷键[5,6]。生产右旋糖酐酶的微生物有很多,从一开始,真菌和细菌就被确定为能够水解葡聚糖的主要酶源,特别是真菌。来源于细菌的右旋糖酐酶相对较少,并且其酶活力相对较低,但是却具有良好的热稳定性[7,8]。真菌来源的右旋糖酐酶大多稳定性好,酶活力较高,具有很高的研究价值和商业价值[9-13]。
Plackett-Burman (PB)实验设计可以从大量变量中筛选主要因素,响应面法是一种有效的实验工具,通过它可以确定多变量系统中的最优条件。因此,为了有利于工业化生产,本研究拟筛选能够高产右旋糖酐酶的真菌菌株,并利用响应面法对其发酵生产右旋糖酐酶的培养基进行优化,以期得到最优的发酵培养基,为其深入研究及工业化应用奠定基础。
1 材料与方法
1.1 材料
右旋糖酐T70、T500、T2000及蓝色葡聚糖购自上海麦克林生化有限公司,常用化学试剂购自国药集团化学试剂有限公司,蛋白胨购自Sigma公司。
1.2 菌株筛选
平板筛选培养基(g/L):右旋糖酐9,蓝色葡聚糖1,硝酸钠3,磷酸氢二钾1,硫酸镁0.5,硫酸锰0.01,氯化钾 0.5,琼脂粉 15-20,pH值为5.5-6.0。
基础发酵培养基(g/L):右旋糖酐10,蛋白胨3,磷酸氢二钾1,硫酸镁 0.5,pH值为5.5-6.0。
取5 g土样,加入50 mL 灭菌ddH2O,振荡30 min后静置沉淀,取上清分别稀释1×103-1×107倍后,取100 μL涂布到平板筛选培养基上,28℃静止培养5-7 d。挑选产生透明圈的菌株,转接到摇瓶发酵培养基中,28℃、180 r/min震荡培养5-7 d后,检测右旋糖酐酶活力[14]。
1.3 菌株鉴定
1.3.1 形态学鉴定
在PDA平板上接种菌株,28℃静止培养,观察并记录菌落形态及颜色。
1.3.2 分子生物学鉴定
收集发酵液中菌丝体,提取基因组DNA。以基因组DNA为模板,以ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)为引物,通过PCR扩增ITS rDNA序列。所得产物送至华大基因公司进行测序,将测序结果与NCBI数据库已有的ITS rDNA序列进行Blast比对,并利用MEGA的Neighbor-Joining软件构建系统发育树,Boot-strap分析重复设置为1 000。
1.4 右旋糖酐酶的活力测定
取1 mL适当稀释的酶液,加入4 mL 3%的右旋糖酐T70 (0.02 mol/L的醋酸缓冲液配制,指定pH值),在指定温度下反应10 min后,利用3,5-二硝基水杨酸(DNS)法检测还原糖量[15]。
一个酶活力单位(U)定义为每分钟释放1 μmol的还原糖所需的酶量。
1.5 培养基优化
1.5.1 单因素实验
分别用葡萄糖、蔗糖、果糖、柠檬酸、玉米淀粉、糊精取代基础发酵培养基中的碳源。接种筛选出的菌株于各培养基中,28℃、200 r/min震荡培养7 d后检测右旋糖酐酶活力,探索发酵产酶所需最佳碳源。
分别用酵母粉、尿素、硝酸钠、硫酸铵等取代基础发酵培养基中的氮源。接种筛选出的菌株于各培养基中,28℃、200 r/min震荡培养7 d后检测右旋糖酐酶活力,探索发酵产酶所需最佳氮源。
在最佳碳源和最佳氮源组成的培养基中,分别添加不同的无机盐:硫酸镁、氯化钾、氯化钠、磷酸二氢钾、磷酸氢二钾、硫酸锰、硫酸亚铁、氯化钙等。接种筛选出的菌株于各培养基中,28℃、200 r/min震荡培养7 d后检测右旋糖酐酶活力,检测无机盐对筛选出的菌株发酵产酶的影响,以未添加无机盐的培养基作为对照。
1.5.2 响应面实验
1.5.2.1 Plackett-Burman实验
根据单因素实验结果,选取6个因素进行PB实验设计,每个因素取两个水平:低水平“-1”和高水平“+1”。
1.5.2.2 最陡爬坡实验
结合PB实验结果选出的显著因素,设计它们的变化方向和步长进行最陡爬坡实验,使各因素的取值更临近最佳值区域,为响应面实验做好准备。
1.5.2.3 Box-Benhnken Design (BBD)实验
在最陡爬坡实验确定的实验因素中心点基础上,根据BBD中心组合设计原理,设计3因素3水平共15个实验点的响应面分析。
2 结果与分析
2.1 菌株筛选
从土壤中筛选得到一株右旋糖酐酶产生菌株DJ72,该菌株能够在筛选平板培养基上形成明显透明圈,接种到基础发酵培养基培养7 d后,所产右旋糖酐酶活力达98 U/mL。
2.2 菌株鉴定
2.2.1 形态学鉴定
将菌株在PDA平板培养基上培养3 d后,菌落生长整齐,显白色或淡黄色,呈绒毛状(图1a),在显微镜下观察,菌丝有隔、分枝。小分生孢子呈纺锤状或卵圆形,大分生孢子呈梭形或月牙形(图1b)

图1 菌株DJ72的形态学特征
2.2.2 分子生物学鉴定
提取菌株DJ72的总DNA并作为模板,应用通用引物ITS1和ITS4作为引物,克隆得到其ITS rDNA序列,经测序获得一条 521 bp的核苷酸序列,同源性比对分析表明,其与腐皮镰刀菌(Fusariumsolani)菌株的同源性最高,达100%(图2)。

图2 菌株DJ72的系统进化分析
根据形态学及分子生物学鉴定结果,菌株DJ72为腐皮镰刀菌(Fusariumsolani)。将DJ72保藏在中国微生物菌种保藏中心,保藏编号为CGMCC No.14542。
2.3 培养基单因素优化
2.3.1 碳源对DJ72发酵生产右旋糖酐酶的影响
用不同的碳源取代基础发酵培养基中的右旋糖酐T500,经摇瓶震荡发酵7 d后检测右旋糖酐酶活力。实验结果表明,右旋糖酐相比其他碳源更有利于右旋糖酐酶的发酵,其中以分子量更大的右旋糖酐T2000为碳源所产酶活力更高(图3)。

图3 碳源对DJ72发酵生产右旋糖酐酶的影响
2.3.2 氮源对DJ72发酵生产右旋糖酐酶的影响
用不同的氮源取代基础发酵培养基中的氮源,经摇瓶震荡发酵7 d后检测右旋糖酐酶活力。实验结果表明,蛋白胨与尿素的组合最利于DJ72发酵生产右旋糖酐酶(图4)。
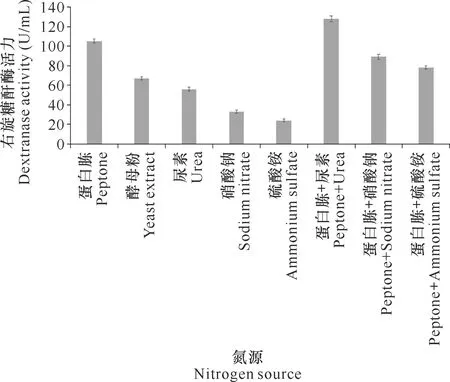
图4 氮源对DJ72发酵生产右旋糖酐酶的影响
2.3.3 无机盐对DJ72发酵生产右旋糖酐酶的影响
在最佳碳源和氮源的基础上添加不同的无机盐,经摇瓶震荡发酵7 d后检测右旋糖酐酶活力。实验结果表明,硫酸镁、磷酸氢二钾和硫酸亚铁有利于DJ72发酵生产右旋糖酐酶(图5)。

图5 无机盐对DJ72发酵生产右旋糖酐酶的影响
2.4 培养基响应面优化
2.4.1 Plackett-Burman实验结果
根据单因素实验结果,选取6个因素进行考察,采用试验次数N=12的 PB进行设计。6个因素分别为右旋糖酐T2000、尿素、蛋白胨、磷酸二氢钾、硫酸镁、硫酸亚铁,分别对应表1中A、B、D、E、G和H列。每个因素取两个水平:低水平“-1”和高水平“+1”。另设两个虚拟列,考察实验误差,分别为C和F列。具体实验设计和结果分析见表1和表2。

表1 Plackett-Burman实验设计与响应值Table 1 Plackett-Burman experiment design and response values
从表2可以看出,在PB设计的两个水平范围内,尿素、蛋白胨和右旋糖酐对酶活力具有显著影响,影响力大小为尿素>蛋白胨>右旋糖酐。因此,对这3种因素开展更进一步研究。为节约成本,今后实验中其余成分取最低值。
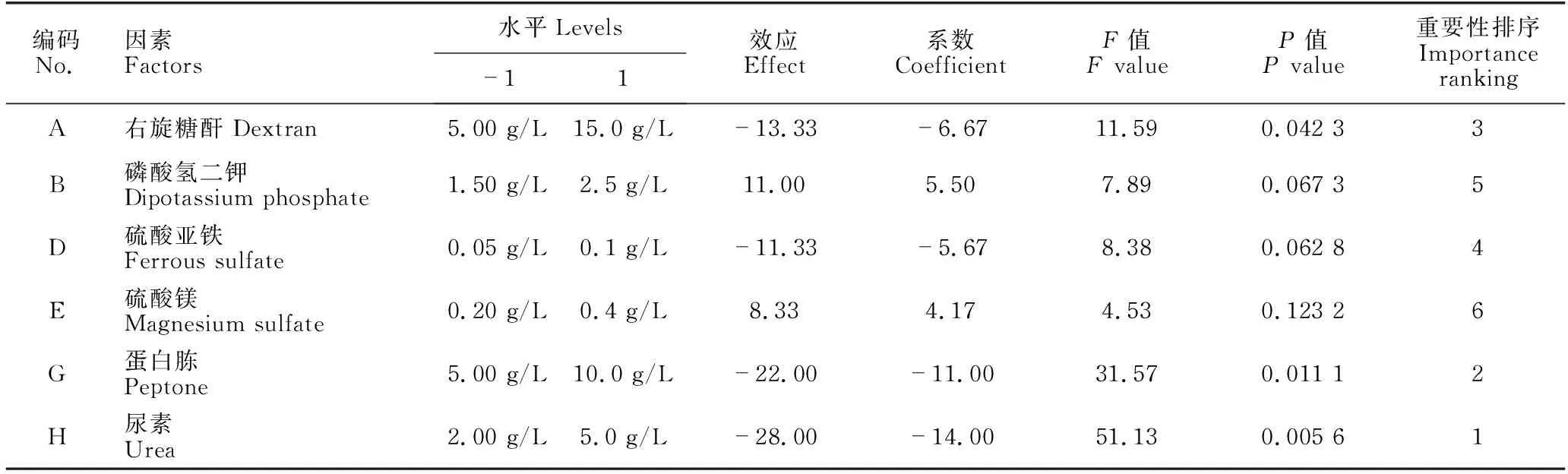
表2 Plackett-Burman实验因素水平和效应分析Table 2 Factor levels and effect analysis in Plackett-Burman experiments
2.4.2 最陡爬坡实验
由PB实验结果选取尿素、蛋白胨以及右旋糖酐等3个因素进行最陡爬坡实验,根据这3个因素的效应大小比较,设定它们的变化方向和步长,结果见表3。从实验结果可知,最佳发酵条件可能在实验3附近,因此以实验3的条件为响应面实验的中心点。

表3 最陡爬坡实验设计及结果Table 3 Design and results of the steepest climbing experiment
2.4.3 Box-Benhnken Design (BBD)实验结果
在PB实验及最陡爬坡实验结果的基础上,对右旋糖酐、蛋白胨及尿素3个变量对右旋糖酐酶发酵结果的影响进行考察,采用响应面法进行优化,实验结果如表4。

表4 Box-Benhnken 实验方案及结果Table 4 Box-Benhnken experiment design and results
通过 Design Expert 软件对表4中实验结果进行二次多元回归拟合,得到二次多元回归方程:Y=227.33+0.50A+5.13B+4.63C-14.75AB-16.25AC-14.00BC-16.42A2-16.17B2-16.17C2,其中Y为右旋糖酐酶活力。进一步对该模型进行方差分析,结果如表5。


表5 方差分析结果Table 5 Analysis of variance for the quadratic model

续表5Continued table 5
各因素之间交互作用及其对右旋糖酶活力影响如图6所示,在3个因素的取值范围内,右旋糖酐酶活力均存在最大值。从图6a可知,蛋白胨与右旋糖酐交互作用明显,在一定范围内随着蛋白胨和右旋糖酐取值不断增大,右旋糖酐酶活力不断增大,然后开始降低。从图6b可知,尿素与右旋糖酐交互作用明显,过高或过低的取值都会使酶活力降低。从图6c可知,尿素与蛋白胨对右旋糖酐酶活力影响极为显著,表现为陡峭的曲面。

图6 各因素交互作用图
根据回归模型预测右旋糖酐酶活力最大为228 U/mL,此时右旋糖酐T2000用量为11.88 g/L,蛋白胨用量为7.15 g/L,尿素用量为3.14 g/L。根据预测结果进行验证实验,平行3次所得右旋糖酐酶活力分别为227,227,229 U/mL,平均值为227.66 U/mL,与预测结果基本一致。
因此,经过优化,确定腐皮镰刀菌DJ72发酵生产右旋糖酐酶的最佳配方为右旋糖酐T2000 11.88 g/L,蛋白胨7.15 g/L,尿素 3.14 g/L,磷酸氢二钾1.50 g/L,硫酸镁0.20 g/L,硫酸亚铁0.05 g/L。
3 讨论
提高右旋糖酐酶发酵产量的方法有很多,如Li等[16]采用补料分批发酵和两步发酵法提高了右旋糖酐酶的活力,分别为159.50和187 U/mL。吴敏等[17]通过基因工程的方法将右旋糖酐酶酶活力提高到240 U/mL。其中,响应面法是运用较多并且行之有效的培养基优化方法,如曹研研等[18]通过响应面法优化棘孢青霉菌的发酵条件,将右旋糖酐酶酶活力提高了88%。杨帆等[19]通过响应面法优化圆弧青霉发酵右旋糖酐酶的发酵培养基,将酶活力提高1.7倍。本研究通过响应面法优化腐皮镰刀菌DJ72发酵产右旋糖酐酶的培养基成分,与初始发酵培养基相比,右旋糖酐酶活力从98 U/mL提升至228 U/mL,酶活力提升1.3倍。
国际上有关右旋糖酐酶生产菌株的报道已有很多,但是有关腐皮镰刀菌生产右旋糖酐酶的报道较少,迄今为止仅见到Maksimov等[20]发表的一篇相关文章,类似的报道国内尚未见到。本研究是国内首次有关腐皮镰刀菌生产右旋糖酐酶的报道,该工作一方面扩充了国内有关右旋糖酶来源菌株的范围,另一方面也为研究人员深入研究右旋糖酐酶提供基础数据。

