球形棕囊藻增加水体黏度对柱形宽水蚤的摄食抑制*
李 杰,陆家昌**,蓝彩碧,赖俊翔,王佳乐,韦福佳
(1.广西科学院,广西北部湾海洋研究中心,广西近海海洋环境重点实验室,广西南宁 530007;2.广西大学海洋学院,广西南宁 530006)
0 引言
球形棕囊藻(Phaeocystisglobosa,下文简称棕囊藻)是在热带、亚热带和温带海域广泛分布的浮游植物赤潮种,对海洋生物化学循环、气候调节以及渔业安全有重要影响[1-3]。棕囊藻具有异常复杂的单细胞-囊体相互转变的生活史,多以囊体形态形成赤潮[4]。目前的研究普遍认为,棕囊藻由单细胞过渡到囊体结构属于一种防御性的生存策略,胶状的囊体结构不仅可以抵御细菌或病毒的侵害,还可以通过增大自身的粒级来抑制捕食者摄食[5,6]。棕囊藻的囊体结构是一层厚度大约为7 μm的胶状透明外被,主要成分为多糖[7,8]。在棕囊藻形成囊体过程中,细胞会随着高分子化合物的对外分泌,提高周围水体环境的黏度[9]。有研究报道,在棕囊藻赤潮暴发前期,水体中叶绿素a浓度与水体黏度有正相关关系[10]。不仅如此,透明胞外颗粒聚合物(Transparent Exopolymer Particles,TEP)也与叶绿素a浓度有正相关关系[11]。但在赤潮衰败期,水体黏度、TEP含量则与叶绿素a浓度呈负相关的关系,这说明细胞分泌物对水体黏度变化起到主要的驱动作用[10]。
近年来,有研究提出棕囊藻细胞分泌溶解有机物(Dissolved Organic Carbon,DOC)形成TEP属于抵御捕食者的生存策略[12]。但对于其内在机制仍然存在争议,比如海洋初级生产力的主要消费者桡足类,有研究认为棕囊藻带来的水体黏度增加不足以抑制桡足类的摄食。桡足类在棕囊藻赤潮期间所表现出来的肠道内含物低,或者对某一浮游植物的摄食率下降与水体黏度没有直接的联系,而是因为桡足类通过摄食TEP补充食物来源,才导致对浮游植物的摄食率下降,所以桡足类的肠道内含物也随之下降[13,14]。但也有研究指出浮游植物所分泌高分子化合物引起的水体黏度增加的确会影响桡足类移动,并抑制其摄食行为[15]。Laurent和Vincent[16]的研究指出,棕囊藻所造成的水体黏度的增加使得桡足类长角宽水蚤(Temoralongicornis)的移动速率下降,导致其移动轨迹发生改变,但并不认为桡足类的摄食被抑制。总的来说,关于棕囊藻带来的水体黏度增加是否会抑制桡足类摄食仍然存在争议。
本研究利用棕囊藻培养液和海藻酸钠溶液设置不同水体黏度进行柱形宽水蚤(Temorastylifera)摄食实验,在此基础上研究棕囊藻培养液和海藻酸钠溶液带来的水体黏度变化对桡足类摄食浮游植物的影响,以期进一步了解棕囊藻赤潮期间桡足类的摄食行为,认识棕囊藻赤潮的发生对浮游生物能量物质循环的影响。
1 材料与方法
1.1 材料
1.1.1 微藻
牟氏角毛藻(Chaetocerosmuelleri)、球等鞭金藻(Isochrysisgalbana)从广西北部湾海洋研究中心获取,球形棕囊藻于2018年从广西近岸海域采集分离获得,保存在广西北部湾海洋研究中心藻种库。在恒温室内以f/2 (-Si)培养液持续传代培养,培养液的配制参考Guillard[17]的文献,培养温度为20℃,盐度为30,光照强度为2 000 lx,光暗时间比为12 h∶12 h。
1.1.2 柱形宽水蚤
桡足类柱形宽水蚤于2019年采集分离自广西近岸海域,在广西北部湾海洋研究中心生态环境实验室传代培养,放置于20 L塑料桶内,盐度为30,室内常温培养。每天投喂一次球等鞭金藻,食物量约为1 000 μg C/L。每星期投喂一次牟氏角毛藻。每隔两个星期换掉容器内一半的水,除去柱形宽水蚤的粪便以及多余的食物,保证水质优良。
1.2 方法
1.2.1 棕囊藻单细胞丰度、囊体丰度、囊体直径的测定
采集处于指数生长期末期的棕囊藻培养液(含囊体结构),在自然重力的条件下过孔径为10 μm的筛绢以除去囊体结构。将过滤所获得的仅含有单细胞的滤液接种到新的f/2 (-Si)培养液中,f/2 (-Si)培养液的体积为2 L(3 L的锥形培养瓶),接种密度为2 000 cells/mL,设置3个平行培养瓶。培养实验开始后,每隔两天在每个培养瓶中采集2 mL的水样,用鲁哥试剂固定(终浓度为5%),使用浮游植物计数框在倒置显微镜(Nikon)下对游离球形棕囊藻进行单细胞计数;实验开始后的第4天起,每隔两天采集5-10 mL 的水样在倒置显微镜下检查囊体的数量和直径。
1.2.2 黏度测定
黏度测定使用旋转流变仪(赛默飞,HAAKE MARS 60),选择桨叶转子FLB26系统,剪切扫描模式[18]。测定棕囊藻培养液和海藻酸钠溶液的黏度值时,测试温度设置为20℃,转子的剪切速率为10 r/s,剪切测试时间为30 s。棕囊藻培养实验开始后,每隔两天采集30 mL的培养液水样测定其黏度值。然后直接转移至旋转流变仪特定的容器中,参照经孔径为0.2 μm滤膜过滤的海水(盐度为30),测定棕囊藻培养液和海藻酸钠溶液的黏度值[10]。
1.2.3 TEP含量的测定
培养实验开始后,每隔两天采集10-50 mL的水样用于TEP含量的测定,方法参照Mari等[19]的研究。在低于150 mm Hg的压力下将水样过滤到孔径为0.4 μm的聚碳酸酯膜(Millipore,ATTP,Ireland)上,加入0.5 mL阿利新蓝染色剂(Sigma,Switzerland,终含量为0.02%),对滤膜进行染色,染色时间t<2 s。把膜转移到15 mL 的样品管中,加入5 mL浓度为80%的硫酸溶液,浸泡2 h。期间,每隔30 min轻轻摇试管,使TEP充分酸化。使用紫外光分光光度计在787 nm处以1 cm的比色皿测定上清液的吸光值,用蒸馏水做对比参考。TEP的浓度(Ctep)以黄原胶(麦克林,上海)的当量(Gum xanthan equivalent)来表示(μg/liter),TEP的浓度单位为 (μg/liter xanthan equiv.)。
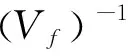
式中,E787为样品的吸光值;C787为空白的吸光值;Vf为过滤体积,单位为L;fx为校正因子。
校正因子fx测定和计算方法如下:将15 mg黄原胶混合到150 mL蒸馏水中,以组织研磨器对标准的黄原胶混合溶液进行研磨混合30 min,研磨两次。取3 mL整数倍的黄原胶标准溶液过滤到预先称量好重量的滤膜上,干燥滤膜后称量滤膜上黄原胶的干重(Dry weights)。取等体积的黄原胶标准溶液过滤到滤膜上,使用爱尔新蓝染色液对其进行染色处理,操作方法按照上述步骤进行(测定其特定波长处的吸光值)。
fx校正因子的计算参照如下公式:
fx=W×[(Est787-C787)×Vst-1]-1,
式中,W为滤膜上黄原胶的干重(μg/liter);Est787为黄原胶的吸光值;C787为空白的吸光值;Vst为用于染色的黄原胶标准溶液的体积。
1.2.4 摄食实验
用孔径为1 mm 的筛网将柱形宽水蚤的雌体从培养瓶中分离出来,在温度为20℃,光照强度为2 000 lx的环境条件下,饥饿处理24 h,清空肠胃。将饥饿处理后的柱形宽水蚤转移至500 mL的三角瓶内,内含由300 mL的棕囊藻培养液或海藻酸钠溶液,盐度为30。以过滤自然海水和高密度棕囊藻培养液的黏度作为参考,设置高、中、低3个层次的黏度环境,共计3组摄食实验,每组3个平行,每个实验瓶内放置5个柱形宽水蚤实验个体,实验时长为24 h。瓶内初始食物浓度为(851.04±80.95) μg C/L。实验温度为20℃,光照为2 000 lx。摄食实验开始前和结束时,每个实验瓶内取1-2 mL的海水,利用浮游植物计数框(登讯,厦门)在倒置显微镜(Nikon)下计算浮游植物的单细胞丰度,通过瓶内饵料食物浓度的变化来计算柱形宽水蚤的摄食率,计算公式参考Frost[20]的文献。各组实验的细节见表1。
海藻酸钠摄食实验:称取0.1 g的海藻酸钠(成都科隆,分析纯)加热搅拌溶解在100 mL纯水中,配制成海藻酸钠母液,再将溶解后的海藻酸钠母液加入过滤海水中(盐度为30),在旋转流变仪(见1.2.2节)的帮助下调配出与棕囊藻培养液相同的黏度值。共设置3组摄食实验,每组3个平行,微藻食物为牟氏角毛藻C.muelleri,其他实验条件与棕囊藻的藻液摄食实验一致,具体信息见表1。

表1 棕囊藻培养液和海藻酸钠溶液的黏度摄食实验信息Table 1 Viscosity ingestion experiment information of P.globosa culture medium and sodium alginate solution
1.2.5 数据处理
通过One-Way Anova分析组间摄食率是否存在显著性差异,显著水平设定为P<0.05。棕囊藻的游离细胞丰度、囊体丰度、囊体直径与培养液的TEP含量、水体黏度之间的数据相关性分析采用Person相关分析( SPSS 20.0,IBM)。
2 结果与分析
2.1 棕囊藻的囊体和游离单细胞
棕囊藻单细胞的丰度随着生长不断升高,培养实验开始后的第4天起开始出现囊体结构,囊体的直径和囊体的丰度同样随着生长而逐渐增大(图1)。
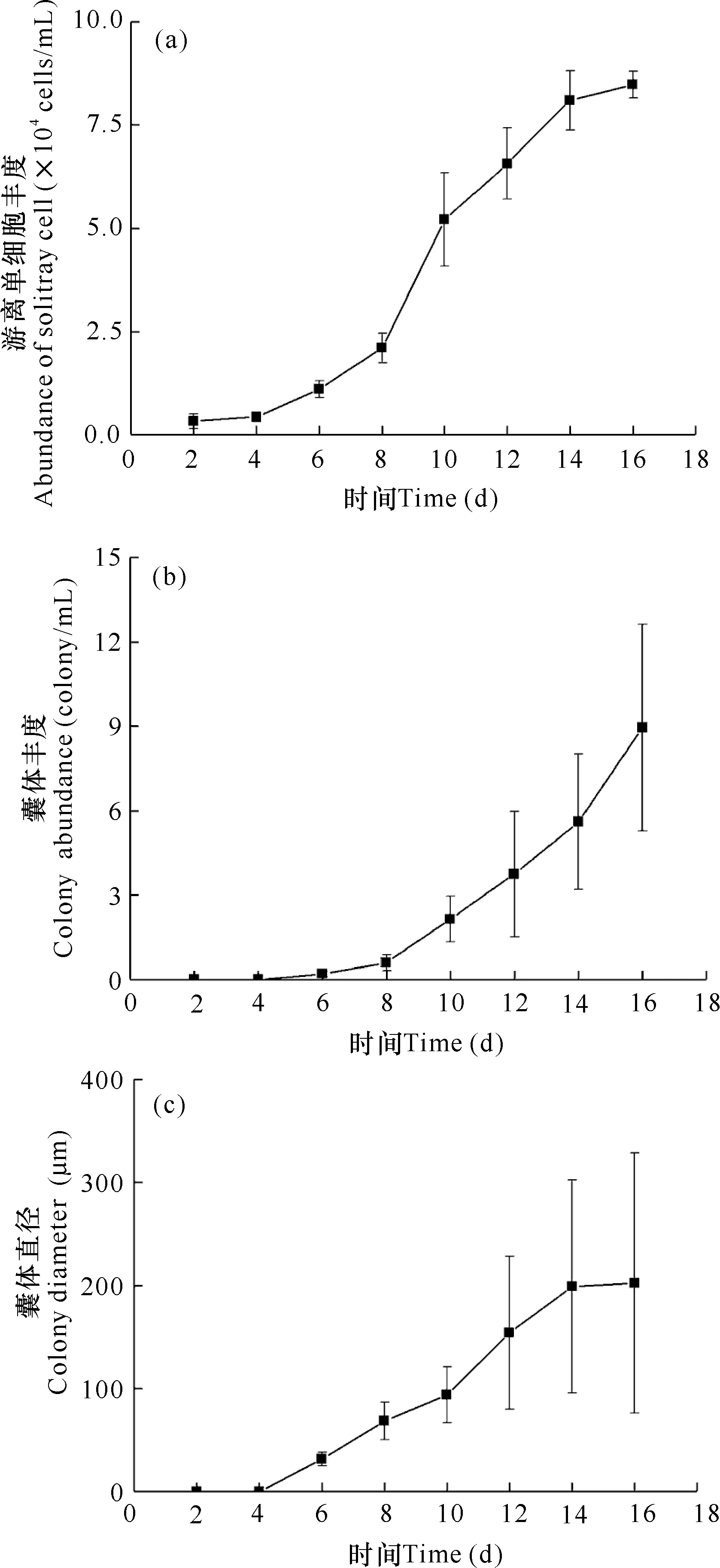
图1 棕囊藻游离单细胞丰度(a)、囊体丰度(b)以及囊体直径(c)生长曲线Fig.1 Growth curve of abundance of solitary cell (a),colony abundance (b) and colony diameter (c) of P.globosa
2.2 TEP和水体黏度
由图2可知,棕囊藻培养液中的TEP含量以及水体黏度在棕囊藻生长过程中逐渐提高,整体保持持续上升的趋势。TEP的含量最高值出现在第16天,达到(677.33±34.92) μg/liter xanthan equiv.,黏度为(2.96±0.58)-(4.92±0.19) MPa·s。
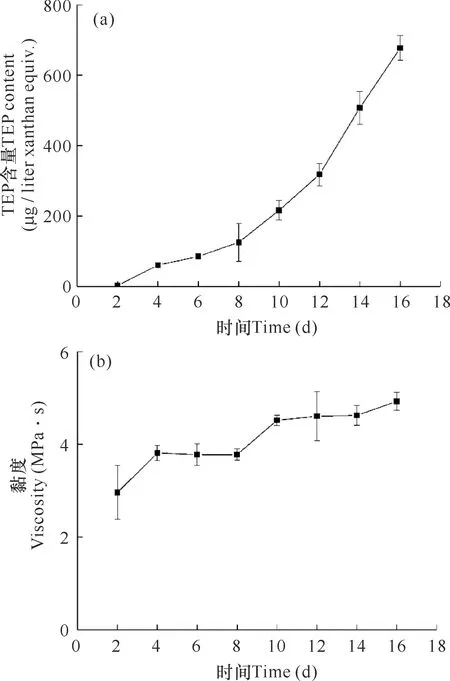
图2 棕囊藻培养液的TEP含量(a)和水体黏度(b)变化
2.3 相关性分析
由表2可以看出,棕囊藻的游离单细胞丰度、囊体丰度以及囊体直径与TEP的含量、水体黏度均有显著的正相关关系(P<0.01)。
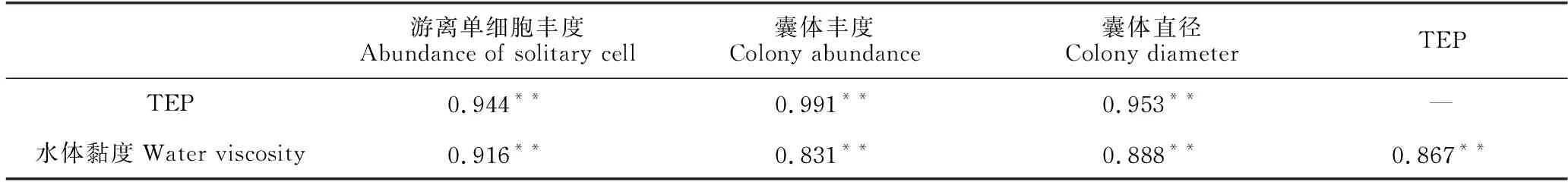
表2 棕囊藻的游离单细胞丰度、囊体丰度、囊体直径与TEP含量、水体黏度的相关性分析Table 2 Correlation analysis of P.globosa solitary cell abundance,colony abundance and colony diameter with TEP content and viscosity
2.4 柱形宽水蚤的摄食率
如图3所示,在棕囊藻浓度高的实验组(Ⅰ),桡足类柱形宽水蚤对牟氏角毛藻的摄食率和滤水率要低于棕囊藻浓度低实验组(Ⅱ),尤其是不含棕囊藻的实验组(Ⅲ)[(120.85±79.07) ng C/(ind.×h) vs(555.63±293.43)ng C/(ind.×h)](图1a,图1c,P<0.05)。在海藻酸钠溶液的摄食实验中,黏度较大的实验组(Ⅳ),柱形宽水蚤对牟氏角毛藻的摄食率和滤水率要显著低于不含海藻酸钠的实验组(Ⅵ)[(11.15±71.95) ng C/(ind.×h) vs (437.71±99.11) ng C/(ind.×h)](图3b,图3d,P<0.05)。相对于中等黏度值的实验组(Ⅴ),可以看出,柱形宽水蚤的摄食率和滤水率高于黏度较大的实验组(Ⅳ),但低于不含海藻酸钠的实验组(Ⅵ)。
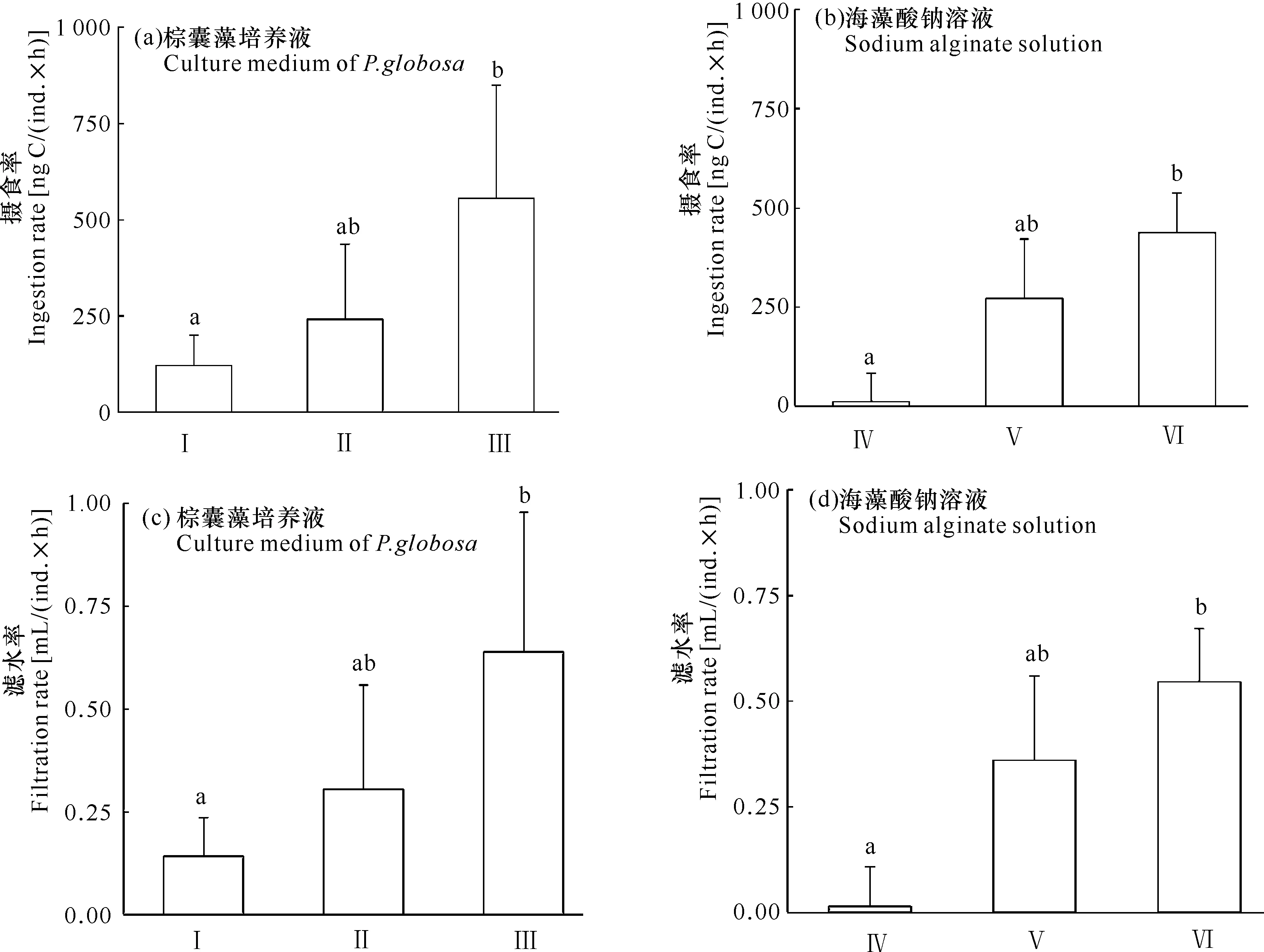
柱形图顶端的不同字母表示组间数据存在差异性,P<0.05
3 讨论
3.1 棕囊藻的TEP与水体黏度
TEP是指可以被阿利新蓝染色的透明颗粒物,主要成分为酸性多糖,具有一定的黏性[21,22]。有研究表明,棕囊藻可以分泌包含有羧基和硫酸盐基的多糖黏液(Mucus),然后自发凝结形成TEP[11,20,23]。依据Mari等[19]的研究,棕囊藻可以通过囊体释放并形成大量TEP,也可以在细胞生长过程中分泌DOC,进一步凝结成TEP。实际上,在自然水体中,这些由棕囊藻分泌出来的DOC及其后续形成的TEP与所在的水体黏度有着一定的关联性[13,24,25]。
本实验的结果表明,随着棕囊藻细胞的生长,水体的TEP含量和黏度值也随之提高(图1)。而且,棕囊藻游离单细胞丰度、棕囊藻囊体丰度、囊体直径与TEP含量、水体黏度有正相关关系(表3)。棕囊藻单细胞繁殖与水体TEP含量呈现正相关关系的结果与Dutz等[13]的研究结果相似,他们在围隔实验中发现,水体环境中的TEP含量是随着棕囊藻的生长而升高的。对于水体黏度与棕囊藻生长的正相关关系(表3),在德国湾(The German Bight)和北海(The North Sea)沿海水域也有类似的发现,在棕囊藻赤潮发展的前期过程中,叶绿素a与海水的黏度值有着显著的正相关性[26,27]。
一般来说,浮游植物分泌出DOC,接着溶解的酸性有机物通过盐桥链接而形成TEP[28,29],虽然黏度与水体中的DOC含量未成一定的线性关系,TEP与DOC也没有直接的线性关系,但TEP和DOC在水体黏度的改变过程中扮演着重要的角色[16,25]。有研究报道,DOC和TEP的增加给水体中团聚体的形成创造有利条件[30,31],对于生活史中含有单细胞过渡形成囊体结构这一过程的棕囊藻[4],先通过分泌DOC,然后再增加水体黏度来促进单细胞过渡到囊体,也是一种较有优势的生活策略[10,32]。此外,在形成囊体之后继续分泌DOC也可以起到保护囊体完整性的作用[25],进一步保证棕囊藻能在恶劣环境中完成生命周期。
3.2 水体黏度对桡足类摄食的影响
实验结果表明,在不同浓度的棕囊藻细胞培养液中,柱形宽水蚤对食物牟氏角毛藻的摄食率表现出差异性。在硅藻食物量等同的条件下,低黏度实验组的柱形宽水蚤摄食率高于高黏度实验组(图3a)。在黏度影响桡足类摄食的研究报道中,Malej和Harris[15]利用硅藻分泌物的高分子化合物和葡萄糖来调节桡足类(长角宽水蚤、长伪哲水蚤、Pseudocalanuselongatus)摄食实验的水体环境黏度,发现水体黏度较高的实验组,桡足类的摄食率低于水体黏度低实验组;在水体黏度较高的情况下,由于湍流减少,桡足类移动速度下降[16],与食物的相遇率也会降低,摄食行为比正常情况下耗费更多的能量[33],桡足类因为捕食行为消耗增高而选择减少运动摄食行为,降低体能的消耗。本研究结果也支持该观点,柱形宽水蚤在高黏度的海藻酸钠实验组中也表现出相对较低的摄食率(图3b)。事实上不仅是桡足类,一些原生动物也会被浮游植物分泌的Exopolymer Secretions (EPS)黏液层(Mucus)改变移动方式以及阻碍摄食[34,35]。这意味着,在高浓度的棕囊藻细胞培养液中,桡足类的摄食行为会受到水体黏度的影响。
相反,有研究指出,棕囊藻可以分泌DOC并进一步形成TEP,而桡足类可以通过摄食TEP来补充能量,从而降低对浮游植物的摄食,因此并不是水体的黏度影响了桡足类的摄食率[13,14]。但在本研究的海藻酸钠摄食实验中,低黏度实验组的柱形宽水蚤对牟氏角毛藻的摄食率要高于高黏度实验组(图3a、图3b),如果水体环境的黏度不足以对桡足类造成摄食障碍,那么各实验组的柱形宽水蚤的摄食率不会有显著性的差异。
有研究报道,在发生棕囊藻赤潮海域里,桡足类长角宽水蚤的产卵量和繁殖率与食物充实情况下无异[36],但在英吉利海峡,棕囊藻赤潮爆发时间却与该海区浮游动物丰度低值时期重合[37]。钦州湾海域也存在同样的现象,棕囊藻的囊体丰度高值期与该海域优势种桡足类强额孔雀水蚤(Paracalanuscrassirostris)丰度的低值期重合[38], Flamme[36]报道的关于棕囊藻不影响长角宽水蚤产卵量和繁殖量的现象,可以认为是桡足类摄食营养价值更高的原生动物的结果,毕竟相比于浮游植物,原生动物(鞭毛虫、纤毛虫)粒级更大,且具有一定的运动能力,在棕囊藻浓度较高、水体黏度较大的情况下,更加容易被桡足类感知和捕食[39]。而且原生动物可以以棕囊藻细胞为食[40],不太可能因为棕囊藻赤潮的发生而造成丰度下降[41]。
对于棕囊藻赤潮期间观察到浮游动物丰度降低的现象早有报道,比如棕囊藻分泌有害的毒素,产生二甲基硫化物 (Dimethylsulfide,DMS)[5],棕囊藻细胞营养价值低[42]以及囊体胶状结构堵塞捕食者嘴部结构影响摄食[43,44],都可能是其中的原因。就本研究而言,棕囊藻赤潮与浮游动物丰度下降之间的联系可以解释为棕囊藻分泌DOC并凝结形成TEP,进而提高水体黏度[25],紧接着造成浮游动物机械性的摄食障碍,最后可能使得浮游动物饥饿致死。尤其是一些运动能力较弱又急需通过摄食来补充生长发育所需的无节幼虫,它们比桡足类成体更加容易受到水体黏度的摄食抑制[13]。
4 结论
本研究以棕囊藻和柱形宽水蚤作为研究对象,探究棕囊藻赤潮带来的海水黏度变化对桡足类摄食产生的影响。研究结果表明,棕囊藻生长过程中的游离单细胞丰度、囊体丰度、囊体直径与TEP含量、水体黏度都有显著的正相关关系;在棕囊藻培养液和海藻酸钠溶液摄食环境中,水体黏度的提高使得柱形宽水蚤的摄食率下降。整体而论,柱形宽水蚤会受水体黏度的影响而降低对其他浮游植物的摄食,即棕囊藻赤潮造成的海水黏度提高会阻碍桡足类的摄食。

